Введение
Артериальная гипертензия (АГ) остается ведущей причиной сердечно-сосудистой заболеваемости и смертности во всем мире1. Однако помимо непосредственно уровня артериального давления (АД) важную роль в плане прогноза, развития и прогрессирования органных поражений, а в дальнейшем и осложнений АГ играют его колебания за тот или иной временной промежуток, что составляет суть феномена вариабельности АД (ВАД; в некоторых источниках литературы также в качестве синонима предлагается понятие «равномерность» уровня АД) [1–3].
Современные российские [4] и европейские [5] рекомендации по ведению пациентов с АГ подчеркивают прогностическую значимость ВАД и необходимость ее учета при стратификации риска и персонализации антигипертензивной терапии (АГТ).
С точки зрения клинической практики интерес представляет оценка и коррекция краткосрочной ВАД (в течение суток), поскольку, с одной стороны, данный тип колебаний АД аналогичным образом взаимосвязан с неблагоприятным влиянием на органы-мишени АГ (сердце, почки, головной мозг) [6–8], с другой — повышение ВАД в течение суток представляет собой доказанный предиктор развития осложнений и фатальных событий (сердечно-сосудистая смертность, инфаркт миокарда, ишемический и геморрагический инсульты) [9–12]. В частности, показано, что вариабельность систолического АД (САД) в течение суток после поправки на средний уровень САД по данным суточного мониторирования АД (СМАД) статистически значимо ассоциируется с повышением риска смертности от всех причин (на 17%), сердечно-сосудистой смертности (на 23%), а также комбинированной конечной точки в виде больших сердечно-сосудистых событий (сочетание сердечно-сосудистой смертности с нефатальными коронарными событиями, сердечной недостаточностью и нефатальным инсультом) — на 16% [13].
Еще одна причина особого интереса именно к ВАД в течение суток заключается в возможности ее автоматизированной и в известной степени объективной оценке инструментальным методом посредством СМАД как исходно (до назначения антигипертензивных препаратов (АГП)), так и на фоне АГТ [4, 14] с расчетом различных характеризующих ее показателей, среди которых одним из наиболее часто используемых, имеющих предложенные нормативные значения в Российской Федерации [15] и рассчитываемых практически любым суточным монитором АД является стандартное отклонение средних цифр АД за тот или иной промежуток в течение суток — показатель SD (standard deviation). Следует также отметить, что клиническим преимуществом анализа краткосрочнойй (суточной) ВАД служит и возможность получения данных о суточном профиле АД и степени его снижения в пассивный период, которая также рассматривается как один из параметров ВАД и которая взаимосвязана с прогнозом АГ и риском развития осложнений, включая фатальные [14, 16].
Несмотря на хорошо известную неблагоприятную предиктивную значимость повышенной ВАД, ее оценка на практике нередко представляется сложной задачей, поскольку в распоряжении врача традиционно имеется ограниченное и меньшее количество мониторов для выполнения СМАД в сравнении с числом пациентов, обращающихся за медицинской помощью, в силу чего не всегда в короткие сроки от первичного приема удается выполнить данное исследование. Соответственно в такой ситуации возникает потребность в формировании перечня простых клинических признаков, которые на этапе скрининга на АГ могли бы указывать на наличие у пациента повышенной ВАД, и лечащий доктор, выявляя данные признаки, еще до фактического проведения СМАД с большой долей вероятности мог бы подозревать наличие повышенной ВАД и уже в зависимости от этого дифференцированно назначал бы те АГП, которые обладают доказательной базой в отношении коррекции рассматриваемой проблемы. Кроме того, сведения о факторах, указывающих на повышенную ВАД, потенциально могли бы быть применены для дополнительного воздействия на колебания АД в случае, если такие факторы относятся к модифицируемым и могут контролироваться посредством немедикаментозных и медикаментозных воздействий. В доступной литературе обсуждаются [2, 17–23] возможные предикторы повышенной ВАД, однако они мало изучены в российской популяции, в том числе с точки зрения влияния на колебания АД в течение суток.
Цель исследования: изучение факторов, ассоциированных с повышенной ВАД по данным СМАД, у пациентов с эссенциальной АГ I–III стадии.
Содержание статьи
Материал и методы
Этические аспекты. Протокол исследования одобрен независимым этическим комитетом при ФГБОУ ДПО РМАНПО Минздрава России (протокол № 5 от 09.04.2025).
Дизайн исследования. Открытое, одномоментное (поперечное), когортное. В исследование включено 103 пациента с эссенциальной АГ, обратившихся за медицинской помощью в ООО «Скандинавский центр здоровья» (клиническая база кафедры терапии и полиморбидной патологии имени академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России) в период с мая по сентябрь 2025 г.
Критерии включения: пациенты обоего пола 18–59 лет с эссенциальной АГ I–III стадии; наличие подписанного информированного согласия.
Критерии невключения: возраст <18 лет; беременность, в том числе планируемая, лактация; пациенты с АГ 3-й степени (уровень АД ≥180/110 мм рт. ст.); онкологические заболевания; симптоматическая (вторичная) АГ; ожирение 3-й степени (индекс массы тела ≥40 кг/м2); стабильная ишемическая болезнь сердца, перенесенный в анамнезе инфаркт миокарда или инсульт / транзиторная ишемическая атака, кардиомиопатии, наличие жидкости в полости перикарда, хроническая ревматическая болезнь сердца, врожденные или приобретенные пороки сердца, хроническая сердечная недостаточность, персистирующая / длительно персистирующая и постоянная формы фибрилляции предсердий, тромбоэмболия легочной артерии в анамнезе, симптомные заболевания периферических артерий; сахарный диабет 1 и 2 типа; расчетная скорость клубочковой фильтрации (рСКФ) <30 мл/мин/1,73 м2; применение заместительной почечной терапии; длительный прием препаратов, обладающих доказанным нефротоксическим действием (нестероидные противовоспалительные препараты, антибиотики, цитостатики и др.); цирроз печени В или С класса по классификации Чайлд — Пью; наличие системных иммуновоспалительных заболеваний; злоупотребление алкоголем, наркотическими средствами и/или психоактивными веществами; психические и поведенческие расстройства, включая деменцию, которые могут оказать влияние на результаты исследования; участие в любых других клинических исследованиях; отказ дать информированное согласие.
Участникам исследования выполнялись: клинический осмотр, измерение офисного АД согласно клиническим рекомендациям Минздрава России [4], СМАД (монитор ABPM-05 Meditech, Венгрия), клинический анализ крови (гематологический анализатор MEK-7300K, Япония), биохимический анализ крови (биохимические анализаторы RХ-IMOL, ARCHITECT, Великобритания; модульная платформа Roche Cobas 8000 c биохимическим модулем с702, Швейцария), клинический анализ мочи, трансторакальная эхокардиография (ультразвуковой сканер Philips Affinity 50, США), регистрация 12-канальной электрокардиограммы (электрокардиограф ATES DIAGNOSTIC EASY ECG, Россия), биоимпедансный анализ состава тела (анализатор состава тела InBody 230, Республика Корея). Пациенты заполняли опросники на выявление потенциальных факторов повышения ВАД: анкету «Короткий международный опросник для определения физической активности» (International Questionnaire on Physical Activity, IPAQ) [24]; Солевой Опросник НедеЛЬный (опросник СОЛЬ) [25], шкалу воспринимаемого стресса-10 (Perceived Stress Scale, PSS) [26, 27], Питсбургский опросник качества сна [28, 29], шкалу сонливости Эпворта [30].
Исходная характеристика пациентов представлена в таблице 1.
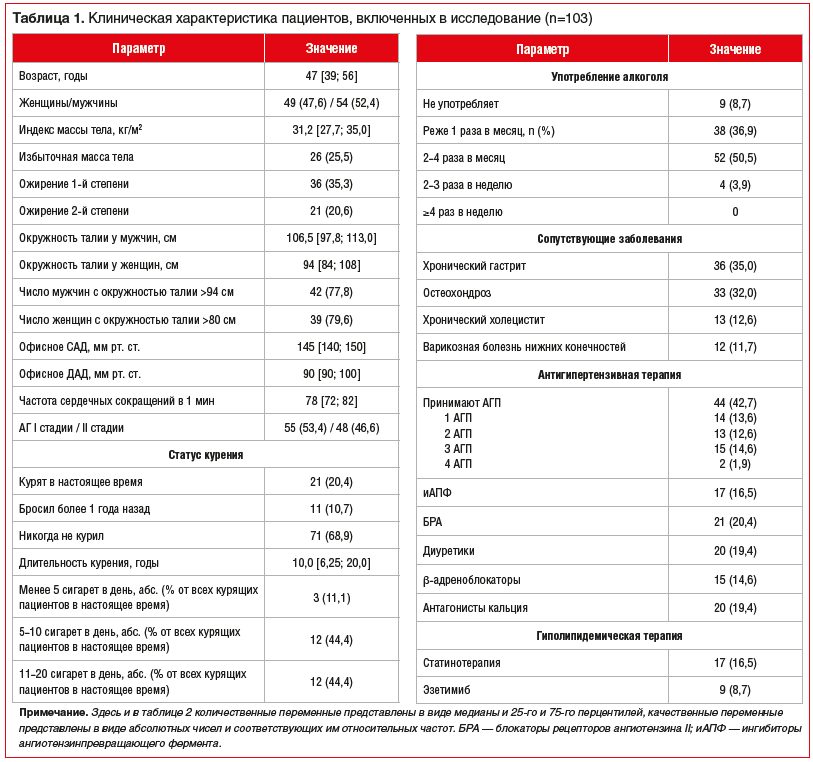
Среди включенных в исследование пациентов в несколько большем количестве (52,4%) были представлены мужчины. Обращает на себя внимание преобладание лиц с ожирением (55,9%), в том числе абдоминальным (по 79,6% среди мужчин и женщин), с 1-й степенью АГ (64,1%). При этом участники исследования в большинстве своем не курили (68,9%) и умеренно употребляли алкоголь. АГП принимали 42,7% участников исследования, наиболее часто используемыми классами препаратов являлись блокаторы рецепторов ангиотензина II (20,4%), антагонисты кальция и диуретики (по 19,4%).
В дальнейшем все пациенты были разделены на 2 группы в зависимости от значений показателя SD по данным проведенного СМАД — группу с повышенной ВАД (n=35) и группу с нормальной ВАД (n=68). Между группами был проведен сравнительный анализ всех клинических, лабораторных и инструментальных показателей, а также результатов заполнения пациентами опросников по физической активности, потреблению соли, уровню воспринимаемого стресса, качеству сна и выраженности сонливости. В качестве критериев повышенной ВАД были избраны референтные значения, предложенные российскими экспертами [15] для показателя SD в активный и пассивный период для САД (в норме не более 15 мм рт. ст. для обоих периодов) и для ДАД (не более 14 и 12 мм рт. ст. соответственно). Пациента относили к группе повышенной ВАД в случае, если хотя бы один из четырех показателей SD выходил за пределы предложенных [15] нормативных значений.
Статистический анализ данных выполнен с использованием программы IBM SPSS Statistics Base 27.0. Нормальность распределения данных оценивали с помощью критерия Шапиро — Уилка. Непрерывные переменные представлены в виде медианы с указанием 25-го и 75-го перцентилей. Достоверность различий между группами анализировали с помощью критерия Манна — Уитни. Для качественных признаков статистическую значимость различий определяли с помощью точного критерия Фишера и критерия χ2. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Данные сравнительного анализа клинических характеристик пациентов в группах повышенной и нормальной ВАД представлены в таблице 2. В группе повышенной ВАД, в сравнении с группой нормальной ВАД, отмечали статистически значимо более высокие значения офисных САД (р=0,001) и ДАД (р=0,022), окружности талии среди мужчин (р=0,010), статистически значимо большее количество мужчин имели окружность талии >94 см (в 100% случаев в группе повышенной ВАД, р<0,001), а также чаще встречался хронический холецистит как сопутствующее заболевание (соответственно в 22,9 и 7,4% случаев, р=0,032) и реже — АГ 1-й степени (р=0,033). Кроме того, в группе нормальной ВАД отмечалась тенденция к более частому применению телмисартана (24%, р=0,093), тогда как в группе повышенной ВАД данный препарат отсутствовал среди назначений. В группе повышенной ВАД наблюдалось более частое применение азилсартана (15,8%), тогда как в группе нормальной ВАД данный препарат применялся в 4% случаев (р=0,266). Также следует отметить, что как в группе повышенной ВАД, так и в группе нормальной ВАД зарегистрирована низкая частота назначения дигидропиридиновых антагонистов кальция (22,9 и 16,1% соответственно).
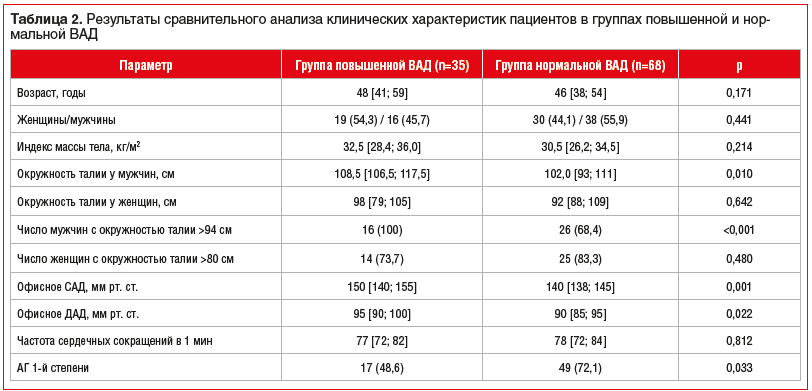
При сравнительном анализе данных лабораторных методов исследования между группами было обнаружено единственное статистически значимое различие: у пациентов с повышенной ВАД наблюдался статистически значимо более высокий уровень триглицеридов в крови (1,60 [1,29; 2,25] и 1,30 [0,97; 1,69] ммоль/л, р=0,028). Иных статистически значимых различий в результатах лабораторных методов исследования не обнаружено.
Данные сравнительного анализа результатов СМАД в группах повышенной и нормальной ВАД представлены в таблице 3. В группе повышенной ВАД отмечались статистически значимо большие значение среднесуточного и среднедневного САД (р=0,005 и р=0,001 соответственно) и закономерно — большие значения всех показателей ВАД (p<0,001). Иных статистически значимых различий в показателях СМАД, включая структуру суточных профилей АД, между группами выявлено не было.
![Таблица 3. Результаты сравнительного анализа данных СМАД в группах повышенной и нормальной ВАД, Me [25%; 75%] Таблица 3. Результаты сравнительного анализа данных СМАД в группах повышенной и нормальной ВАД, Me [25%; 75%]](https://medblog.su/wp-content/uploads/2026/01/1768446810_4_Povyshennaya-variabelnost-arterialnogo-davleniya-v-techenie-sutok-i-vozmozhnosti-ee.png)
По данным проведенной эхокардиографии в группе повышенной ВАД установлены статистически значимо (р=0,049) более высокие значения индекса массы миокарда левого желудочка (иММЛЖ) (45,4 [36,0; 53,9] г/м2,7) в сравнении с группой нормальной ВАД (38,4 [32,6; 48,1] г/м2,7). Иных статистически значимых различий в результатах эхокардиографии, а также данных биоимпедансного анализа состава тела и результатах заполнения пациентами опросников обнаружено не было.
Обсуждение
В настоящем исследовании выявлено, что у пациентов с АГ при наличии повышенной краткосрочной ВАД, рассчитанной на основании СМАД в виде SD, выше уровень офисного САД и ДАД, а также выше уровень среднесуточного и среднедневного САД. Подобные результаты могут иллюстрировать факт того, что в реальной клинической практике пациентам не назначается рациональная АГТ, в силу чего пациенты не достигают целевого уровня АД и имеют повышенную ВАД, что в дальнейшем закономерно может вести к поражению органов-мишеней, а также ассоциироваться с неблагоприятными исходами, поскольку на сегодняшний день подтверждена неблагоприятная роль как непосредственно уровня АД, так и его колебаний [4]. В частности, показана взаимосвязь повышенной краткосрочной ВАД в течение суток с увеличением иММЛЖ (иными словами, выраженности органного поражения сердца в виде гипертрофии левого желудочка), в том числе у лиц молодого возраста [6, 7], ростом уровня креатинина и снижением СКФ [6], утолщением комплекса интима-медиа сонных артерий [8, 9], повышением скорости каротидно-феморальной пульсовой волны и другими маркерами роста жесткости магистральных артерий [10, 11], развитием атеросклероза [31], а также субклиническим поражением головного мозга в виде увеличения количества гипер-интенсивных очагов белого вещества [12], по своей сути являющихся зонами демиелинизации и представляющих собой один из морфологических элементов формирования когнитивных нарушений, ассоциированных с наличием АГ. Здесь следует отметить, что в настоящее время доказанным фактом служит роль повышенной ВАД в развитии когнитивных нарушений, причем безотносительно к абсолютной величине АД, и более того, исследователи высказывают мнение о том, что выполнение СМАД с оценкой показателей ВАД может служить одним из инструментов для дифференцированного выбора тактики ведения пациентов с АГ с позиций церебропротекции [13].
Следовательно, данные результаты указывают на потребность в реальной клинической практике совершенствования стратегий АГТ с фокусом как на достижение целевых значений АД, так и, безусловно, на коррекцию ВАД, которую, как показывает настоящее исследование, практикующие специалисты нередко упускают из поля зрения, ввиду чего не назначают препараты с доказанным сверхдлительным антигипертензивным эффектом и способностью нивелировать повышенную ВАД (в частности, телмисартан [32–34], либо такие препараты используются недостаточно широко, как в случае с дигидропиридиновыми антагонистами кальция, которые в настоящем исследовании в группе повышенной ВАД были назначены менее чем у четверти пациентов, в то время как АГТ именно с включением данного класса АГП демонстрирует [35] наилучшие результаты в снижении ВАД и обеспечении равномерного контроля АД.
В настоящем исследовании также выявлено, что в группе повышенной ВАД, в сравнении с группой нормальной ВАД, отмечались статистически значимо более высокие значения иММЛЖ, что указывает на более выраженное поражение сердца как органа-мишени АГ в условиях повышенной ВАД. Такие результаты согласуются с имеющимися в доступной литературе данными о взаимосвязи повышенной ВАД с ростом иММЛЖ [7, 36].
В частности, это было продемонстрировано в специальном анализе исследования Coronary Artery Risk Development in Young Adults (CARDIA) [36], в котором, в отличие от нашей работы, изучалась долгосрочная (межвизитная) ВАД, а в качестве ее характеристик выступали SD и «средняя реальная вариабельность» (average real variability, ARV), а также «вариабельность, независимая от средних» (variability independent of the mean, VIM). Само исследование CARDIA [37] было инициировано в 1985 г. с целью изучения на популяционном уровне факторов риска сердечно-сосудистых заболеваний у молодых лиц в возрасте 18–30 лет, а период наблюдения достигал 30 лет. В рассматриваемый субанализ [36] вошло 2400 человек (42,7% — мужчины, средний возраст в конце наблюдения 50,4 года), у которых имелись данные об уровне офисного АД на контрольных визитах на 2, 5, 7, 10, 15, 20, 25-м году наблюдения, а также результаты эхокардиографии, выполненной через 25 лет после включения в исследование. В рамках исследования было установлено, что вариабельность как САД, так и ДАД статистически значимо ассоциирована с увеличением иММЛЖ согласно результатам линейного регрессионного анализа. В частности, после поправки на возраст, пол, расу, уровень образования, индекс массы тела, статус курения, уровень физической активности, уровень глюкозы натощак, уровень общего холестерина, уровень холестерина липопротеинов высокой плотности, использование АГП и средний уровень САД, увеличение вариабельности САД (по показателю SD) на 1 SD было ассоциировано с увеличением иММЛЖ на 3,47 г/м2 (p<0,001), а увеличение вариабельности ДАД — на 3,57 г/м2 (p<0,001). Аналогичные статистически значимые взаимосвязи с иММЛЖ были получены для ARV и VIM. В литературе имеется и единичное описание [7] ассоциированности вариабельности ДАД в дневное время (как мера вариабельности использовался коэффициент вариации) с ростом иММЛЖ.
В качестве возможных механизмов развития и потенцирования гипертрофии миокарда левого желудочка при повышенной ВАД обсуждаются различные процессы, включая значимость сопутствующих сосудистых изменений как посредника в этих взаимодействиях [6, 36]. Так, в экспериментальных условиях [38] при повышенной ВАД было продемонстрировано формирование десенситизации β2-адренорецепторов, которые играют важную роль в релаксации крупных артерий. В условиях колебаний АД циклическое механическое воздействие на сосудистую стенку может стимулировать пролиферацию гладкомышечных клеток сосудов, отложение в их стенках компонентов внеклеточного матрикса с профибротическими сдвигами и повышением жесткости. В таких условиях магистральные артерии теряют способность демпфировать кинетическую энергию работы сердца, т. е., растягиваясь, «гасить» пульсативные колебания давления крови, обусловленные сердечной деятельностью, и преобразовывать кровоток из имеющего выраженную фазность в виде существенного роста в фазу изгнания из левого желудочка и выраженного падения в диастолу в непрерывный ламинарный ток крови, необходимый для нормальной перфузии органов и тканей и защиты их от избыточных колебаний АД. В такой ситуации увеличение жесткости артерий будет повышать ВАД, а увеличение ВАД в свою очередь будет способствовать дальнейшему росту артериальной жесткости [36]. Изменения механических свойств артериальной стенки создают дополнительную нагрузку давлением и периферическим сосудистым сопротивлением на левый желудочек, что ведет к его компенсаторному ремоделированию с развитием гипертрофии [36].
Повышенная ВАД может также оказывать прямое влияние на структуру и функцию сердца, вероятно, посредством дополнительных механизмов, требующих изучения [39]. Так, согласно экспериментальным данным, когда проводилась денервация синусового узла с целью индукции повышения ВАД без сопутствующего увеличения уровня АД per se, отмечалось развитие периваскулярной инфильтрации макрофагами, фиброза и гипертрофии миокарда и последующей систолической дисфункции сердца. Также в литературе обсуждается [40] возможный стимулирующий эффект повышенной ВАД в отношении образования непосредственно в миокарде хемотаксического белка моноцитов-1 и трансформирующего фактора роста β, которые способствуют пролиферации и апоптозу клеточных элементов при участии ренин-ангиотензин-альдостероновой системы (РААС), в итоге приводя к формированию гипертрофии миокарда левого желудочка.
В нашем исследовании также обнаружено, что в группе повышенной ВАД, в сравнении с группой нормальной ВАД, у мужчин наблюдались статистически значимо более высокие значения окружности талии и статистически значимо большее количество мужчин имело абдоминальное ожирение согласно величине окружности талии, и в целом в первой группе наблюдались статистически значимо более высокий уровень триглицеридов в крови, а также более высокая распространенность хронического холецистита.
Подобные результаты, на наш взгляд, с одной стороны, отражают хорошо известный и закрепленный на уровне клинических рекомендаций2 [4] факт того, что мужской пол представляет собой установленный фактор сердечно-сосудистого риска, а с другой — подчеркивают не меньшую значимость кардиометаболического нездоровья и ожирения как междисциплинарной, в том числе кардиологической, проблемы [41–43]. Кроме того, не исключено, что дополнительным фактором, опосредующим неблагоприятные взаимодействия висцерального ожирения и патологии сердечно-сосудистой системы в группе повышенной ВАД (с учетом более высокого уровня триглицеридов в крови и большей распространенности холецистита), может служить неалкогольная жировая болезнь печени, которая на сегодняшний день входит в число сердечно-сосудистых факторов риска, но, несмотря на это, к сожалению, до сих пор весьма редко выносится в самостоятельный диагноз по результатам осмотра пациента3.
Взаимосвязь повышения ВАД в течение суток с наличием у пациента ожирения (как конституционального согласно индексу массы тела (ИМТ), так и висцерального согласно величине окружности талии и/или значению отношения окружность талии / окружность бедер) была подтверждена в кросс-секционном исследовании A.M.N. de Souza et al. [44], в которое вошло 812 человек (средний возраст 51 год, мужчин — 50%), проходивших скрининговое обследование в клиниках Бразилии в рамках программы изучения эпидемиологии сердечно-сосудистых заболеваний и сахарного диабета. Избыточную массу тела имели 64,9% участников, абдоминальное ожирение согласно измерению окружности талии — 77,1%, согласно значению отношения окружность талии / окружность бедер — 81,0%. В качестве меры ВАД использовали показатель SD по данным СМАД. После поправки на средний уровень АД, возраст, пол, расу, уровень образования, использование АГП, физическую активность и употребление алкоголя, избыточная масса тела и абдоминальное ожирение (согласно окружности талии и отношения окружность талии / окружность бедер) положительно ассоциировались с вариабельностью САД во время сна (коэффициенты гамма-регрессии соответственно 0,80, 0,74 и 0,59), а также с вариабельностью ДАД за сутки (коэффициенты гамма-регрессии соответственно 0,64, 0,73 и 0,58), вариабельностью ДАД в активный период (коэффициенты гамма-регрессии соответственно 0,50, 0,52 и 0,52) и вариабельностью ДАД во время сна (коэффициенты гамма-регрессии соответственно 0,53, 0,45 и 0,49). Имеются и другие данные [45, 46], подтверждающие взаимосвязь ожирения с повышением ВАД в течение суток.
Обсуждается множество механизмов, посредством которых в условиях ожирения создаются предпосылки для повышения ВАД [45–47]. Ключевым звеном является гиперактивация РААС и симпатоадреналовой нервной системы в условиях инсулинорезистентности, ассоциированной с ожирением, а также секреции жировой тканью широкого спектра адипокинов, обладающих способностью к дополнительной стимуляции данных систем, потенцирования системного воспаления низкой степени выраженности и дополнительного усугубления предсуществующих нарушений углеводного, липидного обмена и пищевого поведения, что в конечном счете сказывается как на повышении ВАД, так и на снижении эффективности АГТ и в еще большей степени усугубляет ассоциированный сердечно-сосудистый риск, а также способствует дальнейшему набору массы тела (как в условиях лептинорезистентности, так и на фоне формирующейся невосприимчивости к сигналам инсулина, в результате чего глюкоза не поступает в ткани и развивается «глюкозное голодание» тканей) [48–50].
Следует отметить, что висцеральная жировая ткань обладает собственной полноценной РААС [51]. Адипоциты экспрессируют ангиотензиноген, ренин, рецепторы к ангиотензину II и ангиотензинпревращающий фермент. При висцеральном ожирении продукция этих компонентов резко возрастает, приводя к увеличению локального и системного уровня ангиотензина II. Последний не только вызывает мощную вазоконстрикцию и задержку натрия, но и потенцирует высвобождение норадреналина из пресинаптических нервных окончаний, усиливая симпатическую активацию [52]. Кроме того, ангиотензин II стимулирует процессы фиброза и гипертрофии гладкомышечных клеток сосудов, способствуя увеличению их жесткости, что является ключевым фактором повышения систолической ВАД [52].
Висцеральный жир является мощным источником хронического системного воспаления и оксидативного стресса [53]. Адипоциты и макрофаги секретируют провоспалительные цитокины, такие как фактор некроза опухоли α и интерлейкин 6 [53]. Данные молекулы, а также избыток свободных жирных кислот подавляют синтез и биодоступность ключевого вазодилататора — оксида азота (NO) путем ингибирования активности эндотелиальной NO-синтазы и увеличения продукции активных форм кислорода [54]. Возникающая эндотелиальная дисфункция нарушает способность сосудов к адекватной и быстрой вазодилатации в ответ на изменения кровотока и стрессовые стимулы, что закономерно ведет к увеличению колебаний АД и повышению ВАД.
Дополнительным фактором, влияющим в условиях ожирения как на формирование ночной АГ в принципе, так и на увеличение ВАД в пассивный период в частности, служит синдром обструктивного апноэ сна [45]. Повторяющиеся эпизоды обструкции дыхательных путей приводят к интермиттирующей гипоксемии и гиперкапнии, которые являются мощными стимулами для активации хеморецепторов, симпатической нервной системы, а затем и РААС [45]. Это вызывает резкие подъемы АД в ответ на каждый эпизод апноэ, дестабилизируя ночной профиль АД и приводя к повышению ВАД и формированию ночной АГ, имеющей крайне неблагоприятное значение для риска развития сердечно-сосудистых осложнений [55].
Следует отметить, что упоминавшийся выше блокатор рецепторов ангиотензина II первого типа телмисартан, помимо своих непосредственных выраженных антигипертензивных свойств и способности обеспечивать равномерный, стабильный контроль АД на протяжении суток с нивелированием ВАД, обладает дополнительными преимуществами в лечении пациентов, имеющих нарушения углеводного и липидного обмена, в том числе ассоциированные с ожирением [56]. Важной особенностью телмисартана, выделяющей его в классе сартанов, служит высокая липофильность, которая, с одной стороны, обеспечивает блокаду РААС (не только в кровотоке, но и на уровне тканей, что имеет принципиальное значение для защиты органов-мишеней за рамками непосредственно контроля АД), а с другой — открывает для молекулы дополнительный путь взаимодействия с PPAR-γ (Peroxisome proliferator-activated receptors γ; рецепторы γ, активируемые пероксисомными пролифераторами), что в свою очередь сопровождается дополнительным благоприятным влиянием на углеводный и липидный обмен [57, 58].
PPAR как класс представляют собой рецепторы, выполняющие функции на уровне ядра клеток и одновременно являющиеся транскрипционными факторами, т. е. когда с рецептором связывается специфическая молекула-активатор, рецептор начинает оказывать влияние на процесс транскрипции в ядре [59]. Поскольку данные рецепторы находятся внутри клетки, уникальная особенность молекулы телмисартана в виде его высокой липофильности открывает перед ним возможности проникать через мембрану клетки и связываться с γ-подтипом указанных рецепторов.
Согласно данным последних лет [60] в классе блокаторов рецепторов ангиотензина II телмисартан проявляет наилучшую способность в отношении стимуляции PPAR-γ. В исследовании [60], где сравнивались константы диссоциации из комплекса с PPAR-γ для различных сартанов (т. е. оценивалась способность выходить из связи с PPAR-γ; чем больше константа, тем активнее молекула выходит из взаимодействия с PPAR-γ), телмисартан продемонстрировал наибольшую силу взаимодействия с данным рецептором. Для сравнения: константа диссоциации для азилсартана >100 мкмоль, тогда как для телмисартана — 0,34±0,04 мкмоль, т. е., иными словами, связь «телмисартан — PPAR-γ» практически в 300 раз прочнее, чем таковая у азилсартана. Одним из объяснений такого высокого сродства телмисартана к PPAR-γ может служить тот факт, что атом азота центрального бензимидазольного кольца молекулы телмисартана образует водородную связь с остатком тирозина в 473-м положении (Tyr473) рецептора PPAR-γ, и это, по-видимому, имеет принципиальное значение для стимуляции рецептора [60]. В отличие от этого другие блокаторы рецепторов ангиотензина II не могут так надежно связываться с PPAR-γ и образовывать водородную связь с Tyr473, как телмисартан [60].
PPAR-γ присутствуют в адипоцитах, эпителии кишечника, эндотелии сосудов, скелетной мускулатуре (с точки зрения углеводного обмена это важно, поскольку миоциты в норме захватывают глюкозу из крови, превращают в гликоген, тем самым контролируя гликемию), в печени (которая аналогичным образом принимает участие в углеводном обмене, а также поддерживает липидный баланс), селезенке (селезенка принимает участие в процессах кроветворения — с наличием PPAR-γ в ней может быть связана регуляция активности клеток крови, участвующих в процессах воспаления) и клетках крови (в частности, в лимфоцитах, макрофагах, которые принимают участие в развитии воспалительной реакции) [59]. PPAR-γ модулируют многие биологические функции, включая метаболизм жирных кислот и глюкозы, противовоспалительные каскады биохимических процессов [59]. Они также подавляют окислительный стресс и предотвращают взаимодействие тромбоцитов и лейкоцитов, тем самым контролируя воспаление и активацию тромбоцитов, которая, например, может служить начальным этапом в образовании тромба [59]. PPAR-γ представлены и в β-клетках поджелудочной железы, активация данных рецепторов защищает эти клетки от нарушения функции (в виде дефектов синтеза инсулина), повреждения и гибели, а также способствует стимуляции считывания гена транспортера глюкозы типа 2 (GLUT2), что повышает чувствительность клеток поджелудочной железы к гипергликемии и запускает инициальные звенья каскада продукции инсулина [61].
PPAR-γ также представлены в белой и бурой жировой ткани [62]. С точки зрения метаболического нездоровья важно подчеркнуть, что в отличие от адипоцитов белой жировой ткани, которые содержат крупные однокамерные липидные капли, заполняющие цитоплазму, адипоциты бурой жировой ткани содержат многокамерные липидные капли и большое количество митохондрий для рассеивания энергии посредством разобщения дыхательной цепи в них [62]. Проще говоря, в бурой жировой ткани происходит утилизация (расщепление) липидов и глюкозы с превращением их в митохондриях в тепло, т. е. по сути бурая жировая ткань способствует снижению избытка липидов и глюкозы, рассеивая их в виде тепловой энергии [62].
Телмисартан в исследованиях доказал свою способность снижать уровень глюкозы крови, концентрацию свободного инсулина в плазме, инсулинорезистентность и уровень гликированного гемоглобина, уменьшать содержание в крови общего холестерина, холестерина липопротеинов низкой плотности, триглицеридов (которые как раз имели статистически значимо более высокое значение в группе повышенной ВАД в нашей работе) и повышать уровень антиатерогенных липопротеинов высокой плотности [63–66].
С точки зрения эффектов, которые телмисартан оказывает на жировую ткань и в целом на пациента, имеющего ожирение, необходимо сказать о том, что согласно имеющимся данным рассматриваемый препарат через PPAR-γ способен оказывать благоприятное влияние на метаболический профиль висцерального жира, стимулируя переход белой жировой ткани в фенотип бурой, что, как указано выше, метаболически выгодно для пациента и в литературе носит название «браунинг белой жировой ткани» [56]. Кроме того, современные данные свидетельствуют о возможности взаимодействия телмисартана с рецепторами меланокортина, благодаря чему реализуется дополнительный эффект противодействия ожирению, а также открыта возможность взаимодействия телмисартана с калиевыми каналами CD4+-лимфоцитов (T-хелперов), что обеспечивает сопутствующее подавление процессов вялотекущего системного воспаления в условиях кардиометаболического нездоровья и ожирения, ассоциированных с АГ и повышенной ВАД [56].
На сегодняшний день, согласно действующим клиническим рекомендациям, в терапии АГ приоритет имеет комбинированная АГТ начиная со старта лечения, причем предпочтение отдается фиксированным комбинациям (ФК) или, по-другому, «стратегии одной таблетки» [4]. Одним из возможных вариантов такой стратегии может служить назначение комбинации блокатора рецепторов ангиотензина II и антагониста кальция. В силу высокой клинической значимости проблемы ВАД и, как демонстрируют результаты нашего исследования, недостаточного использования при повышенной ВАД АГП, обладающих доказанной способностью контролировать данный фактор сердечно-сосудистого риска, а также частого сочетания повышенной ВАД с ожирением и метаболическими нарушениями, представляется целесообразным обратить внимание на наличие на российском рынке ФК амлодипин + телмисартан (Телмиста® АМ, «КРКА», Словения) — союза двух молекул сверхдлительного действия, где антигипертензивный эффект телмисартана усилен антагонистом кальция. Как упоминалось выше, именно АГТ с включением данной группы препаратов имеет наилучший потенциал в вопросе снижения повышенной ВАД и обеспечения равномерного контроля АД [35].
Фиксированная комбинация амлодипин + телмисартан доказала свою возможность в снижении ВАД в течение суток в широком спектре исследований [67–73], благодаря чему может рекомендоваться как непосредственно при наличии повышенной ВАД, так и при выявлении у пациента упомянутых выше факторов, указывающих на вероятное наличие данного прогностически неблагоприятного феномена. Отличительной особенностью препарата Телмиста® АМ служит наличие собственной доказательной базы в рамках реальной клинической практики, где продемонстрированы возможности препарата, в том числе в снижении ВАД в течение суток [74–76].
В российском исследовании SMART [74] оценивали эффективность и переносимость ФК телмисартана у пациентов с АГ в сочетании с метаболическим синдромом и без метаболических нарушений. Через 12 нед. приема комбинации телмисартана и амлодипина (Телмиста® АМ) в группе АГ без метаболических нарушений целевого уровня САД <140 мм рт. ст. достигли 92% пациентов, целевого уровня ДАД — 96% пациентов. Через 12 нед. приема комбинации телмисартана и амлодипина в группе АГ в сочетании с метаболическим синдромом целевого уровня САД <140 мм рт. ст. достигли 89% пациентов, целевого уровня ДАД <90 мм рт. ст. — 93% пациентов. Подавляющее большинство врачей и пациентов (97–98%) оценили эффективность и переносимость ФК телмисартана как хорошую и очень хорошую. Серьезных нежелательных явлений зафиксировано не было.
В наблюдательном исследовании ON TIME [75] изучали клиническую эффективность и переносимость АГТ ФК на основе телмисартана у пациентов с АГ в клинической практике. В наблюдательное многоцентровое исследование было включено 13 647 пациентов (57,6% — женщины, средний возраст 59,3±11,4 года) с АГ 1–3-й степени, которые получали терапию фиксированной комбинацией амлодипин + телмисартан (Телмиста® АМ) или гидрохлоротиазид + телмисартан. В ходе наблюдения проводили сбор жалоб, анамнеза, в том числе данных о ранее получаемой терапии и о перенесенной в течение предшествующего года новой коронавирусной инфекции (COVID-19); проводили измерение роста, массы тела, окружности талии и бедер. Также трижды с интервалом 4 нед. измеряли офисное АД, заполняли опросник удовлетворенности терапией по шкале Лайкерта. Приверженность терапии оценивали со слов пациента. Отмечено статистически значимое снижение САД и ДАД от визита к визиту как в целом по группе, так и при раздельном анализе для каждой степени АГ (р<0,001 между визитами во всех случаях). Степень снижения АД зависела от исходных цифр. К 3-му визиту для 1-й степени АГ среднее снижение САД/ДАД составило 24,5/14,6 мм рт. ст., для 2-й степени — 34,4/16,8 мм рт. ст., для 3-й степени — 49,6/22,1 мм рт. ст. (р<0,001 между группами). Достигли целевого уровня, соответствующего 1-му шагу (САД ≤140 мм рт. ст. и ДАД ≤90 мм рт. ст.), 95,3 и 98,1% пациентов соответственно. Целевого уровня САД, соответствующего 2-му шагу (≤130 мм рт. ст.), достигли 74,9% пациентов, ДАД (≤80 мм рт. ст.) — 78,2%. Окружность талии уменьшилась на 0,5%, окружность бедер — на 1,5%, масса тела — на 0,42% (р<0,001 во всех случаях). Показатели пациентов, перенесших COVID-19, не отличались от показателей лиц, не переносивших его. К 3-му визиту у 94% пациентов практически полностью отсутствовали нарушения режима терапии. Подавляющее большинство врачей и пациентов были «удовлетворены» или «полностью удовлетворены» клиническим эффектом, удобством и переносимостью терапии. Нежелательные явления наблюдались всего у 1,35% пациентов.
В серии клинических наблюдений STABILITY 24 [76] у пациентов с неконтролируемой АГ на фоне ранее применявшейся моно- или двухкомпонентной АГТ оценивали эффективность перевода на ФК телмисартан + амлодипин (Телмиста® АМ). Контроль АД осуществлялся как с помощью офисных измерений, так и методом СМАД. Уже через 1 мес. после перевода на указанную комбинацию у всех пациентов зафиксировано статистически значимое снижение среднедневных и средненочных показателей САД и ДАД с достижением и устойчивым удержанием целевых значений. Дополнительно в рамках СМАД проводился анализ динамики индекса сглаживания — параметра, отражающего степень стабильности антигипертензивного действия препарата и указывающего на снижение ВАД [34, 68, 77]. У всех пациентов значения индекса сглаживания в конце наблюдения (спустя 4 нед.) превышали 1, что свидетельствует о выраженном и продолжительном гипотензивном эффекте терапии. Таким образом, применение ФК амлодипин + телмисартан в условиях реальной клинической практики подтвердило ее высокую эффективность в снижении как АД, так и ВАД, что позволяет рекомендовать данный препарат широкому кругу пациентов с АГ для достижения целевых уровней давления и улучшения прогноза заболевания.
Следует также отметить, что в силу высокой актуальности и неблагоприятной прогностической значимости повышенной ВАД в настоящее время в Российской Федерации проводится исследование, целью которого является анализ частоты достижения целевого АД и динамики параметров СМАД на фоне АГТ с применением ФК телмисартан + амлодипин (Телмиста® АМ) у пациентов с эссенциальной АГ, включая анализ роли факторов риска повышенной ВАД.
Заключение
Таким образом, проведенное нами исследование указывает на недостаточное внимание к проблеме ВАД в реальной отечественной клинической практике с не всегда рациональным подходом к назначению АГТ, ввиду чего по факту в достаточно большом количестве случаев наблюдается сочетание неконтролируемой АГ с повышенной ВАД. Кроме того, результаты работы подтверждают широкую распространенность ожирения с сопутствующим нарушением липидного профиля в условиях повышенной ВАД и более частого ее сочетания с органными поражениями, в частности с гипертрофией левого желудочка, что закономерно повышает сердечно-сосудистый риск. Вместе с тем в нашем распоряжении имеются современные и доступные АГП, которые полностью соответствуют требованиям актуальных клинических рекомендаций и способны обеспечить как контроль АД и снижение ВАД, так и дополнительные благоприятные эффекты на липидный профиль, углеводный обмен и проблему висцерального ожирения и тем самым принести пациенту с АГ и повышенной ВАД дополнительную пользу в аспекте улучшения прогноза. К числу таких препаратов относится ФК телмисартан + амлодипин, которая рекомендуется широкому кругу пациентов с АГ в качестве АГТ первой линии, особенно при наличии повышенной ВАД.
1WHO Global report on hypertension: the race against a silent killer. (Electronic resource.) URL: https://reliefweb.int/report/world/global-report-hypertension-race-against-silent-killer (access date: 04.11.2025).
2Клинические рекомендации. Стабильная ишемическая болезнь сердца. 2024. (Электронный ресурс.)URL: https://cr.minzdrav.gov.ru/view-cr/155_2 (дата обращения: 04.11.2025).
3Клинические рекомендации. Неалкогольная жировая болезнь печени. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/748_2 (дата обращения: 04.11.2025).
Информация с rmj.ru


