Введение
Ревматоидный артрит (РА) — хроническое иммуновоспалительное (аутоиммунное) заболевание неизвестной этиологии, проявляющееся хроническим эрозивным артритом, системным поражением внутренних органов, широким спектром коморбидных заболеваний, ранней инвалидизацией и сокращением продолжительности жизни пациентов [1].
Изучение патогенеза РА способствовало разработке широкого спектра новых лекарственных препаратов, прежде всего генно-инженерных биологических препаратов (ГИБП), ингибирующих патологическую активацию клеток иммунной системы (Т- и В-лимфоцитов) и провоспалительных цитокинов, а также таргетных синтетических базисных противовоспалительных препаратов (БПВП), регулирующих синтез медиаторов воспаления.
Согласно современным зарубежным и российским рекомендациям ГИБП и ингибиторы янус-киназ (JAK, Janus kinase) назначают больным РА, как правило, при недостаточной эффективности или непереносимости стандартных БПВП [2–4]. Применение новых инновационных препаратов позволяет замедлить прогрессирование болезни, достигнуть ремиссии или снижения активности заболевания и повысить качество жизни пациентов.
Особое место в терапии РА занимают ингибиторы JAK, участвующие в передаче цитокин-опосредованного сигнала и являющиеся внутриклеточным интегральным компонентом сигнального пути JAK — STAT [5]. В зависимости от селективности к изоформам JAK препараты условно подразделяются на неселективные ингибиторы JAK (барицитиниб (БАРИ), тофацитиниб (ТОФА)) [6, 7] и селективные ингибиторы JAK (упадацитиниб (УПА)) [8].
Одно из последних достижений в лечении РА — создание препарата олокизумаб (ОКЗ). Это первый российский антагонист ИЛ-6, блокирующий сигнальные пути на этапе финальной сборки гексамерного комплекса ИЛ-6, ИЛ-6Р, gp130 [9, 10].
Эффективность и безопасность ТОФА, УПА и ОКЗ в терапии РА были продемонстрированы на всех этапах клинических исследований [7, 11–15], а также в реальной клинической практике [16–20]. Однако в настоящее время отсутствуют прямые рандомизированные исследования, в которых сравнивается эффективность ТОФА, УПА и ОКЗ при РА.
Цель исследования: провести непрямой сравнительный анализ динамики клинико-лабораторных показателей воспалительной активности заболевания у больных РА на фоне лечения ТОФА, УПА, ОКЗ в реальной клинической практике.
Содержание статьи
Материал и методы
Проведено нерандомизированное клиническое исследование с проспективным включением пациентов. Протокол и дизайн исследования одобрены локальным этическим комитетом ГБОУ ВО ЯГМА Минздрава России (протокол № 1 от 29.01.2015 и протокол № 44 от 13.04.2021).
В исследовании приняли участие 30 пациентов с установленным по критериям ACR/EULAR (2010 г.) диагнозом РА, развернутой стадией заболевания.
Критерии включения в исследование: установленный диагноз РА, умеренная или высокая активность заболевания, неэффективность предшествующей терапии БПВП (метотрексат, лефлуномид) или ГИБП в течение не менее 6 мес., подписанное информированное согласие на участие в исследовании.
Критерии невключения в исследование: планирование беременности и период грудного вскармливания; активная тяжелая инфекция, включая локализованные инфекции; противопоказания для инициации терапии ТОФА, УПА, ОКЗ.
Лечение ТОФА, УПА, ОКЗ назначалось в соответствии с показаниями, утвержденными в инструкции по медицинскому применению препарата, и решением лечащего врача.
Клиническое обследование включало оценку числа болезненных суставов (ЧБС) и числа припухших суставов (ЧПС), общую оценку состояния здоровья больным и врачом по визуальной аналоговой шкале (ВАШ) (от 0 до 100 мм), подсчет индексов Disease Activity Score-28 (DAS28-СОЭ), Simple Disease Activity Index (SDAI), Clinical Disease Activity Index (СDAI), Health Assessment Questionnaire–Disability Index (HAQ-DI) и оценку лабораторных показателей: уровня С-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ), ревматоидного фактора (РФ) IgM, антител к циклическим цитруллинированным пептидам (АЦЦП).
Пациентов распределили в группы: в группу ТОФА включили 10 пациентов, которые получали ТОФА в дозе 5 мг 2 р/сут, пациенты группы УПА (n=10) принимали УПА по 15 мг 1 р/сут, группу ОКЗ составили 10 пациентов, которым был назначен ОКЗ в дозе 64 мг подкожно каждые 4 нед. Клиническая характеристика пациентов представлена в таблице 1.
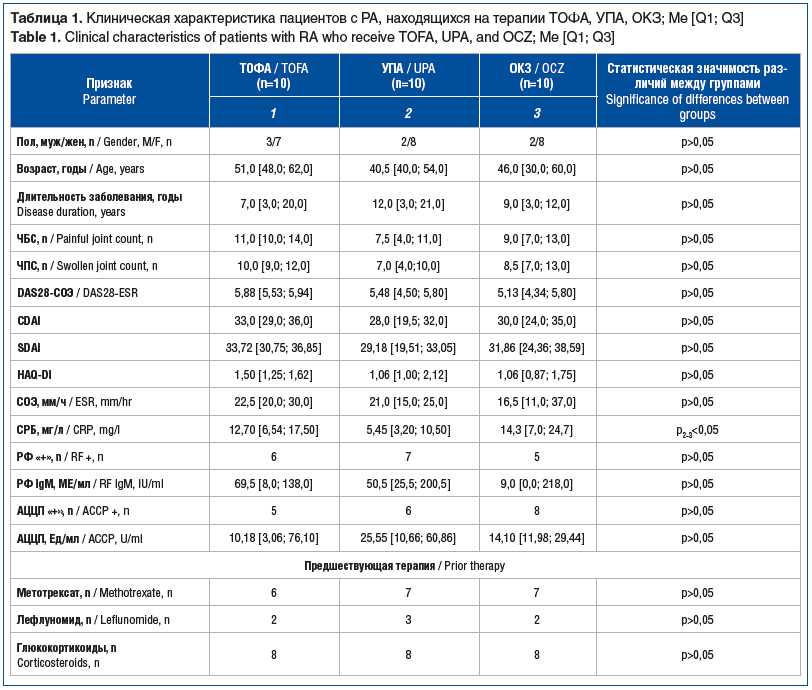
Пациенты трех групп не различались между собой по полу, возрасту, длительности РА, выраженности боли, ЧБС, ЧПС, DAS28-СОЭ, CDAI, SDAI, HAQ-DI, серопозитивности по РФ IgM и/или АЦЦП, выраженности функциональных ограничений по индексу HAQ-DI, СОЭ (р>0,05). Однако у пациентов группы УПА при включении в исследование значения СРБ оказались значимо ниже (p<0,05) таковых в группе ОКЗ.
Большинство обследованных пациентов ранее принимали БПВП (метотрексат, лефлуномид), глюкокортикоиды (в дозе до 10 мг/сут в пересчете на преднизолон) и НПВП по потребности. Значимых различий в предшествующей терапии в сравниваемых группах не отмечено (р>0,05).
Результаты лечения оценивали по динамике общепринятых клинических индексов и лабораторных показателей. Для оценки эффективности лечения использовали критерии EULAR [4]. Пациенты обследованы до лечения, через 3 и 6 мес. терапии.
Концентрацию СРБ и РФ IgM в сыворотке крови измеряли иммунотурбидиметрическим методом с использованием наборов (Diasys, Германия) на анализаторе Sapphire 400 (TOKYO BOEKI MEDISYS Inc., Япония). Количество АЦЦП в сыворотке крови определяли методом иммуноферментного анализа (ИФА) с помощью коммерческих наборов («ОМНИКС», Россия). Сывороточный уровень ИЛ-6 исследовали с помощью мультиплексной технологии хMАР на анализаторе Bio-PlexTM 200 System (BIO-RAD, США).
Статистическую обработку результатов проводили с использованием пакета программ Stаtistica 10.0 (StatSoft, США), включая общепринятые методы параметрического и непараметрического анализа. Для определения достоверности изменений переменных в динамике (связанные выборки) использовали критерий Уилкоксона. Для сравнения параметров несвязанных (независимых) групп использовали критерии Манна — Уитни и Краскела — Уоллиса. Результаты представлены в виде медианы (Ме) и нижнего и верхнего квартилей [Q1; Q3] среднего значения (М) и стандартного отклонения (SD). Корреляционный анализ проводили по методу Спирмена. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Изменения клинических показателей у пациентов с РА на фоне терапии ТОФА, УПА, ОКЗ представлены в таблице 2.
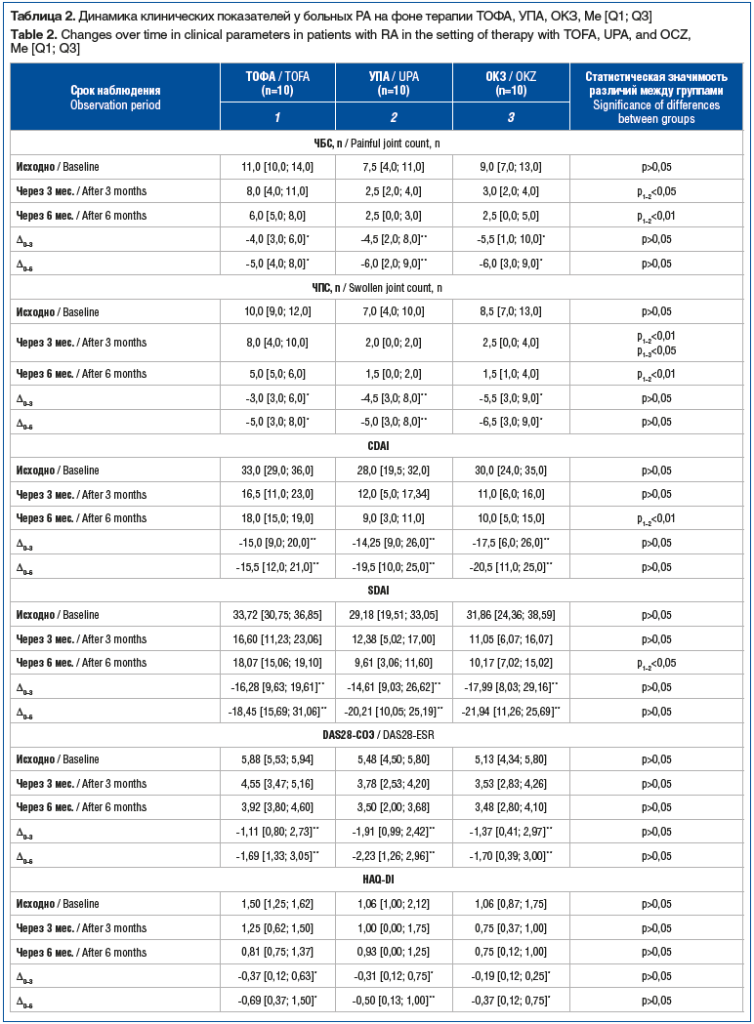
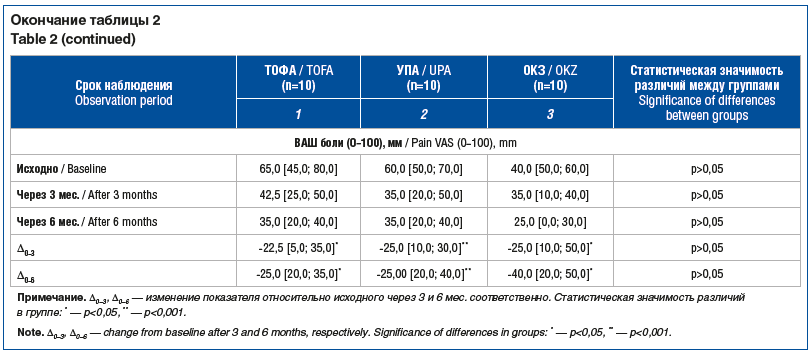
Через 3 мес. лечения снизились ЧБС, ЧПС, индексы воспалительной активности заболевания (DAS28-СОЭ, CDAI и SDAI), HAQ-DI, а также выраженность болевого синдрома по ВАШ во всех сравниваемых группах. Эти изменения сохранялись весь период наблюдения.
В группе пациентов, применявших УПА, через 6 мес. лечения наблюдалось достоверно более значимое уменьшение ЧБС, ЧПС, а также индексов воспалительной активности заболевания (CDAI, SDAI) по сравнению с этими показателями у пациентов, принимающих ТОФА. Показатели DAS28-СОЭ, HAQ-DI, выраженность боли по ВАШ у пациентов, принимающих УПА и ТОФА, были сопоставимы весь период наблюдения (р>0,05). В группах пациентов, получавших УПА и ОКЗ, не отмечено статистически значимых различий ЧБС, ЧПС, CDAI, SDAI, DAS28-СОЭ, HAQ-DI, а также интенсивности боли по ВАШ через 3 и 6 мес. лечения (р>0,05). Кроме того, через 3 и 6 мес. лечения динамика клинических показателей, индексов воспалительной активности РА и функционального состояния (разница конечных и исходных значений (∆исх. — 3 мес., ∆исх. — 6 мес.)) была сопоставима в сравниваемых группах (р>0,05).
Через 3 и 6 мес. терапии ТОФА достоверно снизились значения СОЭ, СРБ (р<0,05), а также концентрация РФ IgM через 6 мес. наблюдения (p<0,05) (табл. 3). Статистически значимого изменения концентрации АЦЦП не выявлено. В группе пациентов, принимающих УПА, через 3 мес. терапии уменьшилась СОЭ (p<0,05), однако через 6 мес. этот показатель несколько увеличился и хотя не достигал исходных значений, достоверно от них не отличался (р>0,05). Не отмечено значимого влияния УПА на содержание СРБ, РФ IgM, АЦЦП (р>0,05). Применение ОКЗ сопровождалось достоверным снижением концентрации СРБ через 3 и 6 мес. лечения (p<0,05) и не оказывало существенного влияния на СОЭ, концентрации РФ IgM и АЦЦП (р>0,05).
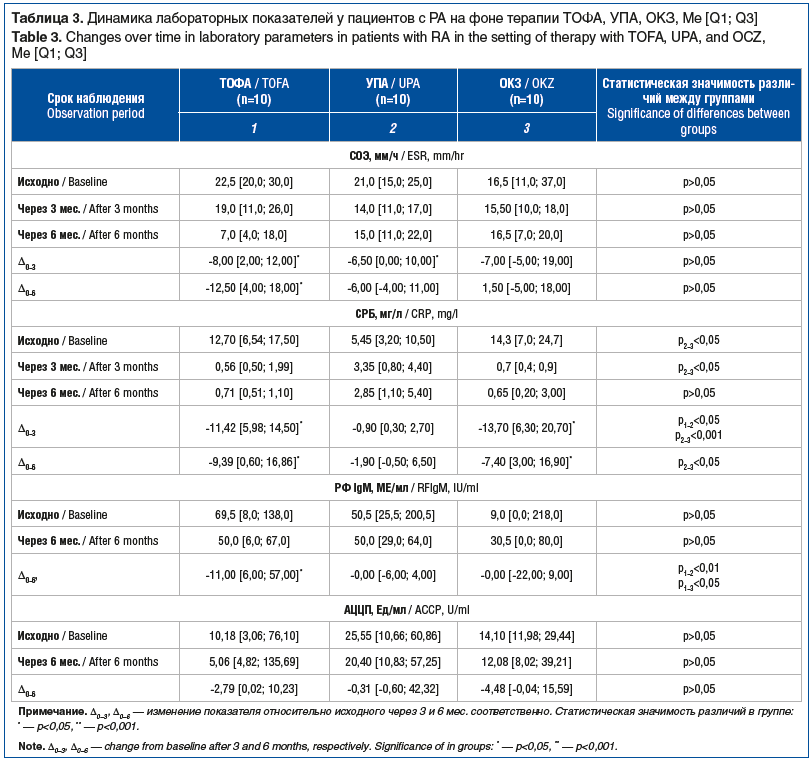
В группе пациентов, которым был назначен УПА, при включении в исследование оказались более низкие значения СРБ по сравнению с таковыми у пациентов группы ОКЗ (p<0,05). Через 3 мес. лечения уровень СРБ стал достоверно ниже у пациентов группы ОКЗ (p<0,05), чем у пациентов группы УПА. Через 6 мес. лечения концентрации СРБ в сравниваемых группах не различались (р>0,05).
Во всех группах показатели СОЭ, содержание РФ IgM и АЦЦП были сопоставимы в течение всего периода наблюдения (р>0,05).
Динамика снижения концентрации СРБ (∆исх. – 3 мес.) оказалась статистически значимой у пациентов групп ТОФА и ОКЗ через 3 мес., а через 6 мес. (∆исх. — 6 мес.) — только у пациентов группы ОКЗ.
Кроме того, мы обнаружили статистически значимую динамику снижения концентрации РФ IgM (∆исх. — 6 мес.) у больных РА, принимающих ТОФА, через 6 мес. лечения (p<0,05). В таблице 4 представлены изменения концентрации ИЛ-6 в сравниваемых группах.
Применение ТОФА сопровождалось достоверным снижением концентрации ИЛ-6 через 3 и 6 мес. наблюдения (см. табл. 4). Напротив, через 3 мес. терапии ОКЗ уровень ИЛ-6 статистически значимо повышался, а через 6 мес. лечения он снижался, не достигая, однако, исходных значений. Применение УПА не оказывало существенного влияния на уровень ИЛ-6 в течение всего периода наблюдения.
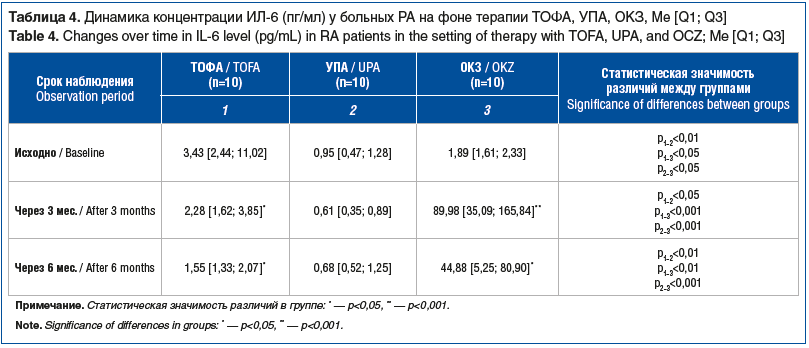
У пациентов группы ТОФА на момент включения в исследование значения ИЛ-6 оказались выше по сравнению со значениями у пациентов групп УПА или ОКЗ (p<0,05). Через 3 и 6 мес. лечения уровень ИЛ-6 также оставался выше в группе ТОФА по сравнению с таковым у пациентов группы УПА (p<0,05). У пациентов группы ОКЗ концентрация ИЛ-6 через 3 и 6 мес. лечения была достоверно выше, чем в других группах.
У части пациентов были зарегистрированы нежелательные явления (НЯ). Так, на фоне лечения ТОФА одна пациентка выбыла из исследования через 3 мес. терапии в связи со снижением уровня гемоглобина до 78 г/л при исходно низком его уровне (98,0 г/л). У другого пациента через 2 мес. наблюдения отмечалось транзиторное повышение уровня аспартатаминотрансферазы (АСТ) на 20,0 ед/л от исходно нормального уровня, однако это событие не потребовало отмены препарата. Серьезных НЯ не было.
Наиболее частыми НЯ при применении УПА были отклонения лабораторных показателей, такие как повышение активности АСТ и аланинаминотрансферазы (АЛТ) до значений, не превышающих 3-кратно верхних границ нормы (у 2 пациентов), и бессимптомное увеличение активности креатинфосфокиназы (у 6 пациентов). У одного пациента зафиксирована реактивация вируса Varicella zoster, потребовавшая назначения противовирусных препаратов. Серьезные НЯ не отмечены ни у одного из 10 пациентов.
При применении ОКЗ наиболее частыми НЯ были отклонения лабораторных показателей от референтных значений, такие как нейтропения легкой степени (у 2 пациентов), повышение уровней АЛТ, АСТ менее 3 верхних границ нормы (у 2 пациентов), гиперхолестеринемия (у 3 пациентов). Серьезных НЯ не было зарегистрировано ни у одного из 10 пациентов.
Обсуждение
В настоящей работе впервые в реальной клинической практике было проведено непрямое сравнение эффективности терапии ТОФА, УПА и ОКЗ у больных РА с недостаточным ответом на стандартные БПВП.
Результаты нашего исследования согласуются с ранее полученными данными о том, что применение ТОФА, УПА и ОКЗ у пациентов с умеренной или высокой активностью РА, резистентных к стандартному лечению БПВП, приводит к статистически значимому снижению клинико-лабораторных показателей активности заболевания: уменьшению ЧБС, ЧПС, DAS28-СОЭ, CDAI, SDAI, СРБ [11–14, 17]. Отсутствие статистически значимых различий в динамике концентрации СРБ на фоне терапии УПА, возможно, связано с его исходно низкой концентрацией до начала лечения. Применение ОКЗ не оказывало существенного влияния на показатели СОЭ при статистически значимом снижении индексов DAS28-СОЭ, SDAI и концентрации СРБ. По нашему мнению, это связано с достижением клинического эффекта на фоне лечения ОКЗ за счет преимущественного подавления активности ИЛ-6.
Нами не отмечено значимых различий в динамике концентрации РФ IgM и АЦЦП на фоне терапии УПА и ОКЗ. Однако лечение ТОФА сопровождалось снижением уровня РФ IgM через 6 мес. наблюдения. В экспериментальных работах in vitro показано, что ТОФА способен подавлять активацию, дифференцировку и переключение различных классов В-клеток, но поддерживает их регуляторную функцию [21, 22]. Кроме того, K. Sonomoto et al. [23] установили, что применение ТОФА у больных РА приводит к уменьшению значений РФ IgG и РФ IgM, коррелирующих с уменьшением активности заболевания.
В настоящее время отсутствуют рандомизированные клинические исследования, в которых проводилось прямое сравнение эффективности и безопасности ТОФА, УПА и ОКЗ у больных РА. В рандомизированных плацебо-контролируемых исследованиях (РПКИ) изучалась эффективность данных препаратов в сравнении с эффективностью ингибитора фактора некроза опухоли α — адалимумаба (АДА). Так, было показано, что комбинированная терапия ТОФА и метатрексатом (МТ) у больных РА, резистентных к БПВП, не уступала в эффективности комбинации АДА и МТ [24].
В самое крупное РПКИ в рамках программы SELECT — SELECT-COMPARE (n=1629) были включены пациенты, резистентные к терапии МТ. Результаты этого исследования подтверждают более высокую длительную эффективность (72 нед.) комбинированной терапии УПА и МТ по сравнению с эффективностью АДА и МТ в отношении достижения ответа DAS28-СРБ ≤3,3 (45% против 29%; p<0,001), а на 12-й неделе терапии УПА превосходил АДА по критериям American College of Rheumatology (ACR) 50 (45% против 29%, p<0,001), снижению боли (-32 против -25 по ВАШ, p<0,001) и индексу HAQ-DI [25, 26].
В РПКИ CREDO 2 III фазы применение ОКЗ в дозе 64 мг каждые 2 или 4 нед. в комбинации с МТ не уступало лечению АДА в дозе 40 мг каждые 2 нед. в сочетании с МТ в достижении ответа по критериям ACR 20 через 12 нед. терапии (70,3, 71,4, 66,9% соответственно) [14, 15].
Сетевой метаанализ РПКИ показал более высокую эффективность комбинированной терапии УПА (доза 15 мг/сут и 30 мг/сут) и МТ, а также ТОФА (доза 5 мг/сут и 10 мг/сут) и МТ по сравнению с применением АДА и МТ в отношении достижения ответа по критериям ACR 20 у больных РА, резистентных к БПВП. Причем комбинация УПА (доза 15 мг/сут и 30 мг/сут) в сочетании с МТ была наилучшим лечением с точки зрения частоты ответа ACR 20 и не ассоциировалась со значительным риском серьезных НЯ [27].
Данные сетевого метаанализа РПКИ, посвященного сравнительной оценке эффективности и безопасности ингибиторов JAK (БАРИ, ТОФА, УПА) и 8 ГИБП, включая тоцилизумаб, показали, что последний, а также цертолизумаба пэгол и УПА имели относительно равную эффективность по показателям ACR 20, DAS 28 и HAQ-DI [28]. При этом тоцилизумаб превосходил другие препараты по влиянию на снижение значений СОЭ, СРБ и DAS 28.
Непрямое сравнение комбинированного лечения ТОФА и МТ, а также УПА и МТ у больных РА, резистентных к предшествующей терапии МТ, свидетельствует о более частом достижении ремиссии по индексам SDAI (mean difference in difference (DID) 9,1%, p=0,011), CDAI (DID 7,5%, p=0,038), DAS28-СОЭ (DID 11,3%, p=0,002) у пациентов, находящихся на лечении УПА и МТ, через 6 мес. наблюдения [29].
В целом результаты настоящего непрямого сравнительного анализа не противоречат ранее полученным данным РПКИ и результатам метаанализов. Так, через 6 мес. наблюдения лечение УПА приводило к более значимому уменьшению ЧБС, ЧПС, CDAI, SDAI по сравнению с этими показателями на фоне терапии ТОФА. Изменения клинических показателей, индексов воспалительной активности РА и функционального состояния были сопоставимы в сравниваемых группах весь период наблюдения. ОКЗ превосходил УПА по снижению показателей СРБ через 3 мес. лечения. Концентрация СРБ (∆исх. — 3 мес.) значимо снизилась у пациентов, получающих ТОФА и ОКЗ через 3 мес., а через 6 мес. (∆исх. — 6 мес) — только в группе пациентов, принимавших ОКЗ. Кроме того, мы выявили статистически значимую динамику снижения РФ IgM (∆исх–6 мес) через 6 мес. терапии у больных РА, принимающих ТОФА (p<0,05).
В нашей работе мы также исследовали влияние ТОФА, УПА и ОКЗ на изменение содержания ИЛ-6, ключевого цитокина, вовлеченного в иммунопатогенез РА [30]. В настоящее время ингибиторы JAK (селективные и неселективные), наряду с ингибиторами рецепторов ИЛ-6 (тоцилизумаб) или самого ИЛ-6 (ОКЗ), рассматриваются в контексте «анти-ИЛ-6-терапии» [31].
По нашим данным, на фоне клинической эффективности каждого из препаратов применение ТОФА сопровождалось значимым снижением концентрации ИЛ-6 через 3 и 6 мес. наблюдения. УПА не оказывал существенного влияния на уровень ИЛ-6 в течение всего периода исследования, что, возможно, связано с подавлением синтеза не только ИЛ-6, но и других цитокинов, участвующих в иммунопатогенезе РА, а также с различной селективностью изучаемых препаратов.
Напротив, на фоне снижения индексов активности РА и СРБ терапия ОКЗ приводила к статистически значимому повышению уровня ИЛ-6 через 3 мес. Через 6 мес. лечения на фоне дальнейшего снижения значений DAS28-СОЭ, SDAI, CDAI и СРБ концентрация ИЛ-6 уменьшалась, не достигая, однако, исходных значений. Данный феномен обусловлен замедлением скорости клиренса комплекса ОКЗ/ИЛ-6, который, в отличие от свободного ИЛ-6, не обладает провоспалительным потенциалом [32, 33].
Заключение
В целом результаты исследования продемонстрировали некоторые различия в клиническом эффекте ингибиторов JAK у больных РА, резистентных к предшествующей терапии БПВП. Применение УПА приводило к более значимому уменьшению ЧБС, ЧПС, CDAI, SDAI через 6 мес. терапии по сравнению с таковым при лечении ТОФА. В то же время лечение ТОФА сопровождалось снижением уровня РФ IgM к 6 мес. наблюдения. ОКЗ превосходил ингибиторы JAK по снижению концентрации СРБ через 6 мес. лечения. При этом, независимо от исходной концентрации ИЛ-6 и ее изменения на фоне лечения, все сравниваемые препараты показали высокую эффективность в отношении подавления активности РА, а также безопасность.
Наше непрямое сравнительное исследование носило поисковый характер, без проведения формальной оценки размеров выборок и поправки на множественное сравнение, в связи с чем полученные результаты и отмеченные тенденции должны быть подтверждены в будущих клинических исследованиях и реальной клинической практике.
СВЕДЕНИЯ ОБ АВТОРАХ:
Лапкина Наталья Александровна — к.м.н., доцент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ФГБОУ ВО ЯГМУ Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5; ORCID iD 0000-0003-2692-399X.
Баранов Андрей Анатольевич — д.м.н., профессор, заведующий кафедрой поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ФГБОУ ВО ЯГМУ Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5; ORCID iD 0000-0001-7847-1679.
Леонтьева Елена Андреевна — ассистент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ФГБОУ ВО ЯГМУ
Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5; ORCID iD 0000-0002-7979-1313.
Амирджанова Вера Николаевна — д.м.н., профессор, ведущий научный сотрудник ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское ш., д. 34А; ORCID iD 0000-0001-5382-6357.
Колинько Александр Андреевич — к.м.н., доцент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ФГБОУ ВО ЯГМУ Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5; ORCID iD 0009-0005-1379-8511.
Ашихмин Глеб Максимович — студент 6-го курса Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0009-0006-3242-8257.
Контактная информация: Лапкина Наталья Александровна, e-mail: lanaal@rambler.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 08.02.2024.
Поступила после рецензирования 04.03.2024.
Принята в печать 27.03.2024.
ABOUT THE AUTHORS:
Natalya A. Lapkina — C. Sc. (Med.)., associate professor of the Department of Polyclinics Therapy, Clinical Laboratory Diagnostics, and Medical Biochemistry, Yaroslavl State Medical University; 5, Revolutsionnaya str., Yaroslavl, 150000, Russian Federation; ORCID iD 0000-0003-2692-399X.
Andrey A. Baranov — Dr. Sc. (Med.), Professor, Head of the Department of Polyclinics Therapy, Clinical Laboratory Diagnostics, and Medical Biochemistry, Yaroslavl State Medical University; 5, Revolutsionnaya str., Yaroslavl, 150000, Russian Federation; ORCID iD 0000-0001-7847-1679.
Elena A. Leont’eva — assistant of the Department of Polyclinics Therapy, Clinical Laboratory Diagnostics, and Medical Biochemistry, Yaroslavl State Medical University; 5, Revolutsionnaya str., Yaroslavl, 150000, Russian Federation; ORCID iD 0000-0002-7979-1313.
Vera N. Amirdzhanova — Dr. Sc. (Med.), Professor, leading researcher of the V.A. Nasonova Research Institute of Rheumatology; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0001-5382-6357.
Aleksandr A. Kolin’ko — C. Sc. (Med.)., associate professor of the Department of Polyclinics Therapy, Clinical Laboratory Diagnostics, and Medical Biochemistry, Yaroslavl State Medical University; 5, Revolutsionnaya str., Yaroslavl, 150000, Russian Federation; ORCID iD 0009-0005-1379-8511.
Gleb M. Ashikhmin — student of the 6th course of the N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0009-0006-3242-8257.
Contact information: Natalya A. Lapkina, e-mail: lanaal@rambler.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 08.02.2024.
Revised 04.03.2024.
Accepted 27.03.2024.
Информация с rmj.ru






