Содержание статьи
Введение
Продолжительность жизни в мире растет, и, по данным Всемирной организации здравоохранения, к 2050 г. число людей старше 60 лет удвоится [1]. Уже сейчас в экономически и социально развитых странах количество населения в возрасте старше 80 лет увеличилось в 4 раза, старше 90 лет — в 8 раз, а старше 100 лет — в 20 раз по сравнению с серединой прошлого века [2]. Во многом это обусловлено синтезом новых лекарственных средств, которые помогли в борьбе с инфекционными и неинфекционными заболеваниям и тем самым способствовали увеличению продолжительности жизни, а также уменьшению младенческой и детской смертности.
С момента открытия и синтеза молекулы, получения на нее компанией-производителем патента на изобретение и до масштабного применения в клинической практике проходит много лет, в течение которых в in vitro экспериментах и на моделях животных (доклинические исследования), а также на здоровых добровольцах и пациентах (клинические исследования) изучаются профиль эффективности и безопасности, а также режим дозирования будущего лекарственного препарата (ЛП) [3]. ЛП с новым действующим веществом, который первым зарегистрирован и одобрен для применения в медицинской практике на основании результатов доклинических и клинических исследований, подтверждающих его качество, эффективность и безопасность, называется оригинальным ЛП [4]. В течение срока действия патентной защиты только компания — держатель регистрационного удостоверения имеет право на производство и реализацию оригинального ЛП, однако по окончании срока действия патента другие фармацевтические компании также получают право на производство и реализацию ЛП, эквивалентных оригинальному по качественному и количественному составу действующих веществ, а также в эквивалентной лекарственной форме, — так называемых воспроизведенных ЛП или дженериков [4]. Данные ЛП не проходят доклинических и трех фаз клинических исследований и в основном регистрируются на основании исследований биоэквивалентности, т. е. клинического исследования, подтверждающего достижение дженериком сопоставимых показателей скорости всасывания, степени поступления к месту действия и скорости выведения одного или нескольких обладающих фармакологической активностью действующих веществ, в эквивалентных оригинальному ЛП дозировках и при одинаковом способе введения [4].
В процессе подтверждения биоэквивалентности дженерика и оригинального ЛП анализируются AUC (area under curve, площадь под кривой) и Сmax (максимальная концентрация активного вещества в плазме крови) [5]. Воспроизведенный ЛП считается биоэквивалентным оригинальному в случае, если AUC(0–t) или AUC(0–72 ч) и Сmax лежат в интервале 80,00–125,00% при 90% доверительном интервале [6, 7]. Важно отметить, что хотя фармакокинетические параметры оригинального и воспроизведенных ЛП укладываются в диапазон 80,00–125,00% биоэквивалентности, тем не менее в ряде случаев может возникать необходимость изменения режима дозирования, а также клинически значимые различия профилей безопасности и эффективности [5].
Оригинальный ЛП моксонидин и его дженерики
Оригинальный ЛП моксонидин (Физиотенз®) [8] является гипотензивным препаратом центрального действия. Моксонидин селективно стимулирует имидазолин-чувствительные рецепторы в стволовых структурах мозга, принимающие участие в тонической и рефлекторной регуляции симпатической нервной системы, приводя к снижению системного сосудистого сопротивления и артериального давления (АД). На сегодняшний день в России помимо оригинального ЛП моксонидина зарегистрировано еще 15 средств с данным действующим веществом [8].
В.В. Руксин и соавт. [9] сравнили эффективность, безопасность и время наступления антигипертензивного эффекта оригинального моксонидина и двух его дженериков у пациентов с нежизнеугрожающей артериальной гипертензией при оказании скорой медицинской помощи. Было выявлено, что все 3 ЛП могут эффективно и безопасно применяться для снижения АД, однако оригинальный препарат имеет большую антигипертензивную эффективность и при его применении требуется меньше времени для достижения терапевтического эффекта по сравнению с дженериками. На основании полученных данных авторами был сделан вывод о том, что именно оригинальный моксонидин является антигипертензивным препаратом выбора как в работе выездных бригад скорой медицинской помощи, так и при оказании самопомощи (принцип «таблетка в кармане»).
В другом исследовании [10] авторы оценивали терапевтическую эффективность и безопасность однократного сублингвального приема оригинального моксонидина и его дженерика при оказании скорой медицинской помощи у пациентов с артериальной гипертензией. Выявлено, что оба ЛП могут быть использованы для снижения АД, особенно у пациентов с признаками активации симпатоадреналовой системы, однако эффективность дженерика несколько ниже, а время наступления эффекта — длительнее по сравнению с оригинальным ЛП. По мнению авторов, при оказании скорой медицинской помощи предпочтительно использование именно оригинальных ЛП, эффективность и безопасность которых изучены в исследованиях с участием пациентов, находящихся в состоянии, требующем неотложной медицинской помощи, и только при их отсутствии — применение дженериков. Выявленные в приведенных выше двух исследованиях клинические отличия оригинального препарата и его дженериков могут быть частично обусловлены различиями в технологии производства препаратов (степень измельчения, уровень компрессионного давления при производстве лекарственной формы и т. д.), а также разницей в составе вспомогательных веществ [5–10].
В работе Г.В. Раменской и соавт. [11] был проведен сравнительный анализ кинетики растворения 4 дженериков, содержащих моксонидин, и референтного ЛП. Исследователями обнаружено, что, несмотря на доказанную биоэквивалентность, in vitro наблюдались отличия кинетики растворения: ни один из исследуемых образцов ЛП не был полностью сопоставим c оригинальным препаратом. Наиболее выраженные отличия наблюдались в среде с рН=6,8, где исследуемые препараты Дженерик 1 и Дженерик 2 имели более «быструю», а препараты Дженерик 3 и Дженерик 4 — более «медленную» кинетику [11]. По мнению авторов, выявленные различия обусловлены разнообразием в составе вспомогательных веществ, вследствие которого изменяется скорость всасывания активного вещества в системный кровоток.
Влияние вспомогательных веществ на метаболизм ЛП
Один из механизмов, с помощью которого вспомогательные вещества могут влиять на терапевтическую эффективность ЛП и профиль его безопасности, — изменение метаболизма ЛП (в том числе пресистемного) за счет ингибирования р-гликопротеина (P-gp) и/или изоферментов цитохрома Р450 (CYP450) [12–17]. В таблице 1 приведены примеры изменения активности изоферментов CYP450, участвующих в метаболизме ЛП под действием некоторых вспомогательных веществ [12–28]. Изофермент CYP3A4 участвует в метаболизме ~50% ЛП, применяемых в клинической практике [18], его транскрипция регулируется преимущественно прегнан-X-рецептором (Pregnane X receptor, PXR) [19]. CYP3A5 является одним из изоферментов семейства CYP450, который преимущественно экспрессируется в кишечнике, в меньшей степени — в печени [12–17], большинство ЛП-субстратов CYP3A4 также метаболизируются CYP3A5. Изофермент CYP2C9 составляет более 10% от общего содержания CYP450 в тонком кишечнике человека [25–26], изофермент CYP2C19 — около 2% от общего содержания CYP450 в кишечнике [25], а изофермент CYP2D6 является одним из наименее распространенных — менее 1% CYP450 в кишечнике [25].
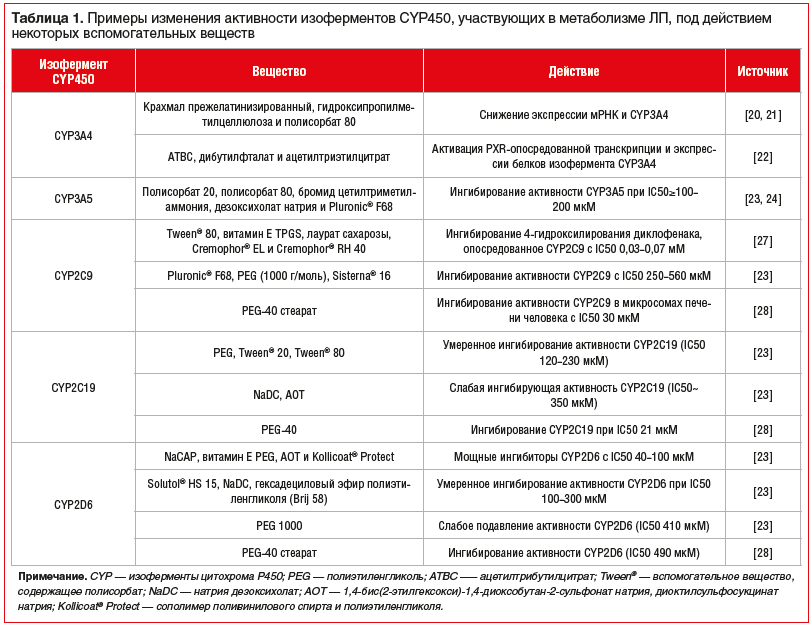
Изоферменты CYР450, участвующие в метаболизме моксонидина, на момент подготовки статьи не установлены [29, 30]. Однако, учитывая наличие в воспроизведенных ЛП моксонидина, вспомогательных веществ, которые отсутствуют в оригинальном препарате, например Tween® 80, и доказанную в экспериментальных работах их способность изменять активность изоферментов, участвующих в метаболизме ксенобиотиков, можно предположить, что отличия в фармакокинетике препаратов моксонидина, показанные в исследованиях В.В. Руксина и соавт. [9, 10], также потенциально могли быть обусловлены изменениями метаболизма ЛП.
Для подтверждения данной гипотезы требуется проведение дополнительных исследований.
Влияние вспомогательных веществ на почечную элиминацию ЛП
Моксонидин выводится из организма в неизмененном виде, преимущественно через почки, поэтому крайне важно, чтобы вспомогательные вещества, входящие в состав ядра ЛП и его оболочки, не изменяли функцию почек [8, 31–33]. Выделяют несколько механизмов, с помощью которых вспомогательные вещества могут изменять секрецию и/или реабсорбцию ЛП в почках, а следовательно, и влиять на элиминацию ЛП через почки:
угнетение/активация белков-транспортеров, таких как p-gp, MRP2, MRP4, BCRP и др. на апикальной или базолатеральной мембране нефрона [12, 13, 31, 34];
конкуренция с ЛП на уровне белков-переносчиков в почках [12, 13, 31, 34];
токсическое действие на нефрон;
снижение скорости клубочковой фильтрации.
В ряде работ [35–46] было показано, что вспомогательное вещество Cremophor® способно ингибировать P-gp. Так, в экспериментальной работе [36] на модели клеток эпителия почек Madin–Darby (MDCK) было показано, что Cremophor® EL (Полиоксил-35, касторовое масло) ингибирует активность как P-gp, так и MRP2. В более позднем исследовании G. Zhao et al. [37] на модели крыс было показано, что не только Cremophor® EL, но и самоэмульгирующиеся системы доставки лекарственных средств (SMEDDS) на основе Cremophor® RH 40 (Полиоксил 40, гидрогенизированное касторовое масло) могут увеличивать Cmax этопозида на 28% и 33%, а его AUC0–24 ч — на 40% и 65% соответственно, именно путем ингибирования P-gp.
J. Huang et al. [38] и L. Ma et al. [39] показали, что Pluronic® F68 (Полоксамер 188) может в 2 раза снижать эффлюкс целипролола (вещество-субстрат P-gp) в клетках Caco-2. В исследовании L. Ma et al. [39] также продемонстрировано, что у крыс Pluronic® F68 снижает общий клиренс рифампицина в 1,8 раза и увеличивает его AUC в 1,5 раза. U. Hanke et al. [36] изучали влияние вспомогательных веществ на функцию MRP2 на модели клеток MDCK II. Было показано, что Cremophor® EL, витамин E TPGS 1000 (d-α-токоферил полиэтиленгликоля 1000 сукцинат), Cremophor® RH 40 и Tween® 80 ингибировали активность MRP2, а Pluronic® PE 10300 (блоксополимер этиленоксида и пропиленоксида) и сложный эфир сахарозы L-1695 угнетали активность P-gp. L. Li et al. [40] исследовали влияние вспомогательных веществ на активность MRP2 на модели клеток Caco-2 и везикулах клеточной мембраны Sf-9, сверхэкспрессирующих MRP2. Было выявлено, что Cremophor® EL, Cremophor® RH, Pluronic® F68, Labrasol® (моно-, ди- и триглицериды, моно- и диэфиры жирных кислот полиэтиленгликоля (PEG)-8 и свободного PEG-8, с каприловой (C8) и каприновой (C10) кислотами в качестве основных жирных кислот) и Pluronic® F127 (Полоксамер 407), Labrafac Lipophile® WL 1349 (среднецепочечные триглицериды каприловой (C8) и каприновой (C10) кислот), Capmul® MCM (глицерил каприлат / капрат), Maisine® 35–1 (смесь моно-, ди- и триглицеридов олеиновой и линолевой кислот (C18:1/C18:2)), PEG 400 и PEG 2000 (полиэтиленгликоль), Transcutol® (моноэтиловый эфир диэтиленгликоля) и β-циклодекстрин выраженно (в 2–4 раза) угнетали активность MRP2.
В работах M. Hayman et al. [41] и N.E. Yaucher et al. [42] описаны случаи нефротоксичности (включая острый тубулярный некроз) у пациентов, принимавших ЛП, в состав которых входил пропиленгликоль. Таким образом, потенциальные изменения функции почек под действием вспомогательных веществ также могут обусловливать отличия в биоэквивалентности и терапевтической эквивалентности ЛП, особенно тех, которые преимущественно выводятся почками (например, моксонидин).
Вспомогательные вещества как потенциальные причины развития нежелательных реакций
Важно отметить, что наличие в составе дженериков вспомогательных веществ, которые отсутствуют в оригинальном препарате, может приводить к развитию серьезных осложнений фармакотерапии — например, аллергических реакций.
Проведенный поиск литературы не выявил описания клинических случаев с ЛП, содержащими моксонидин, которые бы наглядно демонстрировали эту точку зрения, однако была найдена публикация M. Greenhawt et al. [43], описывающая случай анафилаксии (отек глаз, зуд в области лица) через 90 мин после приема воспроизведенного азитромицина у 47-летней женщины с анамнезом бронхиальной астмы и аллергии на карминовый краситель в составе пищевых продуктов (малиновый йогурт красного цвета, тортеллини красного цвета) и косметических средств красного цвета. Оригинальный азитромицин, в отличие от воспроизведенного, не имел в составе кармина, а потому для верификации нежелательной реакции и уточнения возможности дальнейшего применения данного антибактериального средства у конкретной пациентки авторами статьи были выполнены кожные пробы с кармином, чистым азитромицином без оболочки и отдельно с оболочкой каждого из производителей. Было выявлено, что пациентка имела выраженную положительную реакцию на чистый кармин и оболочку воспроизведенного азитромицина, в состав которой также входил кармин [43].
Представленное клиническое наблюдение крайне интересно не только тем, что именно вспомогательное вещество, входящее в состав оболочки ЛП в крайне небольшом количестве, а не активное вещество, вызвало серьезную, жизнеугрожающую нежелательную реакцию, но также и тем, что пациентке, несмотря на установленную ранее аллергию на кармин, был назначен лекарственный препарат, содержащий это вещество. Если бы специалисты здравоохранения и сама женщина были более внимательны, этого осложнения можно было бы избежать, применяя оригинальный препарат, который не содержит в своем составе кармин.
В таблице 2 систематизированы данные о рисках развития осложнений, ассоциированных с применением некоторых часто используемых в фармацевтической отрасли вспомогательных веществ, полученные из открытых литературных источников и специализированных баз данных [8, 43–48].
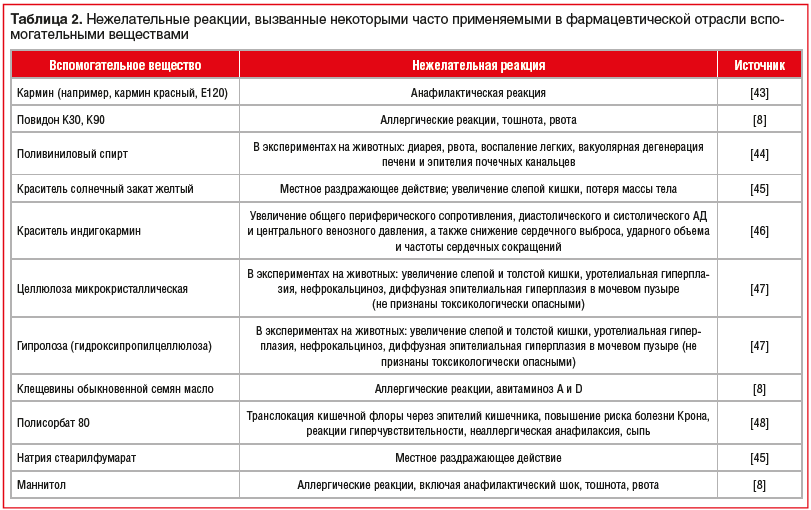
Наличие данных вспомогательных веществ в составе воспроизведенных препаратов моксонидина может быть ассоциировано с риском развития осложнений. Лечащий врач и пациент могут расценить их как осложнение от применения активного вещества и отказаться от применения эффективного антигипертензивного средства. Однако терапия может быть продолжена при условии доказанной причинно-следственной связи между осложнением фармакотерапии и конкретным вспомогательным веществом и назначения оригинального ЛП, в составе которого оно отсутствует.
Заключение
Таким образом, несмотря на подтвержденную биоэквивалентность, оригинальные и воспроизведенные ЛП имеют целый ряд отличий не только в терапевтической эффективности, но и в фармакокинетике, обусловленных разницей в способе производства и составе вспомогательных веществ, что было продемонстрировано на примере оригинального ЛП моксонидина и его дженериков [9-11]. Сами вспомогательные вещества, хотя и считаются фармакологически и химически инертными, тем не менее могут влиять на фармакодинамику и фармакокинетику ЛП за счет различий в скорости высвобождения вещества из лекарственной формы, изменения активности изоферментов CYР450 и влияния на элиминацию ЛП. Более того, в ряде случаев развития нежелательных реакций, которые возникают при применении воспроизведенных ЛП, можно избежать путем назначения оригинального ЛП, так как оригинальный препарат не содержит вспомогательных веществ, которые потенциально могли бы вызывать осложнения фармакотерапии.
.
Информация с rmj.ru

