В статье представлен опыт диетологической коррекции нутритивного статуса у пациентов с ДЦП. Описано клиническое наблюдение.
Содержание статьи
Введение
Детский церебральный паралич (ДЦП) — группа стабильных нарушений развития моторики и поддержания позы, ведущих к двигательным дефектам, обусловленным непрогрессирующим повреждением и/или аномалией развивающегося головного мозга у плода или новорожденного ребенка, с дальнейшим формированием патологического мышечного тонуса (преимущественно спастичности) при сохранении позотонических рефлексов и сопутствующих нарушений становления цепных установочных выпрямительных рефлексов [1]. Основным отличием ДЦП от других центральных параличей является время воздействия патологического фактора: пренатальное, интранатальное и в раннем постнатальном периоде [2].
По данным ВОЗ, ДЦП является основной причиной детской неврологической инвалидности в мире, частота встречаемости его в мире составляет 3–4 случая на 1000 новорожденных [3]. В Российской Федерации распространенность зарегистрированных случаев ДЦП составляет 2,2–3,3 случая на 1000 новорожденных [1].
Пациенты с ДЦП составляют группу риска по нутритивной недостаточности. Нарушения нутритивного статуса выявляются в среднем у половины детей данной категории [4]. Нарушения питания у детей с ДЦП включают дефицит веса разной степени, замедление темпов роста, остеопению (более чем у 70%) и ожирение (10–15%) [3]. Дети, страдающие ДЦП, нуждаются в тщательном мониторинге пищевого статуса, разработке рациона с назначением нутритивной поддержки по показаниям и ее обязательной коррекцией в динамике наблюдения с учетом возраста, характера течения основного заболевания, наличия сопутствующей патологии, а также объема и интенсивности реабилитационных мероприятий.
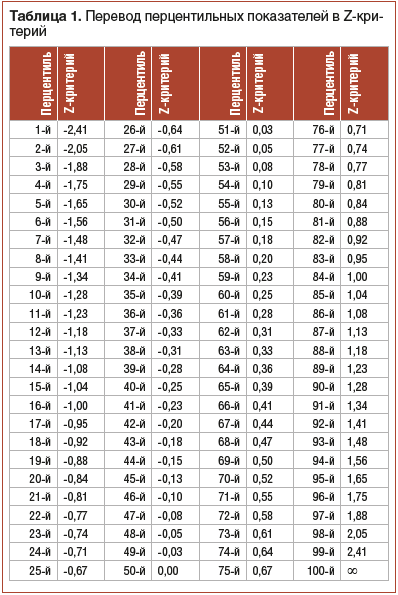
Оценка физического развития пациентов с ДЦП проводится с использованием центильных таблиц, разработанных для пациентов с данной патологией с учетом моторного класса по системе оценки глобальных моторных функций (Gross Motor Function Classification System, GMFCS). Z-критерий ИМТ может определяться путем перевода перцентильных показателей в Z-критерии с использованием таблиц (табл. 1). Критерии оценки показателей физического развития представлены в таблице 2.

Клиническое наблюдение 1
Ребенок В. впервые госпитализирован в отделение педиатрической гастроэнтерологии, гепатологии и диетологии ФГБУН «ФИЦ питания и биотехнологии» в возрасте 13 лет с жалобами на сниженный избирательный аппетит, вздутие и боли в животе, не связанные с приемом пищи, тошноту, неустойчивый стул: чередование запоров с задержкой стула до 3 дней и разжиженного стула с кусочками непереваренной пищи, низкую массу тела, шелушение кожи на подушечках пальцев рук.
Анамнез: мальчик от II беременности (I беременность замершая), протекавшей на фоне хронической фетоплацентарной недостаточности, угрозы прерывания на всем сроке. Роды I самостоятельные, преждевременные (35–36 нед. гестации), с двойным обвитием пуповиной вокруг шеи. При рождении масса тела — 2480 г, длина — 51 см. Оценка по шкале Апгар — 7/8 баллов. В связи с тяжелым состоянием, обусловленным дыхательной недостаточностью и неврологической симптоматикой, госпитализирован в отделение интенсивной терапии, где в течение 3 сут проводилась ИВЛ. На 7-е сут жизни переведен в отделение патологии новорожденных с диагнозом: гипоксически-ишемическое поражение ЦНС. Грудное вскармливание проводилось до 2 мес., смешанное — до 4 мес., затем искусственное (адаптированные молочные смеси на основе цельного белка). Введение прикорма с 4 мес. (начиная с творога). В 5 мес. введены овощи, в 6 мес. — коровье молоко (2,5% жирности). На первом году наблюдался у специалистов по поводу задержки психомоторного и речевого развития.
В возрасте 3 мес. появились признаки внутричерепной гипертензии (по данным нейросонографии) и тетрапареза. В 1 год 2 мес. установлен диагноз ДЦП. Спастический тетрапарез. Постоянно наблюдается специалистами по месту жительства, проводятся реабилитационные мероприятия по поводу резидуально-органического поражения ЦНС; ДЦП, спастического левостороннего гемипареза с преимущественным поражением левой верхней конечности, GMFCS I уровень. Сопутствующие заболевания: аутоиммунный тиреоидит, субклинический гипотиреоз, медикаментозная компенсация. Миопия слабой степени. Множественные приводящие контрактуры левой верхней и нижней конечности. Нарушение осанки. Поло-эквино-варусные стопы. Дизартрия псевдобульбарная. Смешанное специфическое расстройство развития.
Наследственность: по линии матери: у мамы — хронический гастрит; у дедушки — рак желудка; по линии отца: у папы — артериальная гипертензия; у бабушки — сахарный диабет 2 типа; у деда — артериальная гипертензия, инфаркт миокарда.
Перенесенные заболевания: ОРВИ; анемия в раннем возрасте; в 7 лет — ветряная оспа, эписклерит, оперативные вмешательства: в 7,5 года — сухожильно-мышечная пластика на левой кисти.
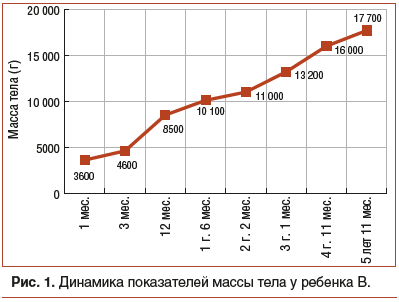
Со слов матери, с рождения у ребенка отмечаются ежедневные колики, задержка стула до 4–5 дней, низкие темпы прибавки массы тела (рис. 1).
С 3 мес. до 4 лет большая часть приемов пищи осуществлялась во сне в связи с наличием позывов на рвоту или рвоты при приеме еды во время бодрствования. До 4 лет в рационе присутствовала исключительно протертая пища. На момент госпитализации в рационе преобладали молочные и кисломолочные продукты, крупы (гречневая, кукурузная, овсяная, рисовая 1 раз в неделю), макаронные изделия, мясо в протертом виде (курица, индейка, говядина), хлеб и хлебобулочные изделия, овощи (капуста цветная, свежие огурцы, картофель, морковь, лук репчатый, свекла), фрукты (яблоки, бананы, груши). Специализированное лечебное питание не получал.
Объективно: положение ребенка активное. I класс GMFCS. Масса тела — 27,5 кг, рост — 149 см. ИМТ — 12,4 кг/м2; Z-критерий ИМТ/возраст — <-3, Z-критерий рост/возраст — -0,05; Z-критерий вес/возраст — -1,65. Физическое развитие среднее, тяжелый дефицит массы тела. Шелушение кожи подушечек пальцев рук, болезненность при пальпации в эпигастральной и мезогастральной области. Выраженная асимметрия лица. На момент госпитализации навыки жевания и глотания сформированы. Жует преимущественно на правой стороне. Речь нечеткая.
При обследовании: клинический анализ крови без воспалительных изменений. Общий белок, липидограмма, электролиты, показатели обмена железа не имеют диагностически значимых отклонений. Тиреоидный профиль в норме. При аллергообследовании выявлено наличие специфических IgE (III класс) к казеиновой и сывороточной фракциям белка коровьего молока, глютену. При оценке витаминного статуса выявлен дефицит витаминов В6 и В12. Уровень антител классов IgA/IgG к тканевой трансглутаминазе в пределах нормы. Ультразвуковые признаки деформации желчного пузыря (перегиб в дне), вторичных изменений поджелудочной железы, гастродуоденита. По данным биоимпедансометрии выявлено снижение основных компонентов состава тела относительно индивидуальной нормы с максимальной недостаточностью жирового компонента; дефицит массы тела составил 24,45%, жировой массы — 84,6%, мышечно-скелетной массы — 2%, протеинов — 12%, минеральных веществ — 19%. При проведении оценки фактического питания в домашних условиях выявлен дефицит энергетической ценности рациона и основных его компонентов по сравнению с возрастной нормой [5]. Энергетическая ценность рациона составила 1760 ккал/сут (норма — 2500 ккал/сут), белок — 61,7 г/сут (норма — 75 г/сут), жиры — 40,07 г/сут, что составляет менее 50% от рекомендованной суточной потребности (норма — 83 г/сут), углеводы — 287,83 г/сут (норма — 363 г/сут).
На основании данных анамнеза, жалоб, клинического осмотра, лабораторно-инструментального обследования был выставлен диагноз: К90.8. Нарушение всасывания в кишечнике. Пищевая аллергия, гастроинтестинальная форма. Дисфункция билиарного тракта на фоне деформации желчного пузыря. Вторичные изменения поджелудочной железы. Тяжелый дефицит массы тела (Z-критерий ИМТ <-3). Органическое поражение ЦНС, синдром ДЦП, левосторонний гемипарез (спастический тетрапарез) с преимущественным поражением левой верхней конечности. Дисгидротическая экзема, ремиссия.
В данном случае причиной синдрома мальабсорбции, вызвавшего тяжелый дефицит массы тела, явилась гастроинтестинальная форма пищевой аллергии к казеиновой и сывороточной фракциям белка коровьего молока, глютену. В связи с этим была рекомендована элиминационная диета с исключением причинно-значимых аллергенов. Ввиду отсутствия в рационе молочного белка с целью профилактики дефицита белкового компонента, восполнения дефицита витаминов и микроэлементов, помимо увеличения квоты мясных продуктов в качестве нутритивной поддержки была использована лечебная элементная энтеральная смесь на основе аминокислот (Альфаре Амино) в объеме до 420 мл/сут (210 мл [7 мерных ложек] × 2 р./сут). С целью компенсации жирового компонента рекомендовано обогащение рациона растительными маслами, использование препаратов омега-3 жирных кислот. Компенсация углеводного компонента проводилась за счет увеличения содержания в рационе безглютеновых круп, макаронных и хлебобулочных изделий на основе безглютеновой муки.
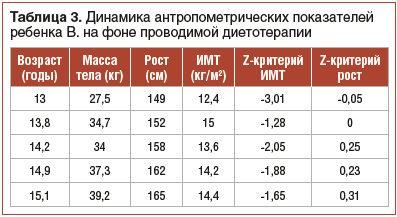
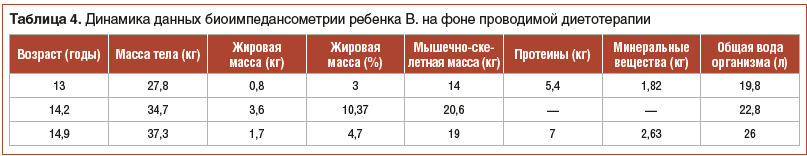
В ходе катамнестического наблюдения на фоне проводимой диетотерапии отмечалась положительная динамика в виде нормализации характера и частоты стула, купирования болевого синдрома, увеличения массы тела, что подтверждается положительной динамикой антропометрических показателей (табл. 3) и данными биоимпедансометрии (табл. 4).
Клиническое наблюдение 2
Ребенок Н. впервые госпитализирован в отделение педиатрической гастроэнтерологии, гепатологии и диетологии ФГБУН «ФИЦ питания и биотехнологии» в возрасте
7 лет 7 мес. с жалобами, со слов матери, на вздутие живота, боли в животе спастического характера, вялость, беспокойный ночной сон, повышенную утомляемость, отсутствие прибавки массы тела.
Анамнез жизни: мальчик от I беременности, протекавшей до III триместра без особенностей, в III триместре маловодие, задержка внутриутробного развития (ЗВУР) на фоне фетоплацентарной недостаточности. Роды I самостоятельные, на 39-й нед. гестации с применением медикаментозной стимуляции. При рождении масса тела — 2280 г, рост — 47 см. Оценка по шкале Апгар — 5/7 баллов. В связи с тяжелым состоянием, обусловленным дыхательной недостаточностью и неврологической симптоматикой, проведены санация верхних дыхательных путей, дополнительная оксигенация в родзале, интубация трахеи. Госпитализирован в отделение интенсивной терапии, где проводилась искусственная вентиляция легких (ИВЛ) в течение 7 сут. На 8-е сут жизни переведен на ИВЛ с постоянным положительным давлением (Constant Positive Airway Pressure, СРАР), с 12-х сут жизни — самостоятельное дыхание. На 14-е сут жизни переведен на второй этап выхаживания в специализированное отделение. Вскармливание сцеженным грудным молоком проводилось до 7 мес. Введение прикорма — с 6 мес. На первом году наблюдался у специалистов по поводу задержки психомоторного и речевого развития.
Перенесенные заболевания: в 5 лет — тонко-толстокишечная инвагинация; в 7 лет — странгуляционная кишечная непроходимость, некроз участка подвздошной кишки, осложненные разлитым перитонитом, двусторонней пневмонией.
С возраста 1 года регулярно наблюдается специалистами по месту жительства, проводятся реабилитационные мероприятия по поводу ДЦП, тетрапареза, симптоматической фокальной эпилепсии (на момент госпитализации противосудорожная терапия отменена). Наследственность: наследственный анамнез отягощен по аллергии (бронхиальная астма у бабушки), патологии щитовидной железы (гиперфункция щитовидной железы у тети).
Со слов матери, низкие темпы прибавки массы тела отмечаются с рождения (рис. 2).
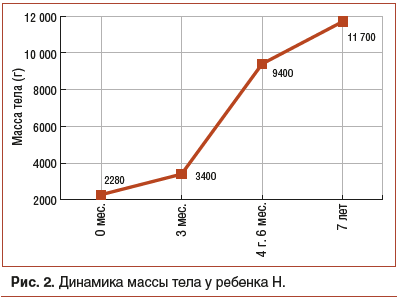
В возрасте 7 лет в связи с ухудшением состояния (выраженная вялость, беспокойство и отсутствие аппетита) бригадой СМП ребенок был доставлен в хирургический стационар с подозрением на кишечную непроходимость. В течение суток проводилась инфузионная терапия без положительной динамики: живот оставался вздутым, болезненным во всех отделах. При рентгенографии органов брюшной полости была выявлена статически расширенная петля тонкой кишки. Выполнена лапаротомия с резекцией некротизированного участка подвздошной кишки (около 15 см). В динамике проведена релапаротомия в связи с отрицательной динамикой состояния, выявлены множественные перфорации тонкой кишки, перитонит. После повторной релапаротомии пассаж по кишечнику восстановился на 5–6-е сут после оперативного лечения. Энтеральное питание проводилось полимерной изокалорийной смесью на основе цельного белка коровьего молока с постепенным расширением рациона. В послеоперационном периоде потеря веса составила более 3 кг.
На момент госпитализации в наше отделение, через 3 мес. после операции в рационе каши с добавлением молока, овощные пюре, протертое мясо (индейка, говядина); кисломолочные продукты (йогурт, кефир); фрукты (преимущественно банан). В связи с абдоминальным болевым синдромом и выраженным метеоризмом мама корректировала питание с уменьшением объема и кратности приема пищи, сокращая количество кормлений до 3–4 приемов пищи в день).
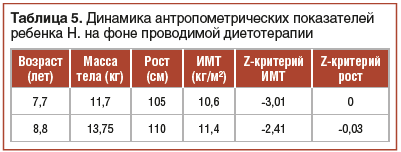
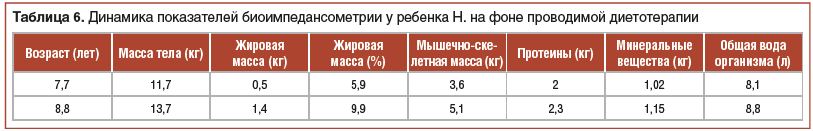
При госпитализации в ФГБУН «ФИЦ питания и биотехнологии»: возраст ребенка 7 лет 7 мес., выраженная диффузная мышечная гипотония, ребенок сидит только при помощи поддержки. V класс GMFCS. Масса тела — 11,7 кг, рост лежа — 105 см. ИМТ — 10,6 кг/м2. Z-критерий ИМТ <-3; Z-критерий рост/возраст -0,23; Z-критерий вес/возраст -1,56. Физическое развитие среднее, тяжелый дефицит массы тела (Z-критерий ИМТ <-3). Выраженная сухость кожи лица, туловища и конечностей, гиперемия кожи щек. На передней брюшной стенке послеоперационный рубец по срединной линии. Очаги алопеции в теменной и затылочной области, со слов мамы, появившиеся после операции. Навык глотания сформирован, навык жевания развит незначительно. Речь отсутствует. Живот вздут, урчание при пальпации по ходу всего кишечника. Задержка стула до 4–5 дней. При обследовании: эозинофилия 5,6%, общий белок, липидограмма, электролиты, показатели обмена железа не имеют диагностически значимых отклонений. Тиреоидный профиль в норме. Витаминный статус — снижение уровня витамина D (26,9 нг/мл). При аллергообследовании выявлено наличие специфических IgE (II класс) к казеиновой фракции белка коровьего молока. По данным УЗИ органов брюшной полости, выявлены признаки дисфункции билиарного тракта (S-образная деформация). При определении состава тела методом биоимпедансометрии выявлено снижение основных компонентов состава тела относительно индивидуальной нормы с максимальной недостаточностью жирового компонента. Дефицит массы тела составил 25,5%, жировой массы — 58,33%, мышечно-скелетной массы — 33,33%, протеинов — 28,57%, минеральных веществ — 1,97%.
При проведении оценки фактического питания в домашних условиях выявлен резкий дефицит энергетической ценности рациона и основных компонентов, составляющий более 50% от рекомендованных физиологических потребностей. Энергетическая ценность рациона составила 746 ккал/сут (норма — 1800 ккал/сут), белок — 26 г/сут (норма — 54 г /сут), жиры — 31 г/сут (норма — 60 г/сут), углеводы — 97 г/сут (норма — 261 г/сут).
На основании данных анамнеза, жалоб, клинического осмотра и лабораторно-инструментального обследования выставлен диагноз: Тяжелая белково-энергетическая недостаточность. Дефицит массы тела, тяжелый (Z-критерий ИМТ <-3). Синдром короткой кишки. Состояние после резекции участка подвздошной кишки. Дисфункция билиарного тракта на фоне деформации желчного пузыря. Пищевая аллергия, кожная и гастроинтестинальная форма (белок коровьего молока). Гнездная алопеция. Недостаточность витамина D. Детский церебральный паралич, тетрапарез.
У ребенка с ДЦП дефицит массы тела имеет многофакторные причины: резекция участка тонкой кишки, тяжесть течения ДЦП (слабый навык жевания), наличие гастроинтестинальных проявлений (метеоризм, абдоминальный болевой синдром, данные аллергообследования — реакция на белок коровьего молока и его казеиновую фракцию), а также алиментарный дефицит энергетической ценности рациона и основных его компонентов.
Ребенку была рекомендована элиминационная диета с исключением причинно-значимых аллергенов; продуктов, содержащих белок коровьего молока. С учетом показателей пищевого статуса, а также характера сопутствующей патологии была проведена нутритивная поддержка с использованием лечебной полуэлементной энтеральной смеси на основе глубокого гидролиза белка молочной сыворотки с содержанием среднецепочечных триглицеридов не менее 50% от общего содержания жиров Пептамен Юниор, предназначенной для питания детей от 1 года до 10 лет, в объеме 400–600 мл/сут (второй завтрак и/или полдник и на ночь). Проведена коррекция питания с учетом выявленного дефицита рациона.
В ходе катамнестического наблюдения на фоне проводимой диетотерапии отмечалась положительная динамика в виде нормализации характера и частоты стула, купирования абдоминального болевого синдрома, увеличения массы тела и темпов линейного роста, показателей моторного развития (табл. 5 и 6).
Обсуждение
Дефицит массы тела различной степени выраженности и нарушения работы желудочно-кишечного тракта являются одними из наиболее частых проблем у пациентов с неврологической патологией, а частота их возникновения значительно увеличивается при тяжелых двигательных нарушениях [6]. Причиной низких темпов прибавки массо-
ростовых показателей, помимо особенностей течения основного заболевания в виде когнитивных нарушений и нарушения функций жевания и глотания, может являться такая сопутствующая патология, как пищевая аллергия [7, 8].
По данным литературы, распространенность аллергических заболеваний у пациентов с тяжелыми двигательными и интеллектуальными нарушениями не отличается от показателей населения в целом (составляет от 30 до 60% в популяции), а ведущим по клинической значимости аллергеном в детском возрасте является белок коровьего молока. С высокой частотой регистрируются аллергические реакции на белки злаков: глиадин, глютен, реже — белки кукурузы, риса, гречихи [8, 9].
Основным методом лечения аллергических заболеваний, основанным непосредственно на этиологии заболевания, у пациентов данной группы является элиминационная диета, т. е. исключение из рациона питания продуктов, относящихся к причинно-значимым аллергенам. Детям с аллергией на белок коровьего молока в качестве основного источника питания или в рамках нутритивной поддержки рекомендовано использование специализированных лечебных смесей на основе высокогидролизованного молочного белка или аминокислот, что является наиболее оптимальной схемой профилактики и коррекции нарушений нутритивного статуса [3, 10]. Применение продуктов данной категории улучшает поступление питательных веществ за счет компонентов, входящих в их состав, и способствует нормализации процессов всасывания и микроциркуляции в кишечнике.
При выборе продуктов для нутритивной поддержки необходимо учитывать:
возрастные потребности в пищевых веществах и энергии, т. к. недостаточная нутритивная поддержка не даст должного эффекта, а избыточная может привести к гипералиментации и метаболическим нарушениям;
патогенез основного заболевания, степень пищевых нарушений и характер сопутствующей патологии (дисфагия, гастроэзофагеальная рефлюксная болезнь, пищевая аллергия и др.) [3, 11].
На основании результатов исследований, проведенных российскими и зарубежными авторами, использование в качестве нутритивной поддержки специализированных продуктов питания данной категории способствует увеличению массо-ростовых показателей, купированию гастроинтестинальных симптомов, снижению частоты эпизодов гастроэзофагеального рефлюкса / рвоты, что уменьшает частоту хирургических вмешательств (фундопликация по Ниссену) [12, 13]. Наличие в составе смеси жирового компонента с преобладанием среднецепочечных триглицеридов улучшает усвоение эссенциальных жирных кислот и жирорастворимых витаминов и позволяет обеспечивать усвоение жиров без участия желчных кислот и панкреатической липазы, что свидетельствует о снижении степени стимуляции поджелудочной железы.
Заключение
Дети с нарушениями нутритивного статуса и неврологической патологией (в т. ч. ДЦП) нуждаются в пристальном врачебном внимании, регулярном контроле массо-ростовых показателей и своевременной и адекватной коррекции рациона с обязательным включением лечебных энтеральных смесей. При выборе лечебных энтеральных смесей требуется персонализированный подход с учетом особенностей пациента: возраста, степени дефицита массы тела, гастроинтестинальных симптомов и пищевых ограничений. Применение в качестве нутритивной поддержки специализированных продуктов питания у данной категории пациентов способствует увеличению массо-ростовых показателей, купированию симптомов со стороны желудочно-кишечного тракта, в т. ч. гастроэзофагеального рефлюкса и/или рвоты, что позволяет избежать выполнения хирургических вмешательств.
Информация с rmj.ru






