Материал и методы: 70 пациентов с хронической болью в спине были разделены на 2 группы. Первая группа (n=35) получала по интермиттирующей схеме парентерально Хондрогард по 2,0 мл (200 мг) в/м через день № 20 и Сустагард Артро по 3,0 мл (2,0 мл — 200 мг в/м действующего вещества и 1,0 мл растворителя) через день № 20. Кроме этого, каждый пациент выполнял специальный индивидуальный комплекс упражнений для коленного сустава и БНС. Пациентам 2-й группы (n=35) была назначена стандартная терапия нестероидными противовоспалительными препаратами (НПВП). Эффективность лечения оценивалась по визуальной аналоговой шкале боли (ВАШ) 100 мм, тяжесть остеоартроза коленных суставов — по валидизированной шкале WOMAC, качество жизни — по валидизированной русскоязычной версии общего опросника EuroQol-5D.
Результаты исследования: у пациентов 1-й группы к 6-й неделе боль уменьшилась на 68,7%, во 2-й группе — на 48,5%. К концу 2-го и 6-го месяцев наблюдения у пациентов 1-й группы средний балл интенсивности боли по ВАШ не превышал среднего балла, зафиксированного в конце инъекционного курса терапии. При оценке качества жизни по опроснику EuroQol-5D прирост общего показателя к концу курса терапии (5-й визит) в 1-й группе составил 39,1%, во 2-й группе — лишь 8,2% (p
Заключение: парентеральная интермиттирующая терапия препаратами Хондрогард и Сустагард Артро в совокупности с ежедневной ходьбой и индивидуально подобранным комплексом физических упражнений позволяет добиться эффективного обезболивания в течение 6 нед. терапии у 91,4% пациентов, в то время как терапия НПВП — лишь у 62,9%. Терапия пациентов 1-й группы в течение 6 нед. позволяет купировать боль в нижней части спины на 69% в сравнении с исходным уровнем, превосходя эффект традиционной терапии НПВП более чем на 23%. Отмечается длительный эффект последействия проведенной в 1-й группе терапии. В 1-й группе показатель качества жизни за 6 мес. увеличился на 56,6%, тогда как в группе сравнения на 1%.
Ключевые слова: межпозвонковый диск, боль в спине, остеоартроз, хондроитина сульфат, глюкозамина сульфат, Хондрогард, Сустагард Артро.
Для цитирования: Наумов А.В., Ткачева О.Н., Ховасова Н.О. Обострения хронической боли в спине у коморбидных больных: терапия на перспективу // РМЖ. Медицинское обозрение. 2018. №5. С. 35-42
A.V. Naumov1, О.N. Tkacheva1, N.O. Khovasova2
1 «Russian gerontological scientific and clinical center» — branch of Pirogov Russian National Research Medical University, Moscow
2 A.I. Evdokimov Moscow State University of Medicine and Dentistry
Aim: to evaluate the effectiveness and safety of the intermittent scheme of parenteral administration of Chondrogard and Sustaguard Artro in patients with relapse of chronic low back pain (CLBP).
Patients and Methods: 70 patients with chronic back pain were divided into 2 groups. The 1st group (n=35) received Chondrogard parenterally according to the intermittent scheme, 2.0 ml (200 mg) IM, alternate days No. 20, and Sustaguard Artro 3.0 ml (2.0 ml — 200 mg IM of active ingredient and 1.0 ml of solvent) alternate days No. 20. In addition, each patient had an individual exercise program for the knee joint and CLBP. Patients of the 2nd group (n=35) were prescribed standard therapy with nonsteroidal anti-inflammatory drugs (NSAIDs). The effectiveness of the treatment was assessed according to a visual analog scale (VAS) of 100 mm, the severity of knee osteoarthritis — according to the validated WOMAC scale, the quality of life — according to the validated Russian version of the EuroQol-5D.
Results: by the 6th week in patients of the 1st group the pain decreased by 68.7%, in the 2nd group — by 48.5%. At the end of the 2nd and 6th months of follow-up in patients of the 1st group, the average score of pain intensity according to the VAS did not exceed the average score recorded at the end of the injection therapy. When assessing the quality of life according to the EuroQol-5D, the increase in the overall value at the end of the therapy (on the 5th visit) in the 1st group was 39.1%, in the 2nd group — only 8.2% (p<0.05). In further visits, in patients of the 2nd group, this value decreased. All patients of both groups had pain syndrome in the knee joints, the pain analysis according to the VAS revealed a stable positive dynamics in the patients of the 1st group during the treatment.
Conclusion: parenteral intermittent therapy with Chondrogard and Sustaguard Artro, in combination with daily walking and individually selected exercise complex allows to achieve effective analgesia during 6 weeks of therapy in 91.4% of patients, while therapy with NSAIDs — only in 62.9%. Therapy of patients of the 1st group for 6 weeks allows to reduce pain in the lower back by 69% in comparison with the baseline, exceeding the effect of traditional NSAID therapy by more than 23%. There is a long-lasting aftereffect effect in the 1st group of therapy. In the 1st group, the quality of life indicator for the six months increased by 56.6%, while in the the 2nd group it was 1%.
Key words: intervertebral disc, back pain, osteoarthritis, chondroitin sulfate, glucosamine sulfate, Chondrogard, Sustaguard Artro.
For citation: Naumov A.V., Tkacheva О.N., Khovasova N.O. Exacerbations of chronic back pain in comorbid patients: long-term therapy // RMJ. Medical Review. 2018. № 5. P. 35–42.
Статья посвящена проблеме обострения хронической боли в спине у коморбидных больных. Представлены результаты оригинального исследования, целью которого явилась оценка эффективности и безопасности интермиттирующей схемы парентерального введения Хондрогарда и Сустагарда Артро у пациентов с рецидивом хронической боли в нижней части спины
Содержание статьи
Актуальность проблемы
Масштабы медико-социальной проблемы боли в спине потрясают не только воображение врачей всех специальностей, но и грозят общепопуляционной пандемией. Во втором десятилетии XXI в. более 90% человеческой популяции на Земле подвержены болевым проявлениям в спине, ограничивающим профессиональную деятельность, выполнение бытовых задач и оптимальный уровень социализации [1].
Хроническая боль в спине является главной причиной нетрудоспособности [2]. Болевые синдромы в структуре глобального бремени болезней занимают ведущее место во всех странах мира, приводя на протяжении последних двух десятилетий к значительному увеличению количества лет, прожитых с нарушенным здоровьем, и значительному ухудшению качества жизни населения.
В США отмечается ежегодное (с 1992 г.) увеличение распространенности боли в нижней части спины (БНС) на 11,6% во всех демографических группах [3].
Эпидемиологические исследования, изучавшие структуру причин БНС, позволили установить: 80–85% болевых синдромов связаны с неспецифической болью в спине, 10–15% — с радикулопатиями, 1–5% — со специфическими болями в спине, обусловленными серьезной патологией [4].
Проведенные клинические исследования с постанализом эффективности комплексной терапии боли выявили крайне низкую эффективность терапии БНС. В среднем лишь 20% пациентов удовлетворены обезболивающей терапией [5].
Анализ причин низкой эффективности методологических подходов к терапии БНС выявляет несколько факторов:
отсутствие в рутинной практике единого подхода к нозологической характеристике морфологических изменений в структурах позвоночника;
низкое внимание к «красным флагам» при боли в спине (ночные боли и другие проявления воспалительной боли, отсутствие алгических поз и приемов, кратковременное улучшение после физической нагрузки, эффективность только диклофенака натрия, симптомы, указывающие на аневризму брюшного отдела аорты, и пр.);
игнорирование в лечебной тактике БНС декомпенсации отдельных нозологических форм коморбидности (гиперхолестеринемия, гиперурикемия, анемия, декомпенсация углеводного обмена, гипотиреоз, обострение хронической обструктивной болезни легких, коллагенозы, инфекционные поражения позвоночника);
сведение лечебной тактики только к назначению нестероидных противовоспалительных препаратов (НПВП) и миорелаксантов;
отсутствие адекватного лечения нейропатического и психогенного компонентов болевого синдрома;
низкая доступность и низкая приверженность полноценным реабилитационным программам;
недооценка роли травматических повреждений, в т. ч. связанных с профессиональным спортом.
Нозологическая характеристика БНС
Наиболее очевидной проблемой рутинной клинической практики является отсутствие на территории РФ единого подхода к нозологической характеристике причин болевого синдрома в спине. Оптимальной клинической характеристикой БНС может служить классификация, обозначенная в клинических рекомендациях Ассоциации врачей общей практики (семейных врачей) Российской Федерации «Диагностика и лечение хронической боли в спине в общей врачебной практике» (2014).
Подходы к нозологической характеристике БНС
Этиопатогенетический подход
Первичная БНС обусловлена дистрофическими и/или функциональными изменениями в тканях позвоночника (межпозвонковые суставы, межпозвонковые диски (МПД), фасции, мышцы, сухожилия) с возможным вовлечением смежных структур (корешок, нерв).
Вторичная БНС в основе своей имеет причины: врожденные аномалии (люмбализация, spina bifida, и т.д.), травмы (переломы позвонков, протрузии МПД и др.), артриты (анкилозирующий спондилит, реактивный артрит, ревматоидный артрит и др.), другие заболевания позвоночника (опухоли, инфекции, нарушения метаболизма и др.), проекционные боли при заболеваниях внутренних органов (желудка, поджелудочной железы, кишечника, брюшной аорты и др.), заболевания мочеполовых органов.
Этиологический подход
Вертеброгенные причины БНС: грыжа (пролапс) или протрузия МПД; спондилез; остеофиты; сакрализация или люмбализация; спондилоартроз (фасеточный синдром); анкилозирующий спондилит (болезнь Бехтерева); спинальный стеноз (вторичный стеноз позвоночного канала, отмечающийся часто на фоне его врожденной узости); нестабильность позвоночно-двигательного сегмента (особенно ретроспондилолистез); переломы позвонков (в т. ч. компрессионные на фоне остеопороза); остеопороз; первичные/вторичные опухоли позвоночника, спинного мозга и корешков; врожденные или приобретенные деформации позвоночника (кифосколиоз, сколиоз, гиперлордоз); функциональные биомеханические нарушения в межпозвонковых двигательных сегментах с нарушением двигательного стереотипа.
Невертеброгенные причины БНС: миофасциальный болевой синдром; психогенные боли; отраженные боли в спине при болезнях внутренних органов (сердца, легких, желудочно-кишечного тракта, мочеполовых органов); эпидуральный абсцесс; сирингомиелия.
Временной подход:
острая БНС — продолжается до 6 нед., возникает в ответ на новое повреждение и неразрывно с ним связана;
подострая БНС — продолжается от 6 до 12 нед.;
хроническая БНС — продолжается свыше 12 нед., т. е. сверх нормального периода заживления поврежденных тканей;
рецидивирующая БНС — возникает с интервалом не менее 6 мес. с момента окончания предыдущего обострения, т. е. после полностью бессимптомного периода;
обострение хронической БНС — если боль возникает менее чем через 6 мес. либо если боль до конца не купировалась.
Подход МКБ-10
По МКБ-10, дорсопатии делятся на 3 основные группы: деформирующие дорсопатии, спондилопатии, дорсалгии. В разделе «Спондилопатии» наиболее распространенным дегенеративным изменением является спондилез, в который включены артроз и дегенерация фасеточных суставов (спондилоартроз).
Спондилоартроз
Спондилоартроз, как известно, представляет собой дегенеративный процесс, локализующийся в межпозвонковых суставах, являющихся обычными синовиальными суставами с двумя покрытыми гиалиновым хрящом суставными поверхностями [6]. В настоящее время установлено, что МПД — это разновидность хрящевой ткани, богатой протеогликанами, представленными сульфатированными глиозаминогликанами и коллагеном I и II типов. Протеогликаны диска (пульпозного ядра и фиброзного кольца) представлены хондроитинсульфатами, которые гомологичны протеогликанам суставных хрящей периферических суставов. Показано, что процессы дегенерации в межпозвонковых и периферических суставах принципиально не различаются [7].
Доказано, что процессы поражения хряща в периферических суставах и суставах позвоночника при остеоартрозе (ОА) протекают по однотипному механизму. В основе лежит дисбаланс синтеза и деградации матрикса (снижение выработки протеогликанов, повышение активности протеолитических ферментов и др.) и развитие асептического воспаления (продукция интерлейкинов (ИЛ) — ИЛ-1, ИЛ-6, простагландинов, фактора некроза опухоли α — ФНО-α и др.).
Спондилоартроз — самая частая причина болей в пояснице у лиц пожилого возраста. При артрозе фасеточных суставов боль обычно двусторонняя, локализуется, в отличие от дискогенной, паравертебрально, а не по средней линии, усиливается при длительном стоянии и разгибании и уменьшается при ходьбе и сидении.
Установлено, что изменения в МПД, обусловленные старением, появляются у лиц старше 30 лет изначально в матриксе пульпозного ядра с появления очагов зернистого распада, гибели части клеток. Эти изменения нарушают однородность и упорядоченность структуры, ведут к потере воды, снижению внутридискового давления и ухудшению функциональных свойств диска. Дегенерация МПД — многофакторный процесс. В основе вырождения диска лежит генетический дефект. Идентифицировано несколько генов, ответственных за прочность и качество костно-хрящевых структур, — гены синтеза коллагена IX типа, рецептора витамина D, аггрекана, металлопротеиназы. Генетическая «поломка» носит системный характер, что подтверждается высокой распространенностью дегенерации МПД у больных ОА периферических суставов. Триггерным фактором развития дегенеративных изменений в диске служит структурное повреждение фиброзного кольца, приводящее к последующим изменениям в пульпозном ядре и замыкательных пластинах. Структурное повреждение элементов диска приводит в общем случае к развитию каскада метаболических реакций — активного процесса заживления. C возрастом способность к эффективной репарации ослабевает, что приводит к прогрессированию дегенеративных процессов [8].
Традиционно терапия БНС включает местные и системные НПВП, реже — миорелаксанты (польза от применения не доказана) [9].
Учитывая совокупность воспалительных и дегенеративных изменений в МПД, сопровождающихся апоптозом клеточных структур, воздействие на метаболизм МПД является одной из новых и современных задач комплексной терапии боли.
Как наиболее приемлемые средства, способные влиять на метаболические процессы в хрящевой, синовиальной и костной ткани, подавляя синтез провоспалительных медиаторов, для терапии БНС используются хондроитина сульфат (ХС, Хондрогард) и глюкозамина сульфат (ГС, Сустагард Артро).
Патогенетическое обоснование использования ХС и ГС при БНС понятно и заключается в следующем: эти препараты подавляют экспрессию матричных металлопротеиназ, ИЛ-1b и ИЛ-8, циклооксигеназы-2, ФНО-α, оказывают противовоспалительный эффект за счет подавления каскада асептического воспаления; кроме того, являясь нутриентами, представляющими собой гликозаминогликаны, расположенные в экстрацеллюлярном матриксе хряща МПД, ХС и ГС ингибируют свободные радикалы, способные вызывать разрушение хряща и коллагена, угнетают активность ферментов, вызывающих поражение хрящевой ткани, участвуют в синтезе гликозаминогликанов и увеличивают продукцию внутрисуставной жидкости; к тому же ГС является предшественником гликозаминогликанов и играет важную роль в синтетических процессах. Как показано в целом ряде экспериментальных исследований, данные эффекты способствуют замедлению дегенеративных процессов и восстановлению структуры хрящевой ткани [10].
К настоящему времени накоплена обширная доказательная база для ХС и ГС в отношении периферического ОА, больше всего в отношении ОА коленных суставов [11–15]. В то же время в последние годы опубликован ряд обнадеживающих результатов эффективности хондроитина и глюкозамина при БНС в комплексной терапии боли [16].
В настоящей работе продемонстрирована эффективность парентеральных форм ХС и ГС.
Впервые применение хондропротекторов (ХС) при
хронической боли в спине предпринято в исследовании
K.D. Christensen, L.R. Bucci (1989), где была продемонстрирована их эффективность [17].
Отдельного внимания заслуживает работа А.Е. Барулина и О.В. Курушиной (2014) [18], в которой авторы сочетали паравертебральное и внутримышечное введение ХС. Авторы делают заключение, что ХС целесообразно вводить паравертебрально и/или локально возле крупного сустава (внутримышечно), что позволяет быстрее и эффективнее достигать максимальных концентраций ХС в регионарном кровотоке пораженных участков опорно-двигательного аппарата и соответственно повышать эффективность лечения и сокращать сроки нетрудоспособности.
В то же время в публикациях последних лет отмечается необходимость комбинации ХС и ГС в терапии боли при ОА [10]. Важным доводом в пользу совместного применения ХС и ГС служат результаты фармакопротеомного исследования [19], свидетельствующие о достижении сбалансированности метаболических процессов в хондроците (синтез белка и стрессоустойчивость) при использовании этой комбинации.
Как известно, парентеральные формы ХС и ГС обеспечивают оптимальную концентрацию препаратов в хрящевой ткани уже с первой инъекции, что может влиять и на скорость наступления обезболивающего эффекта. Именно поэтому мы решили провести исследование эффективности и безопасности парентеральной интермиттирующей схемы введения ХС и ГС.
Цель исследования — оценка эффективности и безопасности интермиттирующей схемы парентерального введения ХС и ГС в совокупности с ежедневной ходьбой и индивидуально подобранным комплексом физических упражнений у пациентов с рецидивом хронической БНС.
Материал и методы
Проведено открытое сравнительное исследование. В результате скрининга 118 больных с хронической болью в спине отобрано 70 пациентов, рандомизированных на 2 равные группы методом случайных чисел.
Критерии включения в исследование: БНС (описываемая терминами: «дорсопатия», «спондилоартрит», «спондилопатия», «протрузия диска», «грыжа диска без неврологического дефицита») >40 мм по визуальной аналоговой шкале боли (ВАШ); ОА коленного сустава II–III рентгенологической стадии по Kellgren — Lowrence; готовность пациента отказаться от приема иных обезболивающих препаратов, кроме назначенных в исследовании; согласие следовать требованиям протокола в течение всего периода исследования; доступность пациента для консультаций и наблюдения в течение всего периода исследования начиная с момента включения в него; готовность отказаться от дополнительного приема НПВП (в 1-й группе) на весь период исследования; подписание информированного согласия на участие в исследовании.
Критерии исключения: отчетливый невропатический и/или психогенный компонент болевого синдрома; онкологические заболевания любой локализации; сахарный диабет 1-го типа; хроническая болезнь почек с выраженной почечной недостаточностью (уровень креатинина ≥180 ммоль/л, скорость клубочковой фильтрации
Для изучения эффективности и безопасности интермиттирующей схемы парентерального введения ХС и ГС в совокупности с ежедневной ходьбой и индивидуально подобранным комплексом физических упражнений у пациентов с рецидивом хронической БНС были определены первичные и вторичные точки оценки.
Первичные точки: процент пациентов, ответивших на терапию, оцененный по уменьшению боли, согласно общепринятым стандартам (уменьшение боли по ВАШ на ≥50%); оценка динамики боли по ВАШ; сроки наступления обезболивания, удовлетворяющие пациента.
Вторичные точки: изменение качества жизни; оценка динамики боли в суставах по ВАШ; влияние на основные биохимические параметры (аланинаминотрансфераза — АЛТ, аспартатаминотрансфераза — АСТ, глюкоза крови, креатинин крови), динамика уровня С-реактивного белка (СРБ) в 1-й группе, частота нежелательных явлений.
Включенные в исследование пациенты были разделены на 2 группы в зависимости от стратегии терапии болевого синдрома. Пациентам 1-й группы (n=35) была назначена интермиттирующая схема парентерального введения Хондрогарда по 2,0 мл (200 мг) в/м через день № 20 и Сустагарда Артро по 3,0 мл в/м (2,0 мл — 200 мг действующего вещества и 1,0 мл растворителя) через день № 20 [20, 21]. Препараты вводили в режиме чередования: 1-й, 3-й, 5-й, 7-й день и т. д. — ХС; 2-й, 4-й, 6-й день терапии и т. д. — ГС. Каждый пациент был осмотрен терапевтом и неврологом для исключения специфических причин боли в спине. Консилиумом терапевта, невролога и реабилитолога был разработан специальный индивидуальный комплекс упражнений для коленного сустава и нижней части спины. Первые 10 занятий проходили в клинических условиях, далее до конца исследования инструктор ЛФК осуществлял ежедневный мониторинг выполнения упражнений. Все больные 1-й группы выполняли ежедневную индивидуальную норму ходьбы (5000–12 000 шагов в сутки), согласованную консилиумом специалистов. У большинства пациентов эту норму корректировали в зависимости от переносимости, но не менее 10 000 шагов к концу 3-й недели терапии.
Пациентам 2-й группы (n=35, контроль) рекомендована стандартная терапия, включавшая НПВП, подобранные с учетом фармакологического анамнеза терапии боли. Из них 2 (5,7%) пациента, имевших противопоказания к НПВП (прием оральных антикоагулянтов в связи с наличием неклапанной фибрилляции предсердий) получали парацетамол в дозе 2,0–3,0 г/сут.
Были назначены следующие НПВП: кетопрофен (7 пациентов, 35%); лорноксикам (8, 22,9%), диклофенак (10, 28,6%), ибупрофен (8, 22,9%). Дозы определяли индивидуально и титровали в зависимости от индивидуальной чувствительности и переносимости. Терапию НПВП и парацетамолом продолжали до достижения обезболивающего эффекта, удовлетворяющего больного, что соответствует стандартным амбулаторным стратегиям лечения обострений болевого синдрома. Пациентам, которые принимали НПВП, был рекомендован прием пантопразола в дозе 20 мг для профилактики НПВП-гастропатии.
Группы пациентов были сопоставимы по полу и возрасту, антропометрическим и клиническим показателям, а также по коморбидным состояниям. Клиническая характеристика пациентов представлена в таблице 1.
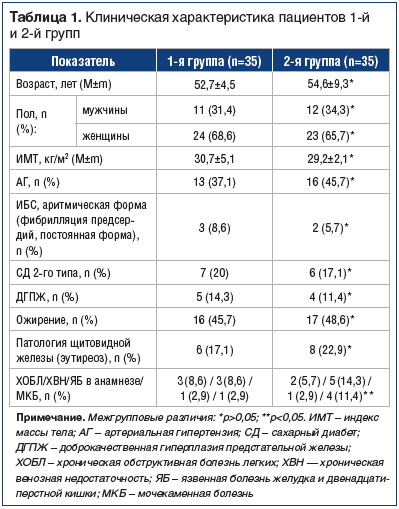
Статистически значимых различий в продолжительности и тяжести ОА, длительности и интенсивности БНС в 1-й и 2-й группах не выявлено. Средняя продолжительность рецидива БНС — 8,1±4,1 и 10,4±5,2 дня соответственно. Характеристика хронической БНС и тяжести ОА у пациентов 1-й и 2-й групп приведена в таблице 2.
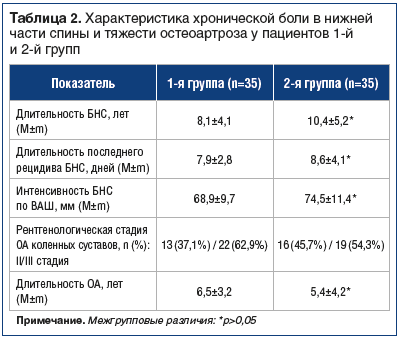
Оценивали эффективность лечения по ВАШ, 100 мм (в начале, на 10-й, 20-й дни, через 6 нед., 2 мес., 6 мес. исследования); тяжесть ОА коленных суставов — с помощью валидизированной шкалы WOMAC (в начале, через 6 нед., 2 мес. и через 6 мес. исследования); качество жизни — по валидизированной русскоязычной версии общего опросника EuroQol-5D (в начале, через 6 нед. и через 6 мес. исследования) [19].
Для анализа безопасности терапии в начале и в конце исследования были изучены уровни глюкозы в крови натощак, АЛТ, АСТ, креатинина. Кроме того, регистрировали частоту любых нежелательных явлений. У пациентов 1-й группы дополнительно изучали уровень СРБ в сыворотке крови.
База данных создана в программе Microsoft Exel 2011 для MacOS. Вычисляли средние значения и стандартные отклонения. Достоверность различий оценивали по критерию Стьюдента (двухпарный с неравным отклонением). Анализ данных проводили в программах Microsoft Exel.
Результаты
Все включенные пациенты закончили исследование.
У пациентов 1-й группы к концу инъекционного курса терапии (6 нед.) в 32 (91,4%) случаях уменьшение БНС составило >50%, в среднем — на 68,7% (p
К концу приема НПВП во 2-й группе удалось уменьшить боль в спине в среднем на 48,5% (p
К 10-му дню терапии у пациентов обеих групп отмечено отчетливое улучшение. Как видно из данных таблицы 3, у пациентов 1-й группы при использовании интермиттирующей схемы парентерального введения ХС и ГС в совокупности с выполнением лечебной физической нагрузки наблюдалось более выраженное уменьшение показателя боли, чем у пациентов 2-й группы — на 26,4% и 17,2% соответственно.
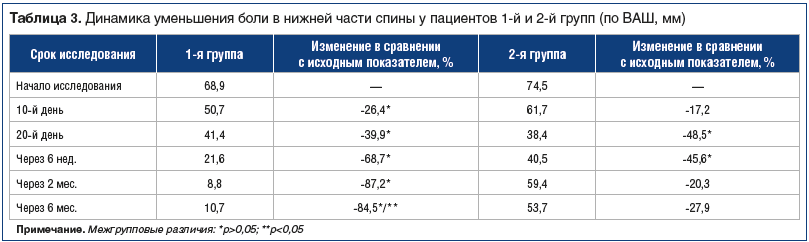
К 3-му визиту на 20-й день большинство пациентов во 2-й (контрольной) группе закончили прием назначенного препарата. Отмечена значительная положительная динамика уменьшения боли, что можно объяснить эффектом курсового приема НПВП. Однако в последующие визиты более выраженное уменьшение боли отмечено у больных 1-й группы.
Наиболее значимым результатом исследования стал длительный эффект проведенной терапии. Как видно из рисунка 1, к концу 2-го и 6-го месяцев наблюдения у пациентов 1-й группы средний балл интенсивности боли по ВАШ не превышал балла, зафиксированного в конце инъекционного курса терапии.
Средний срок наступления отчетливого обезболивающего эффекта, удовлетворяющего пациентов, составил 23,1±3,9 дня в 1-й группе.
У большинства пациентов 2-й группы НПВП отменены в среднем на 17,6±4,7 день. Лишь 2 пациента принимали парацетамол на протяжении 6 нед. исследования.
Таким образом, показатели эффективности парентеральной интермиттирующей терапии ХС и ГС в совокупности с ежедневной ходьбой и индивидуально подобранным комплексом физических упражнений превосходили показатели эффективности стандартной (амбулаторной) терапии НПВП (до достижения приемлемого обезболивающего эффекта). В 1-й группе эффективное обезболивание достигнуто у 91,4% пациентов, тогда как во 2-й группе — лишь у 62,9 %.
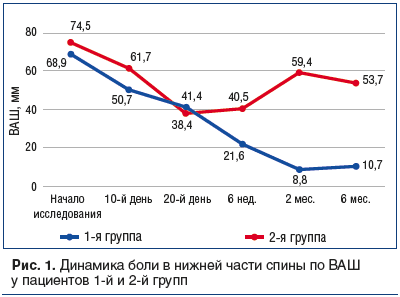
Качество жизни, согласно валидизированной русскоязычной версии общего опросника EuroQol-5D, к концу инъекционного курса (5-й визит) в 1-й группе улучшилось на 39,1%, тогда как во 2-й группе — лишь на 8,2% (межгрупповое различие: p<0,05). У пациентов 2-й группы в последующие визиты выявлено снижение качества жизни по опроснику EuroQol-5D (рис. 2).
В то же время у пациентов 1-й группы как после окончания инъекционного курса, так и на последующих визитах установлена положительная динамика изменений балла по опроснику EuroQol-5D. Так, в конце 2-го месяца средний балл составил 85,7±9,4, в конце 6-го месяца — 87,2±10,8 (р
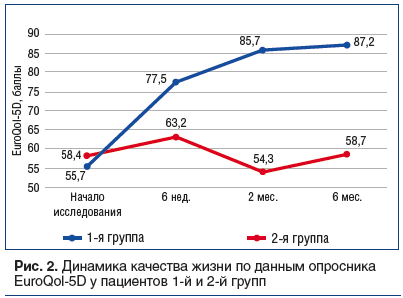
Все включенные в исследование пациенты в обеих группах имели болевой синдром в коленных суставах. Анализ динамики болевого синдрома в коленных суставах по ВАШ выявил устойчивую положительную динамику боли у пациентов 1-й группы (рис. 3).
В 1-й группе через 2 и 6 мес. наблюдения интенсивность боли по ВАШ составила 14,1±7,8 и 10,2±9,6 соответственно. Изменения достоверны при сравнении с началом исследования и недостоверны при сравнении между показателями 2-го и 6-го месяцев.
Межгрупповая разница по уменьшению боли в коленных суставах к концу инъекционного курса терапии составила 22,7% (p
У пациентов обеих групп не отмечено нежелательных явлений ни во время активного лечения, ни во время последующего наблюдения.
На протяжении исследования основные биохимические показатели не претерпели существенных изменений (табл. 4).
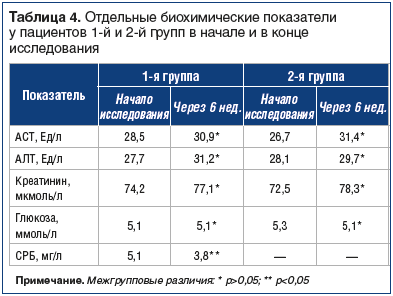
Это относится и к уровню глюкозы в крови, в том числе у 7 пациентов с СД 2-го типа. Отдельный анализ содержания глюкозы в крови натощак у этих больных показал, что в начале и в конце исследования не отмечено достоверной динамики: 6,4±0,7 и 6,2±0,4 ммоль/л соответственно.
Установлено снижение концентрации СРБ у пациентов 1-й группы на 25% c 5,1 мг/л до 3,8 мг/л (p
Таким образом, 6-недельная парентеральная интермиттирующая терапия ХС и ГС в совокупности с ежедневной ходьбой и индивидуальным комплексом физических упражнений оказалась достаточно безопасной, хорошо переносилась больными, не вызывала изменений почечных и печеночных функций, не влияла на углеводный обмен. За 6 нед. терапии уровень СРБ уменьшился на 25% в среднем по группе и на 38,1% у больных, у которых этот показатель изначально был повышен.
Выводы
Применение парентеральной интермиттирующей терапии ХС и ГС в совокупности с ежедневной ходьбой и индивидуально подобранным комплексом физических упражнений в течение 6 нед. позволяет добиться эффективного обезболивания у 91,4% пациентов, в то время как терапия НПВП — лишь у 62,9%.
Парентеральная интермиттирующая терапия ХС и ГС в совокупности с ежедневной ходьбой и индивидуально подобранным комплексом физических упражнений в течение 6 нед. позволяет купировать боль в нижней части спины на 69% в сравнении с исходным уровнем, превосходя эффект традиционной (амбулаторной) терапии НПВП более чем на 23%.
В 1-й группе отмечена устойчивая положительная динамика боли на 2-м и 6-м месяцах наблюдения, что указывает на длительный эффект лечения по данной лечебной методике.
В 1-й группе показатель качества жизни за 6 мес. увеличился на 56,6%, тогда как в группе сравнения лишь на1%.
У пациентов 1-й группы содержание СРБ снизилось в среднем на 25% и на 38,1% у больных с исходно
повышенным уровнем СРБ.
Нежелательных явлений терапии в обеих группах не выявлено.
Литература
1. GPI 2017. Global Report Findings. [Электронный ресурс]. URL: https://www.gsk.com/media/3814/global-pain-index-2017-report.pdf) (дата обращения: 14.08.2018).
2. Global Burden of Disease Study 2013 Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013 // Lancet. 2015. Vol. 386(9995). P.743–800.
3. Неврология. Национальное руководство / под ред. Е.И. Гусева, А.Н. Коновалова, В.И. Скворцовой, А.Б. Гехт. М.: ГЭОТАР-Медиа, 2010. С.431–438 [Nevrologiya. Natsional’noye rukovodstvo / pod red. Ye.I. Guseva, A.N. Konovalova, V.I. Skvortsovoy, A.B. Gekht. M.: GEOTAR-Media, 2010. S.431–438 (in Russian)].
4. Low back disorders. In: Hegmann K.T. editor(s). Occupational medicine practice guidelines. Evaluation and management of common health problems and functional recovery in workers. 3rd ed. Elk Grove Village (IL): American College of Occupational and Environmental Medicine (ACOEM). 2011. P.333–796.
5. Breivik H., Collett B., Ventafridda V. et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment // Eur. J. Pain. 2006. Vol. 10. P.287–333.
6. Wasiak R., Kim J., Pransky G. Work disability and costs caused by recurrence of low back pain: longer and more costly than in first episodes // Spine. 2006. Vol. 31(2). P.219–225.
7. Шостак Н.А. Современные подходы к терапии боли в нижней части спины: взгляд ревматолога // Справочник поликлинического врача. 2006. №9. С.44–48 [Shostak N.A. Sovremennyye podkhody k terapii boli v nizhney chasti spiny: vzglyad revmatologa // Spravochnik poliklinicheskogo vracha. 2006. №9. S.44–48 (in Russian)].
8. Melrose J., Smith S.M., Little C.B. et al. Recent advances in annular pathobiology provide insights into rim-lesion mediated intervertebral disc degeneration and potential new approaches to annular repair strategies // Eur Spine J. 2008. Vol.17(9). P.1131–1148.
9. Koes B.W., Van Tulder M., Macedo L.G. et al. An updated overview of clinical guidelines for the management of non-specific low back pain in primary care // Eur. Spine J. 2010. Vol. 19. P.2075–2094.
10. Jerosch J. Effects of Glucosamine and Chondroitin Sulfate on Cartilage Metabolism in OA: Outlook on Other Nutrient Partners Especially Omega-3 Fatty Acids // Int J Rheumatol. 2011. Vol. 2011. P.969012. doi:10.1155/2011/969012
11. Pelletier J.P. Chondroitin sulfate may reduce total knee replacement in 12-month multicenter clinical trial in knee osteoarthritis: results from 4-year observation // EULAR. ACR 2012.
12. Singh J.A., Noorbaloochi S., MacDonald R., Maxwell L.J. Chondroitin for osteoarthritis // Cochrane Database Syst Rev. 2015. Vol. 1. CD005614. doi: 10.1002/14651858.CD005614.pub2
13. Hochberg M.C., Martel-Pelletier J., Monfort J. et al. Combined chondroitin sulfate and glucosamine for painful knee osteoarthritis: a multicentre, randomized, double-blind, non-inferiority trial versus celecoxib // Ann Rheum Dis. 2016. Vol.75(1). P.37–44. doi: 10.1136/annrheumdis-2014-206792
14. Navarro S.L., Herrero M., Martinez H. et al. Differences in Serum Protein Biomarkers between Combined Glucosamine and Chondroitin Versus Celecoxib Treatment in a Randomized, Double-Blind Trial in Osteoarthritis Patients // ACR. Presentation Number. 2017. P.1203.
15. Reginster J., Dudler J., Blicharski T., Pavelka K. Pharmaceutical-grade Chondroitin sulfate is as effective as celecoxib and superior to placebo in symptomatic knee osteoarthritis: the ChONdroitin versus CElecoxib versus Placebo Trial (CONCEPT) // Ann Rheum Dis. 2017. Vol. 76(9). P.1537–1543. doi: 10.1136/annrheumdis-2016-210860
16. Шостак Н.А., Правдюк Н.Г., Кондрашов А.А., Швырева Н.М. Боль в спине — возможности симптом-модифицирующей терапии замедленного действия // Consilium Medicum. Неврология и ревматология. (Прил.) 2014. №1. С.5–6 [Shostak N.A., Pravdyuk N.G., Kondrashov A.A., Shvyreva N.M. Bol’ v spine — vozmozhnosti simptom-modifitsiruyushchey terapii zamedlennogo deystviya // Consilium Medicum. Nevrologiya i revmatologiya. (Pril.) 2014. №1. S.5–6 (in Russian)].
17. Christensen K.D., Bucci L.R. Comparison of nutritional supplement effects on functional assessments of lower back patients measured by an objective computer-assisted tester / Second Symposium on Nutrition and Chiropractic. Davenport: Palmer College of Chiropractic, 1989. P.19–22.
18. Барулин А.Е., Курушина О.В. Хондропротекторы в комплексной терапии болей в спине // Трудный пациент. 2014. №3. С.35–38 [Barulin A.Ye., Kurushina O.V. Khondroprotektory v kompleksnoy terapii boley v spine // Trudnyy patsiyent. 2014. №3. S.35–38 (in Russian)].
19. Calamia V., Ruiz-Romero C., Rocha B. et al. Pharmacoproteomic study of the effects of chondroitin and glucosamine sulfate on human articular chondrocytes // Arthritis Res Ther. 2010. Vol. 12(4). R138. doi: 10.1186/ar3077
20. Инструкция по медицинскому применению препарата Хондрогард [Instruktsiya po meditsinskomu primeneniyu preparata Khondrogard (in Russian)]. [Электронный ресурс]. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=b65305ad-ab70-44ad-9121-0da725b98063andt= (дата обращения: 14.08.2018).
21. Инструкция по медицинскому применению препарата Сустагард Артро [Instruktsiya po meditsinskomu primeneniyu preparata Sustagard Artro (in Russian)]. [Электронный ресурс]. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=c4fc9147-8de7-4d38-95c3-ed3190379088andt= (дата обращения: 14.08.2018).
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru