Содержание статьи
Введение
Коронавирусная инфекция COVID-19, несмотря на высокую контагиозность, может клинически протекать относительно легко или бессимптомно. Опасность данной инфекции в том, что у пациентов с нарушениями иммунитета COVID-19 приводит к тяжелой пневмонии и острой дыхательной недостаточности. Выявление групп риска с потенциально тяжелым течением заболевания и снижение соответствующих рисков являются наиболее актуальными задачами профилактики и терапии COVID-19. Для этого необходимо систематизировать данные об:
особенностях патогенеза COVID-19, отличающих его от других коронавирусных инфекций;
роли хронических заболеваний в отягощении течения инфекции COVID-19;
влиянии вируса SARS-CoV-2, вызывающего COVID-19, на хронические заболевания;
способах повышения иммунитета против коронавирусов на уровне популяций.
С целью ответа на эти вопросы мы осуществили систематический компьютерный анализ всего массива публикаций имеющейся научной литературы по коронавирусам (20 600 публикаций в базе данных биомедицинских публикаций PUBMED, в т. ч. 4500 публикаций по COVID-19 и SARS-CoV-2). Анализ был проведен с использованием современных методов анализа больших данных, развиваемых в рамках топологического [1, 2] и метрического [3, 4] подходов к задачам распознавания/классификации. В результате анализа литературы были выделены 49 наиболее информативных рубрик, которые достоверно чаще встречались в выборке публикаций по COVID-19/SARS-CoV-2 — в 3—8 раз чаще, чем в контроле (статьи, найденные по запросу («betacoronavirus OR coronavirus OR coronaviridae) NOT COVID-19»). Полученные результаты представлены на «карте» молекулярной патофизиологии COVID-19, включающей эти 49 молекулярных механизмов (рис. 1). Расстояние между точками, соответствующими терминам, обратно пропорционально совместной встречаемости терминов в исследованной выборке публикаций (чем ближе две произвольные точки, тем чаще встречается совместное употребление двух соответствующих терминов). Приведены диагнозы по МКБ-10, отдельные симптомы, синдромы и соответствующие биологические процессы. Биологические активности по международной номенклатуре GO (Gene Ontology) приведены на рисунке без кодов (см. коды в тексте).
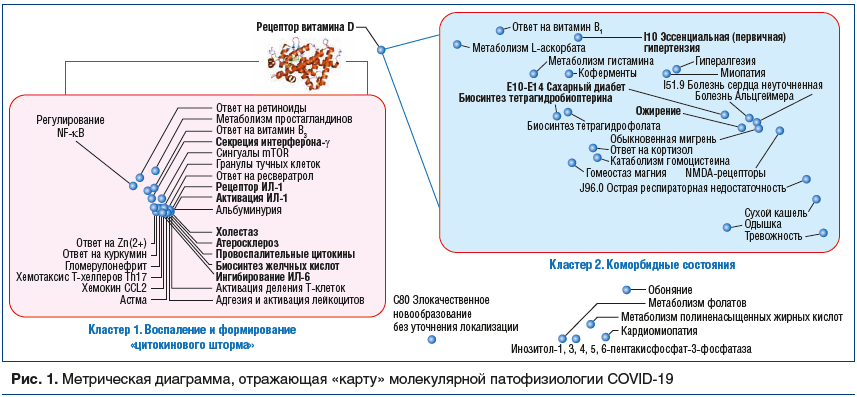
Анализ полученной «карты» молекулярной патофизиологии COVID-19 показал, что наиболее информативные биомедицинские термины, достоверно чаще встречающиеся в публикациях по COVID-19/SARS-CoV-2, сгруппированы в кластер 1 «Воспаление и формирование «цитокинового шторма» и в кластер 2 «Коморбидные состояния». Эти два кластера указывают на «тактический» (кластер 1) и «стратегический» (кластер 2) подходы к профилактике и терапии COVID-19.
![Рис. 2. Полногеномный анализ эффектов витамина D указал на существование 155 белков противовирусной защиты, экспрессия генов которых регулируется витамином D [14] Рис. 2. Полногеномный анализ эффектов витамина D указал на существование 155 белков противовирусной защиты, экспрессия генов которых регулируется витамином D [14]](https://medblog.su/wp-content/uploads/2020/07/1594411580_253_o-perspektivah-ispolzovaniya-vitamina-d-i-drugih-mikronutrientov-v-profilaktike-i-terapii-covid-19-gromova-o-a-torshin-i-yu-malyavskaya-s-i-lapochkina-n-p.png)
«Цитокиновый шторм» (лавинообразное нарастание концентраций провоспалительных цитокинов) — опасное осложнение COVID-19, приводящее к необходимости применения искусственной вентиляции легких (ИВЛ). Тактически очень важно предотвратить этот процесс, что снизит риск летальных исходов. Наличие у пациента любого очага хронического воспаления (ключевые слова: гломерулонефрит, альбуминурия, холестаз, атеросклероз, ожирение, сахарный диабет (СД) и др.) стимулирует более быстрое усиление синтеза провоспалительных цитокинов: интерлейкина (ИЛ) -1 (GO:0004909, GO:0004908), CCL2 (GO:0035715), ИЛ-6 (GO:0070104), интерферона-γ (GO:1902715). Интерлейкины повышают активацию лейкоцитов (GO:0050902) и распад гранул тучных клеток (GO:0042629). Эти процессы осуществляются при участии витамина D (GO:0008434) и ряда других микронутриентов (цинк, витамин А, витамин РР).
Стратегически важным в терапии и профилактике COVID-19 является борьба с хроническим воспалением, сопровождающим многие коморбидные патологии. Риск более тяжелого течения COVID-19 ассоциирован с наличием у пациента кардиомиопатии, ожирения, артериальной гипертонии (АГ), ишемической болезни сердца (ИБС), СД и др. Снижение избыточного хронического воспаления связано с повышением обеспеченности витамином D (GO:0008434) и другими микронутриентами (цинк, фолаты, витамин B1, магний, омега-3-полиненасыщенные жирные кислоты [омега-3-ПНЖК], миоинозитол, витамин С).
Проведенный анализ указал на взаимосвязь ряда механизмов патогенеза COVID-19 с обеспеченностью организма определенными микронутриентами. Компенсация недостаточности витамина D имеет важное значение и для активации интерферон-зависимого противовирусного иммунитета, и для профилактики «цитокинового шторма», и для снижения хронического воспаления при наличии у пациента коморбидных патологий.
Витамин D является одним из важнейших регуляторов иммунитета [5]. Адекватная обеспеченность организма витамином D — одна из основ противовирусного иммунитета, в т. ч. против вируса гриппа [6]. Уже к 2010 г. были получены результаты многочисленных исследований, указывающие на антибактериальные и противовирусные эффекты витамина D [7]. Метаанализ подтвердил, что дотации витамина D облегчают течение острых респираторных вирусных инфекций (ОРВИ), вызванных вирусом гриппа, и других инфекций респираторного тракта у взрослых и детей [8].
Недостаточность витамина D, встречающаяся у 80% россиян, ассоциирована с нарушениями функционирования врожденного и приобретенного иммунитета и с повышением риска вирусных и бактериальных заболеваний. На фоне недостаточности витамина D у пациента любого возраста возникает хроническое воспаление, которое существенно снижает резистентность организма к бактериальным и вирусным заболеваниям (ОРВИ, грипп, ринит, бронхит, обструктивные заболевания легких) [9].
Активная форма витамина D (кальцитриол 1,25(OH)2D3) способствует снижению уровней провоспалительных цитокинов (ИЛ-6, фактора некроза опухоли α, хемокинов CXCL8, CXCL10), стимулирует синтез антимикробных пептидов (кателицидин, дефенсин), которые также проявляют противовирусные свойства [10]. Иммунорегулирующий эффект витамина D обусловлен широким спектром воздействия кальцитриола на метаболизм и активность макрофагов, T- и B-клеток [11]. Наличие рецептора витамина D (vitamin D receptor, VDR) и витамин-D3-метаболизирующих ферментов (CYP27B1 и др.) в моноцитах, макрофагах, В- и Т-клетках указывает на то, что клетки иммунной системы могут синтезировать и использовать активную форму витамина 1,25(OH)2D3 для поддержания клеточного иммунитета.
В случае COVID-19 витамин D важен тем, что активирует описанные выше системы врожденного противовирусного иммунитета. Коронавирус SARS-CoV-2 (геном NC_045512.2 в базе данных NCBI) — вирус с одноцепочечной РНК, вирион которого содержит особенные спайк-белки (от англ. spike — «шип, острие, острый выступ»), посредством которых вирус активно взаимодействует с тканями организма человека. РНК-вирусы характеризуются высокой степенью мутаций по сравнению с ДНК-вирусами (т. к. вирусные РНК-полимеразы характеризуются низкой степенью исправления ошибок копирования РНК) [12]. Как следствие, разработка эффективной и безопасной вакцины к SARS-CoV-2 крайне затруднена [13]. Поэтому для борьбы с COVID-19 важно использовать все возможные способы повышения противовирусного иммунитета организма человека и, прежде всего, повышение обеспеченности организма витамином D.
Действие витамина D на организм осуществляется при участии VDR, который специфически активируется кальцитриолом и приводит к изменениям экспрессии более 2700 генов человека. Полногеномный системно-биологический анализ связывания рецептора витамина D позволил осуществить систематизацию биологических ролей витамина D для профилактики и терапии широкого круга заболеваний [14]. В частности, было установлено, что в поддержке противовирусного иммунитета участвуют по меньшей мере 155 белков, экспрессия генов которых регулируется VDR (рис. 2).
Полученные в работе [14] результаты полногеномного анализа VDR свидетельствуют, что 19 из 155 генов/белков имеют непосредственное отношение к защите от одноцепочечных РНК-вирусов, к которым относится и SARS-CoV-2. Витамин D стимулирует экспрессию генов, кодирующих:
интерферон-индуцированные белки с тетратрикопептидными повторами (interferon induced protein with tetratricopeptide repeats, IFIT) (гены IFIT1, IFIT3, IFIT5);
интерферон-регуляторные факторы (interferon regulatory factor, IRF) IRF1, IRF3, IRF7, IRF9;
убиквитин-подобный модификатор, или интерферон-стимулируемый ген (interferon-stimulated gene, ISG) 15;
20 кДа экзонуклеазу, стимулируемую интерфероном (ISG20);
белки устойчивости к миксовирусам, в т. ч. к гриппу (MX1, MX2);
2’-5’-олигоаденилатсинтетазы (OAS1, OAS2);
рецептор ретиноидов α (retinoid X receptor alpha, RXRA);
белки — регуляторы противовирусного ответа (белки, содержащие трехсторонний мотив [tripartite motif-containing proteins, TRIM]) TRIM22, TRIM38, TRIM56;
убиквитин, играющий важные роли в поддержании противовирусного иммунитета к РНК-вирусам (UBB, UBC);
«цинковый палец» ZNF175, тормозящий репликацию вирусов и др.
Сопоставим приведенные выше результаты полногеномного анализа рецептора VDR с результатами протеомного анализа микронутриент-зависимых белков противовирусной защиты человека. В протеоме человека содержится более 35 000 белков, из которых 19 820 были аннотированы (т. е. для которых известны выполняемые ими биологические роли). Методом анализа функциональных взаимосвязей [15] мы выделили 820 белков, вовлеченных в защиту организма против вирусов, из которых 178 имели те или иные нутриентные кофакторы (цинк, магний, производные витаминов и др.).
Сопоставление результатов полногеномного анализа рецептора витамина D с результатами протеомного анализа показывает, что многие из белков, участвующих в торможении жизненного цикла одноцепочечных РНК-вирусов, зависят от витамина D и того или иного микронутриента (рис. 3). Рассмотрим эти синергидные взаимодействия витамина D более подробно.
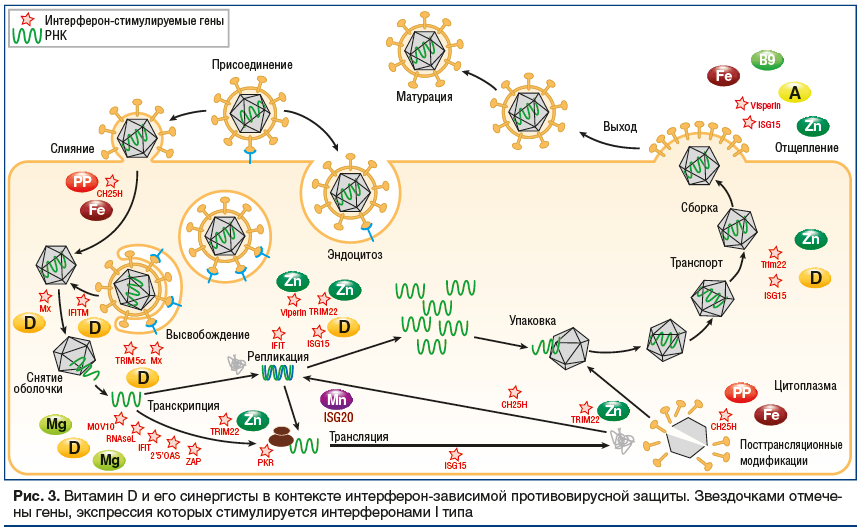
Железо- и витамин-РР-зависимая холестерин-25-гидроксилаза (CH25H) воздействует на вирусы на ранних стадиях инфицирования клетки организма-хозяина (слияние с мембраной клетки) и при «созревании» вирусных белков (в частности, посттрансляционные модификации М-белка вирусной оболочки). Интерферон-индуцированные трансмембранные белки IFITM, экспрессия которых регулируется витамином D, ингибируют слияние вируса с клеткой. Zn-зависимый белок TRIM5α тормозит высвобожение вирусной РНК внутрь клетки. Белок Mx, регулируемый витамином D, блокирует эндоцитарный трафик вирусных частиц и распаковку вирусных рибонуклеокапсидов. Экспрессия генов магний-зависимых олигоаденилатсинтетаз (OAS) активируется рецептором витамина D. Mg-зависимые рибонуклеаза L (RNase L), протеинкиназа R (PKR), белки MOV10, IFIT и Zn-зависимый белок ZAP разрушают вирусную РНК и/или блокируют трансляцию вирусных мРНК. Zn-зависимые белки TRIM22, ISG15 и железо/фолат (В9)-зависимый белок Viperin, экспрессия генов которых регулируется витамином D, ингибируют репликацию вируса и почкование вируса от плазматической мембраны (рис. 3).
Таким образом, рецептор витамина D регулирует экспрессию многих генов защиты организма против одноцепочечных РНК-вирусов. Эта противовирусная система организма будет эффективна и для защиты от коронавирусов. Хотя в случае SARS-CoV-2 пока не имеется данных крупных эпидемиологических исследований, для одноцепочечных РНК-вирусов, вызывающих ОРВИ (RSV, вирус гриппа и др.), было показано, что витамин D ассоциирован с состоянием противовирусной защиты организма.
Например, метаанализ 12 исследований (n=2279) показал, что недостаточная обеспеченность витамином D ассоциирована с бльшим риском инфекционных бронхиолита и пневмонии: у детей с инфекциями уровни 25(OH)D в сыворотке крови были в среднем на 3,5 нг/мл (95% доверительный интервал [ДИ] от 1,8 до 15,7) ниже, чем у здоровых. Также была установлена корреляция между степенью дефицита витамина D и тяжестью течения заболевания [16].
Метаанализ 25 рандомизированных исследований (n=10 933), проведенный с использованием индивидуальных данных пациентов, показал, что дотации витамина D способствовали снижению риска инфицирования ОРВИ в среднем на 12% (скорректированное отношение шансов [ОШ] 0,88, 95% ДИ от 0,81 до 0,96, p<0,00). Среди пациентов, имевших более одного эпизода ОРВИ в год, риск повторного заболевания ОРВИ снижался на 20% на фоне приема витамина D (скорректированное ОШ 0,80, 95% ДИ от 0,69 до 0,93, p=0,004) [17].
Метаанализ 11 плацебо-контролируемых исследований (n=5660) еще раз подтвердил защитный эффект приема препаратов витамина D против вирусных инфекций дыхательных путей (ОШ 0,64, 95% ДИ от 0,49 до 0,84). Защитный эффект был достоверно выше при ежедневном приеме витамина D в средней дозе 1600 МЕ/сут (2–4 мес.) по сравнению с болюсной дозой (100 000 МЕ однократно за 3 мес.). Так, при ежедневном приеме витамина D риск инфекций снижался на 49%, а при использовании «болюсной» дозы — всего на 14% (ОШ 0,51 против 0,86 соответственно, р=0,01) [18].
Дотации витамина D эффективны как адъювантная терапия сепсиса у новорожденных. У пациентов с сепсисом установлены достоверно более низкие уровни 25(OH)D в сыворотке крови, без отличий в уровнях кальция и фосфат-аниона. Дотации витамина D снижали балл тяжести сепсиса, формируемого В-гемолитическим стрептококком группы А, Staphylococcus aureus, Escherichia coli, Haemophilus influenzae [19].
К развитию ОРВИ приводят около 200 возбудителей (вирусы парагриппа, гриппа, аденовирусы, RS-вирусы, риновирусы, герпесвирусы, вирусы Коксаки, коронавирусы и др.), многие из которых, как и SARS-CoV-2, являются одноцепочечными РНК-вирусами. Острая фаза воспаления при респираторно-вирусной инфекции сопровождается отеком слизистой носа и бронхов разной степени выраженности. У пациентов c неблагоприятным аллергическим фоном происходит усиленный выброс гистамина, брадикинина и других медиаторов аллергического воспаления.
Течение инфекции COVID-19 осложнено тем, что описанные выше процессы протекают в гораздо более острой форме, чем при обычном ОРВИ или гриппе. Для SARS-CoV-2 характерен так называемый «цитокиновый шторм» — лавинообразное повышение уровней многочисленных маркеров воспаления (С-реактивный белок, ИЛ-6, интерферон-γ и др.) в крови, которое сопровождается усилением апоптоза лимфоцитов и существенно утяжеляет течение инфекции [20]. Такие «цитокиновые штормы», по всей видимости, являются причиной повреждений легких по типу «матовое стекло» [21] и особенно опасны для пожилых пациентов или молодых пациентов с коморбидными состояниями (ожирение, СД 2 типа и др.).
«Цитокиновый шторм» инициируется при взаимодействии спайк-белков и других белковых частиц на капсиде коронавируса с рецепторами на поверхности клеток. Анализ транскриптома клеток 119 типов из 13 различных тканей человека показал, что молекулами-рецепторами для SARS-CoV-2 являются ангиотензинпревращающий фермент 2 (angiotensin-converting enzyme 2, ACE 2), пептидазы ANPEP, ENPEP, DPP4R и толл-рецепторы [22]. Взаимодействие вирусов с толл-подобными рецепторами (TLR3 и др.) приводит к активации воспалительного сигнального каскада NF-κB. Активация NF-κB стимулирует секрецию проинтерлейкина-1, который подвергается протеолизу при участии каспазы-1, что приводит к активации инфламмасомы и синтезу активного ИЛ-1β, являющегося медиатором воспаления и фиброза легких, лихорадки, стимулируя секрецию других провоспалительных цитокинов. Ингибирование эффектов ИЛ-1β и ИЛ-6 оказывает терапевтическое воздействие при многих патологиях, связанных с воспалением, в т. ч. при вирусных инфекциях. Эффекты ИЛ-1β ослабляются посредством ингибирования сигнального белка mTOR и повышения активности аденозинмонофосфаткиназы (AMPK) [23].
Для снижения риска формирования «цитокинового шторма» при COVID-19 следует применять противовоспалительные средства (в частности, направленные против избыточной активации NF-κB). Витамин D, модулируя активность Т-лимфоцитов, тучных клеток, антиген-презентирующих клеток, способствует ослаблению чрезмерного воспалительного ответа, повышая уровни противовоспалительного ИЛ-10, снижая уровни IgE, цитокинов-аларминов, ИЛ-17, гистамина, лейкотриенов [24].
Для «цитокинового шторма», развивающегося в легких, исключительно важно исходное состояние легочной ткани. Например, если у пациента имеется бронхиальная астма (БА), то эпителий бронхов подвержен постоянной инфильтрации эозинофилами, макрофагами и В-клетками, секретирующими иммуноглобулин Е. Эти изменения в легочной ткани не только облегчают проникновение вируса, но и создают условия для быстрого формирования «цитокинового шторма».
Клинические исследования показали, что сниженные уровни 25(OH)D в крови способствуют повышению риска развития БА (особенно в инфекционно-аллергической форме), обструктивного бронхита, аллергического ринита. В частности, аллергический компонент характеризуется развитием патологической иммунной гиперреакции на аэроаллергены (в т. ч. переносящие вирусные частицы). Метаанализ 21 исследования (n=11 993) показал, что дефицит витамина D был связан с повышенным риском ХОБЛ (ОШ 1,77, 95% ДИ от 1,18 до 2,64, p=0,006) и с более тяжелым течением ХОБЛ (ОШ 2,83, 95% ДИ от 2,00 до 4,00, p<0,001) [25].
Недостаточность витамина D (25(OH)D <20 нг/мл) ассоциирована с более тяжелым состоянием пациентов, госпитализированных с инфекцией нижних дыхательных путей и респираторно-синцитиальным вирусом. Дефицит витамина D установлен у 50% обследованных и был ассоциирован с 3-кратным риском поступления пациента в отделение реанимации и интенсивной терапии (ОШ 3,29, 95% ДИ 1,20–9,02, р=0,018) и с 11-кратным риском перевода пациента на ИВЛ (ОШ 11,20, 95% ДИ 2,27–55,25, р<0,001) [26].
Витамин D способствует снижению повреждений эпителия легких, вызываемых цитокинами типа «алармин», выброс которых происходит при аллергических реакциях и во время приступов БА. Цитокины-алармины ИЛ-25, ИЛ-33 и др., избыточно секретируемые во время приступа, непосредственно стимулируют тучные клетки и лимфоидные клетки 2-го типа (ILC2-клетки). Затем ILC2-клетки секретируют ИЛ-5 и другие цитокины, которые способствуют развитию эозинофильного аллергического воспаления [24].
В клиническом исследовании (n=669) было показано, что недостаточность витамина D ассоциирована с повышением количества эозинофилов в крови. Достоверные различия по данному показателю были установлены между подгруппой участников с тяжелым дефицитом витамина D (25(OH)D <10 нг/мл) при сравнении со всеми остальными подгруппами пациентов (уровни 25(OH)D 10–20 нг/мл, 20–30 нг/мл, ≥30 нг/мл) [27].
Эксперименты на культуре клеток эпителия легких человека показали, что витамин D подавляет избыточную воспалительную реакцию в ответ на вирус гриппа A (H1N1) [28] и снижает активацию NF-κB-связанных провоспалительных цитокинов при инфицировании респираторно-синцитиальным вирусом [29].
Заметим, что исходное состояние ткани легких также зависит от курения. У пациентов с длительным стажем курения уже имеются фибротические изменения легких, вкрапления сажи и других продуктов термического разложения табака. Соответственно, эти пациенты составляют группу риска тяжелого течения COVID-19. Результаты систематического анализа 10 клинико-эпидемиологических исследований (n=76 993) свидетельствуют о том, что курение у обследованных является столь же важным фактором риска инфицирования SARS-CoV-2, как и АГ (10,2–23,7%), ИБС (4,4–22,8%) и СД (6,6–9,3%) [30]. Метаанализ 11 клинических исследований (n=2002) показал, что риск тяжелого течения COVID-19 возрастает в 2 раза у курильщиков и в 4,4 раза — у пациентов с ХОБЛ (как правило, курильщики с большим стажем) [31].
Метаанализ 9 когортных исследований европейцев (n=22 838) показал, что при повышении концентрации 25(OH)D в крови на каждый 1 нмоль/л объем форсированного выдоха в 1 секунду (forced expiratory volume in one second, FEV1) увеличивался на 1,1 мл (95% ДИ от 0,9 до 1,3, p<0,0001). Данная ассоциация была еще более выражена у курильщиков: объем FEV1 увеличивался на 1,7 мл (95% ДИ 1,1–2,3) на каждый 1 нмоль/л 25(OH)D. Таким образом, компенсация недостаточности витамина D является особенно важным резервом реабилитации для курильщиков [32].
Хронические патологии и дефицит витамина D
Широчайший круг биологических функций генов/белков, регулируемых витамином D (рис. 2), обусловливает профилактические и лечебные роли не только при вирусных инфекциях, но и при заболеваниях, отягощающих течение COVID-19. Сложнейший комплекс взаимосвязей между низкой обеспеченностью витамином D и многочисленными коморбидными заболеваниями детально описан в отдельной монографии «Витамин D — смена парадигмы» [9].
В отличие от ранее известных коронавирусов, вызывающих атипичную пневмонию (SARS-CoV, MERS-CoV), SARS-CoV-2 характеризуется более высокой контагиозностью и большей скоростью распространения в популяциях [33]. Очень важно заметить, что течение COVID-19 зачастую связано не только с очевидными нарушениями дыхательной системы, но и с дисфункцией других систем органов. Инфекция COVID-19 ассоциирована с повышением уровней маркеров дисфункции печени (АСТ, АЛТ, альбумина, билирубина) [34], которые также ассоциированы с более тяжелым течением пневмонии и с наличием симптоматики со стороны желудочно-кишечного тракта [35].
Пациенты с COVID-19 характеризуются выраженными нарушениями коагуляционного профиля крови. Прокоагулянтные нарушения профиля свертываемости крови (повышение уровней D-димера, продуктов деградации фибрина) ассоциированы с более высоким риском смертности от COVID-19 [36]. Более высокие уровни плазмина соответствуют усилению фибринолиза и повышению уровней D-димера при тяжелом течении COVID-19. Заметим, что повышенные уровни плазмина и плазминогена являются биомаркерами повышенной восприимчивости к SARS-CoV-2, т. к. протеаза плазмина может «разрезать» соответствующий сайт S-белка SARS-CoV-2, что повышает вирулентность [37]. Хорошо известно, что витамин D способствует нормализации профиля коагуляции крови [9].
Важно понимать, что наличие у пациента хронических коморбидных патологий является патофизиологическим объяснением более тяжелого течения COVID-19 у пожилых пациентов. Например, в многоцентровом китайском исследовании (n=280) доля пациентов старше 65 лет достоверно выше среди больных с тяжелым течением (59%), чем среди пациентов с легким течением инфекции (10,2%, p<0,05). При этом 85,5% пациентов с тяжелым течением COVID-19 также имели СД или сердечно-сосудистые заболевания, которые встречались в 7–10 раз чаще (p=0,042), чем у пациентов с легкой формой COVID-19 [38].
Метаанализ 8 клинических исследований пациентов с COVID-19 (n=46 248) подтвердил, что наиболее распространенными коморбидными состояниями были АГ (17%), СД 2 типа (8%), ИБС (5%), заболевания легких и/или бронхов. Коморбидные состояния соответствовали увеличению риска тяжелого течения инфекции COVID-19: АГ — в 2,4 раза (95% ДИ от 1,5 до 3,8), респираторные — в 2,5 раза (95% ДИ от 1,8 до 3,4), ИБС — в 3,4 раза (95% ДИ от 1,88 до 6,22) [39].
Факторы риска смертности от COVID-19 включают наличие АГ, СД 2 типа, ИБС, цереброваскулярных патологий [40]. Среди пациентов с COVID-19 на фоне СД 2 типа чаще развиваются критические состояния [41]. Все перечисленные патологии (СД 2 типа, АГ, ИБС, ХОБЛ, БА) ассоциированы с недостаточностью витамина D [9].
Заключение
Для профилактики инфицирования и снижения риска тяжелого течения инфекции принципиально необходимо поддержать врожденный противовирусный иммунитет во всех возрастных группах, снизить риск «цитокинового шторма» и компенсировать коморбидные патологии, которые утяжеляют течение коронавирусной инфекции. Устранение недостаточности витамина D принципиально важно для достижения этих трех целей. Витамин D способствует повышению экспрессии генов IFIT1, IFIT3, IRF1, IRF3, ISG15, ISG20, MX1, MX2, OAS1, OAS2 и других генов, кодирующих белки интерферон-зависимой защиты от РНК-вирусов. Витамин D препятствует избыточной активации фактора NF-κB толл-рецептором TLR3, что устраняет одну из важных предпосылок для формирования «цитокинового шторма». Даже переход от тяжелого дефицита витамина D (25(OH)D <20 нг/мл) к умеренному дефициту (25(OH)D в диапазоне 20–30 нг/мл) в 3 раза снижает риск поступления пациента с пневмонией в реанимацию и в 11 раз — риск перевода на ИВЛ [26].
Рекомендованы дотации витаминов А, С, D, E, витаминов группы В, цинка, селена, железа и омега-3-ПНЖК в качестве нутрициальной поддержки в период пандемии COVID-19 [40–42]. Оценка нутрициального статуса пациентов с диагнозом COVID-19 может существенно повысить безопасность применения тех или иных подходов к фармакотерапии вирусных инфекций. С учетом того, что многие противовирусные препараты характеризуются высокой токсичностью, дотации определенных витаминов и микроэлементов способствуют снижению побочных эффектов от использования этих препаратов.
При респираторно-вирусной инфекции (грипп, COVID-19, RSV-инфекция) рекомендуется принимать профилактические дозы витамина D3 (1000–2000 МЕ/сут). Дозировки холекальциферола в диапазоне 2000–4000 МЕ/сут дают более выраженное повышение 25(ОН)D3 в крови пациента и не приводят к отклонениям уровней кальция или паратиреоидного гормона от нормальных значений [43]. Лечебные дозы витамина D3 составляют 4000–8000 МЕ/сут и назначаются врачом индивидуально, с контролем концентраций 25(OH)D3 в крови в динамике лечения.
Эффективным способом поддержания уровня витамина D у населения разных стран является обогащение витамином D пищевых продуктов массового потребления, а также прием витамина D в форме биологически активных добавок к пище.
Работа выполнена при поддержке гранта РФФИ 20–07–00537.
.
Информация с rmj.ru

