Введение
Частота регистрации неалкогольной жировой болезни печени (НАЖБП) в последнее десятилетие в Российской Федерации заметно возросла. По результатам отечественных многоцентровых наблюдательных эпидемиологических исследований DIREG_L_0193 [1] и DIREG 2 [2], проведенных в 2007 г. и 2014 г. соответственно, выявление НАЖБП возросло с 26,1% до 33,3%. Данная тенденция может быть обусловлена не только улучшением диагностики заболевания. Длительное время ведущая роль в патогенезе НАЖБП отводилась универсальному патофизиологическому синдрому инсулинорезистентности (ИР) и гиперинсулинемии, которые могли формироваться уже на самых начальных стадиях НАЖБП. Это положение сохраняется и на данный момент [3]. Однако в современной медицине возрастает роль применения молекулярно-генетических и специальных методов исследования, что позволяет с большей точностью диагностировать и прогнозировать течение заболеваний внутренних органов, в том числе хронических заболеваний печени и НАЖБП, прогнозировать риск возникновения осложнений и неблагоприятного исхода [4–6]. В этом плане активно изучается роль различных генов-кандидатов, полиморфизм которых может играть существенную роль в формировании и прогрессировании НАЖБП, в частности, обсуждается связь с носительством G-аллели полиморфного гена rs666089 ADIPOR1, а также полиморфизм гена PNPLA3/148M [5, 7]. Именно генно-молекулярной проблеме и посвящена наша статья.
Цель нашего исследования: оценить вероятность неблагоприятных исходов у больных НАЖБП с учетом клинических, биохимических и молекулярно-генетических параметров.
Материал и методы
Обследовано 115 больных (84 мужчины и 31 женщина) в возрасте от 23 до 69 лет (средний возраст 49,3±1,1 года) с верифицированной НАЖБП. Диагноз НАЖБП был подтвержден в ходе комплексного обследования согласно клиническим рекомендациям по диагностике и лечению НАЖБП Российского общества по изучению печени и Российской гастроэнтерологической ассоциации [8]. Для подтверждения стеатоза печени у пациентов с НАЖБП рассчитывали индекс HIS (Hepatic steatosis index) по формуле: HIS = 8 × (аланинаминотрансфераза (АлАТ) / аспарта-таминотрансфераза (АсАТ)) + индекс массы тела (ИМТ) + 2 (если женщины) + 2 (если имеется сахарный диабет (СД)).
Пороговое значение индекса HIS более 36,0 свидетельствует в пользу стеатоза печени у пациентов с чувствительностью 93,1% и специфичностью 92,4% [9]. Коэффициент HIS превышал контрольные значения в основной группе, составляя 41,4±1,3, что подтверждало наличие стеатоза печени. Исключены гепатотропная вирусная инфекция и хроническая алкогольная зависимость [10].
Группу сравнения (популяционную) составили 325 чело-век (153 женщины и 172 мужчины) в возрасте от 25 до 67 лет (средний возраст 47,9±0,6 года). Группа сформирована на основе случайной выборки постоянных жителей г. Новосибирска (подобрана по возрасту в соотношении 1:3 — 1 случай на 3 контроля), которые были обследованы в рамках программ MONIСA [11] и HAPIEE [12] — международных эпидемиологических программ ВОЗ по изучению заболеваемости и смертности от сердечно-сосудистых заболеваний и нарушений липидного обмена в разных регионах и в разных популяциях.
Всем участникам исследования было проведено комплексное молекулярно-генетическое обследование в лаборатории молекулярно-генетических исследований терапевтических заболеваний НИИТПМ — филиала ИЦиГ СО РАН. В ходе обследования было проведено генотипирование на наличие и/или отсутствие мутаций Glu342Lys (PIZ) и Glu264Val (PIS) гена α1-антитрипсина (SERPINA1), мутаций аллелей C282Y и H63D гена гемохроматоза (HFE), гена TCF7L2.
Всем пациентам основной группы проводили комплексное обследование: оценивали стандартные показатели функции печени и липидного обмена, определяли показатели цитокинового спектра: интерлейкины (ИЛ): ИЛ-1β, -6, -8, -10, -1Ra, фактор некроза опухоли α (ФНО-α). Их активность отмечают при вирусных гепатитах, циррозе печени, аутоиммунном гепатите, алкогольной болезни печени, гепатоцеллюлярной карциноме и других заболеваниях органов пищеварения [13–15]. Все вышеперечисленные показатели определяли стандартными иммуноферментными наборами реагентов («Вектор», Россия). Исследования проводили в лаборатории цитокинов АО «Вектор-Бест».
Методом хроматографии-спектрофотометрии с помощью тест-набора Biosystems (Испания) определяли предшественники порфиринов: δ-аминолевулиновую кислоту, порфобилиноген; фракции порфиринов: уропорфирин и копропорфирин. Исследование проводилось на базе лабораторного отделения ГБУЗ НСО «ГКБ № 1» г. Новосибирска.
Все обследованные пациенты наблюдались в течение 5 лет, у них регистрировали возникновение неблагоприятных явлений, к которым относили: летальный исход, острую сосудистую патологию (инфаркт миокарда, транзиторную ишемическую атаку, инсульт), формирование цирроза печени.
Результаты клинических и лабораторных исследований обрабатывали методом вариационной статистики. Сравнение уровня непрерывных показателей проводили после проверки нормальности их распределения по тесту Колмогорова — Смирнова. Если показатель отвечал критериям нормального распределения, то использовали однофакторный дисперсионный анализ. Если показатель не соответствовал критериям нормального распределения, то применяли тест Манна — Уитни для двух независимых выборок. Различия между средними величинами считали достоверными при р<0,05. Различия частотных характеристик качественных переменных оценивали с помощью критерия соответствия (метод c2) или коэффициента Пирсона. При установлении достоверности связей пользовались таблицей c2, считая результаты достоверными, если р<0,05 при соответствующих степенях свободы (n1). Ассоциация двух качественных показателей оценивалась при помощи четырехпольных таблиц сопряженности с подсчетом отношения шансов (ОШ) и доверительных интервалов (95% ДИ). Приводимые в работе ДИ строились для доверительной вероятности р=95%.
Результаты и обсуждение
В группе пациентов с НАЖБП мутантные аллели 342Lys (PIZ) и 264Val (PIS) гена SERPINA1 зарегистрированы у 22 (19,1%) человек, при этом несколько чаще регистрировалась мутация по аллели 264Val (PIS) (табл. 1). В группе сравнения (популяционной) мутантные аллели 342Lys (PIZ) и 264Vol (PIS) гена SERPINA1 были обнаружены только у 14 (4,3%) человек. Сравнительный анализ этих данных позволяет отметить существенное повышение частоты носительства мутантных аллелей 342Lys (PIZ) и 264Val (PIS) в группе больных НАЖБП. Вероятность обнаружения в группе НАЖБП носителя генотипа Glu342Lys (PIZ) выше в 3,9 раза (NZ + ZZ против NN: ОШ 3,90, 95% ДИ 1,5–10,5, р=0,007), генотипа Glu264Vol (PIS) — в 6,6 раза (NS против NN: ОШ 6,6, 95% ДИ 2,4–18,3, р<0,001), чем в популяционной группе.
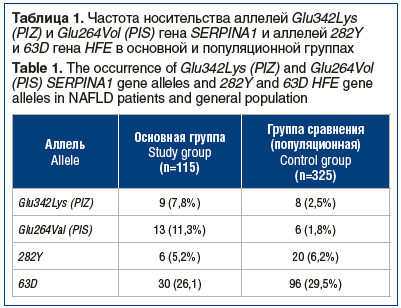
Иная картина наблюдалась при оценке частот мутантных аллелей 282Y и 63D гена HFE. Они были выявлены у 36 (31,3%) пациентов с НАЖБП. Значительно чаще обнаруживалась мутация по аллели 63D, выявленная у 30 (26,1%) больных. Мутация по аллели 282Y зарегистрирована только у 6 (5,2%) пациентов. В группе сравнения мутантные аллели были обнаружены у 115 (35,4%) человек. Заметно чаще (в 4,5 раза), как и в основной группе, регистрировалась мутация по аллели 63D. Достоверных различий по частоте регистрации мутаций по аллелям 282Y и 63D гена HFE между группами не обнаружено (χ2=0,63, р>0,5 при n´=3).
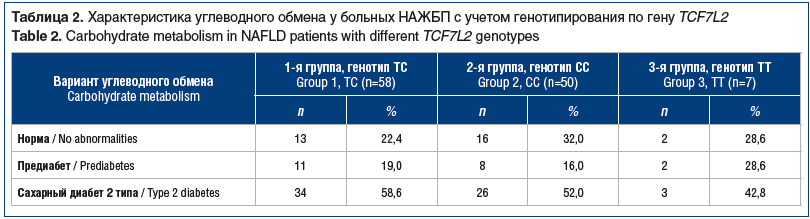
Сравнительная оценка состояния углеводного обмена была проведена у 115 пациентов с НАЖБП согласно клиническим рекомендациям «Алгоритмы специализированной медицинской помощи больным сахарным диабетом» [16] (табл. 2). По результатам молекулярно-генетического исследования по гену TCF7L2 и с учетом выявленного генотипа больные были разделены на 3 группы: 1-я — с генотипом ТС (58; 50,4%), 2-я — с генотипом СС (50; 43,5%), 3-я — с генотипом ТТ (7; 6,1%). Ген TCF7L2 считается наиболее значимым по участию в формировании нарушения функции β-клеток поджелудочной железы, возникновении расстройств углеводного обмена, манифестации СД [13, 17]. Патологические отклонения в углеводном обмене в группе пациентов с НАЖБП зарегистрированы у 84 (73,0%) человек, предиабет выявлен у 21 пациента. При этом несколько чаще он наблюдался на фоне генотипа ТС. Наиболее значимую группу составили пациенты с манифестной формой СД 2 типа с генотипами ТС и СС: 34 (58,6%) и 26 (52,0%) человек соответственно. В ходе обследования СД был впервые выявлен у 12 (10,4%) пациентов: у 7 с генотипом ТС и у 5 с генотипом СС.
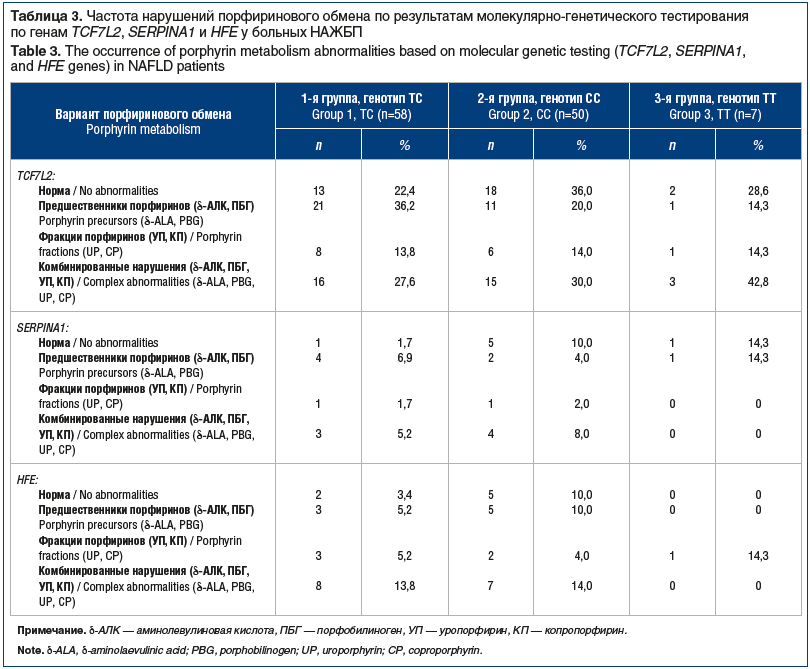
Нарушения порфиринового обмена выявлены у большинства больных (82; 71,3%) и заметно чаще наблюдались у пациентов с генотипом ТС гена TCF7L2 (45; 39,1%), но достоверных различий с генотипами СС и ТТ не обнаружено (χ2=0,57, р>0,5 при n´=4). При наличии мутаций по аллелям Glu324Lys (PIZ) и Glu246Vol (PIS) гена SERPINA1 и аллелям 282Y и 63D гена HFE дисметаболизм порфиринов регистрировался практически с одинаковой частотой: у 16 (72,7%) и у 29 (80,6%) пациентов (табл. 3).
Анализ показателей цитокинового спектра позволил установить, что независимо от генотипа гена TCF7L2 доминировала активность ИЛ-1β, -6 и -1Ra (табл. 4). При наличии мутации по аллелям Glu324Lys (PIZ) и Glu246Vol (PIS) гена SERPINA1 и аллелям 282Y и 63D гена HFE наблюдалась аналогичная динамика.
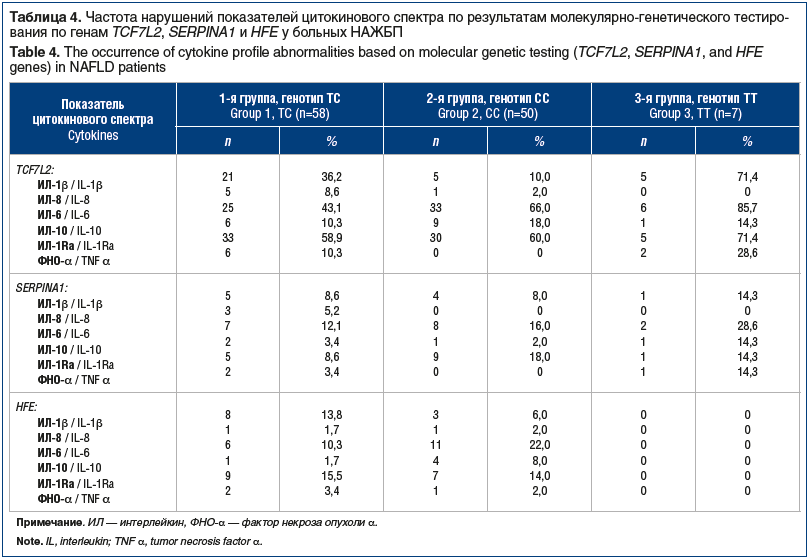
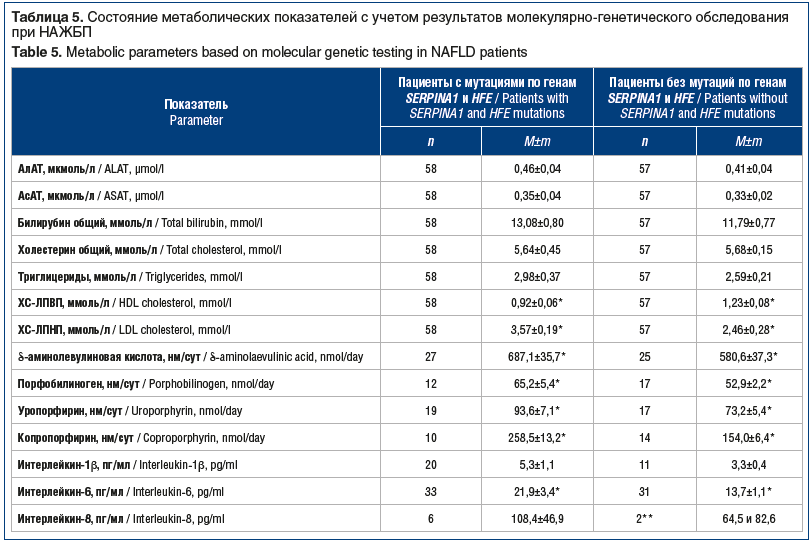
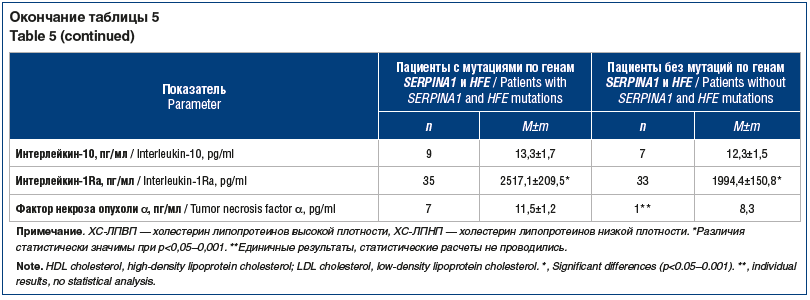
Показатели функции печени (АлАТ, АсАТ, общий билирубин) соответствовали нормативным значениям и при наличии и/или отсутствии мутаций по генам SERPINA1 и HFE не имели достоверных различий (табл. 5). Напротив, все показатели липидного спектра существенно превышали норму. При этом показатели холестерина липопротеинов высокой и низкой плотности при наличии мутаций по генам SERPINA1 и HFE были достоверно хуже. Наличие данных мутаций достоверно (р<0,02–0,05) способствовало ухудшению показателей порфиринового обмена — повышению активности ИЛ-6 и -1Ra.
Наши наблюдения с 2016 г. по 2020 г. позволили зарегистрировать неблагоприятные проявления НАЖБП у 30 (26,1%) пациентов. К ним относили летальный исход (17; 56,7% больных), острую сосудистую патологию (инфаркт миокарда, ишемический инсульт, транзиторная ишемическая атака) (8; 26,7%), формирование цирроза печени (5; 16,6%).
Заключение
Таким образом, проведенное нами исследование у больных НАЖБП позволяет констатировать ряд положений. Во-первых, у пациентов с НАЖБП молекулярно-генетическое исследование гена TCF7L2 показывает, что неблагоприятные исходы чаще регистрируются при генотипе СС (15; 50,0%), несколько реже — при генотипе ТС (13; 43,3%), заметно реже — при генотипе ТТ (2; 6,7%). Во-вторых, у 50% пациентов с неблагоприятными исходами зарегистрированы мутации по аллелям 282Y, 63D гена HFE и аллелям 342Lys (PIZ), 264Val (PIS) гена SERPINA1. В-третьих, анализ факторов риска неблагоприятных исходов НАЖБП позволяет отметить, что заметно чаще регистрируется активность показателей цитокинового спектра (ИЛ-1β, -6, -1Ra), которая зарегистрирована у 27 (90%) пациентов. Практически также часто обнаруживались нарушения порфиринового обмена (22; 73,3%), из клинических параметров наиболее значимым оказалось абдоминальное ожирение. В-четвертых, проведение молекулярно-генетических и специальных биохимических исследований позволяет прогнозировать вероятность неблагоприятного течения НАЖБП.
Сведения об авторах:
Кривошеев Александр Борисович — д.м.н., профессор кафедры факультетской терапии им. проф. Г.Д. Залесского ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-4845-8753.
Максимов Владимир Николаевич — д.м.н., профессор, заведующий лабораторией молекулярно-генетических исследований терапевтических заболеваний НИИТПМ — филиала ИЦиГ СО РАН; 630089, Россия, г. Новосибирск, ул. Бориса Богаткова, д. 175/1; профессор кафедры биологии и медицинской генетики ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-7165-4496.
Бойко Константин Юрьевич — врач-ординатор отделения эндокринологии ГБУЗ НСО «ГКБ № 1»; 630047, Россия, г. Новосибирск, ул. Залесского, д. 6; ORCID iD 0000-0003-3293-0061.
Левыкина Елена Евгеньевна — врач-ординатор отделения гастроэнтерологии ГБУЗ НСО «ГКБ № 1»; 630047, Россия, г. Новосибирск, ул. Залесского, д. 6; ORCID iD 0000-0002-2029-0557.
Михайлова Елена Семеновна — научный сотрудник центральной научно-исследовательской лаборатории ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; научный сотрудник ФИЦ ФТМ; 630117, Россия, г. Новосибирск, ул. Тимакова, д. 2; ORCID iD 0000-0001-8576-3717.
Вараксин Николай Анатольевич — заведующий лабораторией цитокинов АО «Вектор-Бест»; 630559, Россия, г. Новосибирск, районный поселок Кольцово, научно-производственная зона, корп. 36, ком. 211; ORCID iD 0000-0002-0733-7787.
Кондратова Мария Александровна — к.м.н., ассистент кафедры факультетской терапии им. проф. Г.Д. Залесского ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-7971-6479.
Кривошеева Инга Анатольевна — к.м.н., ассистент кафедры профболезней с курсом эндокринологии ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; заведующая отделением эндокринологии ГБУЗ НСО «ГКБ № 1»; 630047, Россия, г. Новосибирск, ул. Залесского, д. 6; ORCID iD 0000-0002-3575-4983.
Аутеншлюс Александр Исаевич — д.б.н., заведующий центральной научно-исследовательской лабораторией ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; главный научный сотрудник ФИЦ ФТМ; 630117, Россия, г. Новосибирск, ул. Тимакова, д. 2; ORCID iD 0000-0002-6538-0089.
Контактная информация: Кривошеев Александр Борисович, e-mail: krivosheev-ab@narod.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.03.2022.
Поступила после рецензирования 19.04.2022.
Принята в печать 18.05.2022.
About the authors:
Aleksandr B. Krivosheev — Dr. Sc. (Med.), professor of the Prof. G.D. Zalesskiy Department of Faculty Therapy, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-4845-8753.
Vladimir N. Maksimov — Dr. Sc. (Med.), Professor, Head of the Laboratory of Molecular Genetic Testing of Therapeutic Diseases, Research Institute for Therapy and Preventive Medicine — Branch of the Federal Research Center Institute of Cytology and Genetics of the Siberian Branch of the RAS; 175/1, B. Bogatkov str., Novosibirsk, 630089, Russian Federation; professor of the Department of Biology and Medical Genetics, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-7165-4496.
Konstantin Yu. Boyko — resident of the Department of Endocrinology, City Clinical Hospital No. 1; 6 build. 4, Zalesskiy str., Novosibirsk, 630047, Russian Federation; ORCID iD 0000-0003-3293-0061.
Elena E. Levykina — resident of the Department of Gastroenterology, City Clinical Hospital No. 1; 6 build. 4, Zalesskiy str., Novosibirsk, 630047, Russian Federation; ORCID iD 0000-0002-2029-0557.
Elena S. Mikhailova — researcher of the Central Research Laboratory, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; researcher, Federal Research Center for Fundamental and Translational Medicine; 2, Timakov str., Novosibirsk, 630060, Russian Federation; ORCID iD 0000-0001-8576-3717.
Nikolay A. Varaksin — Head of the Laboratory of Cytokines, JSC «Vektor-Best»; build. 36, working settlement Koltsovo, Research and Production Zone, Novosibirsk, 630559, Russian Federation; ORCID iD 0000-0002-0733-7787.
Maria A. Kondratova — C. Sc. (Med.), assistant of the Prof. G.D. Zalesskiy Department of Faculty Therapy, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-7971-6479.
Inga A. Krivosheeva — C. Sc. (Med.), assistant of the Department of Occupational Diseases with the Course of Endocrinology, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; Head of the Department of Endocrinology, City Clinical Hospital No. 1; 6 build. 4, Zalesskiy str., Novosibirsk, 630047, Russian Federation; ORCID iD 0000-0002-3575-4983.
Aleksandr I. Autenshlyus — Dr. Sc. (Biol.), Head of the Central Research Laboratory, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; leading researcher, Federal Research Center for Fundamental and Translational Medicine; 2, Timakov str., Novosibirsk, 630060, Russian Federation; ORCID iD 0000-0002-6538-0089.
Contact information: Aleksandr B. Krivosheev, e-mail: krivosheev-ab@narod.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 27.03.2022.
Revised 19.04.2022.
Accepted 18.05.2022.
.
Информация с rmj.ru






