Введение
Маргинальная эритема (erythema marginatum, erythema Lehndorf — Leiner) (МЭ) — характерная кольцевидная кратковременно существующая эритема, являющаяся одним из проявлений острой ревматической лихорадки и, реже, пситтакоза, или дефицита С1-ингибитора (код по МКБ-10: L53.1) [1]. МЭ может быть самостоятельным проявлением заболевания или являться предвестником наследственного ангиоотека (НАО). НАО — это аутосомно-доминантное заболевание, характеризующееся повторными эпизодами отека кожи и/или слизистых оболочек, длящимися от 2 до 5 дней, вовлекающими преимущественно конечности, лицо, дыхательные пути и желудочно-кишечный тракт [2]. НАО относят к первичным иммунодефицитам без инфекционного синдрома (код по МКБ-10: D84.1) [3]. Это редкое наследственное заболевание, вызываемое мутациями в гене SERPING1, которое опосредуется дефицитом (I тип НАО, 80% случаев) или дисфункцией (II тип НАО, 15% случаев) С1-ингибитора эстеразы, ведущими к гиперпродукции брадикинина. Существуют случаи с нормальным уровнем С1-ингибитора (около 5% случаев НАО, ранее описываемые как III тип НАО): НАО с мутацией в гене XII фактора (HAE-FXII), наследуется по аутосомно-доминантному типу с низкой пенетрантностью, составляет 30% среди пациентов с НАО с нормальным уровнем С1-ингибитора. Симптомы заболевания возникают только у 10% мужчин, имеющих мутации в гене, и у 60% женщин [4]. У женщин проявления характеризуются кожными симптомами (преимущественно на лице), отеком языка, часто обострения провоцируются приемом контрацептивов, гормональной перестройкой во время беременности и родов, подтверждая важную роль эстрогенов в развитии заболевания. В противоположность НАО с дефицитом С1-ингибитора, клинические симптомы дебютируют во взрослом возрасте. Мужчины подвержены HAE-FXII реже, за исключением присутствия кофакторов, таких как прием ингибиторов АПФ. Как и в случае с НАО с дефицитом С1-ингибитора, активация контактной системы и гиперпродукция брадикинина вовлечены в патофизиологию НАО с мутацией в факторе Хагемана. НАО с мутацией в гене ангиопоэтина 1 (HAE-ANGPT1). Ангиопоэтин 1 регулирует сосудистую проницаемость, защищая сосуды от пропотевания плазмы, вызываемого брадикинином. Мутация в гене ангиопоэтина 1 ассоциирована с увеличением проницаемости сосудов и ангиоотеком [5]. НАО с мутацией в гене плазминогена (HAE-PLG) является аутосомно-доминантным заболеванием, характеризуется высокой частотой отека языка, что ведет к асфиксии. Отек при этом типе НАО также опосредован брадикинином, но гиперпродукция брадикинина вызвана активацией фибринолитической системы [6]. НАО с неизвестной мутацией (UNK-HAE) — функциональные мутации гена пока не установлены.
Диагноз НАО с нормальным уровнем С1-ингибитора устанавливается при нормальном значении С1-ингибитора и его функциональной активности в случае типичной клинической картины в сочетании с положительным семейным анамнезом.
Безусловно, ангиоотек является главным симптомом НАО, но он может ассоциироваться с другими проявлениями, такими как абдоминальные атаки и продромальные симптомы: беспокойство, усталость, раздражение, МЭ и др. Среди предвестников НАО главный специфический признак — МЭ. Она впервые была описана E. Dinckelecker в 1882 г. [7]. МЭ представляет собой ретикулярную или кольцеобразную незудящую эритему, преимущественно локализующуюся на верхней половине туловища, которая может предшествовать или сопутствовать ангиоотеку, но может появляться самостоятельно [8]. Этот тип сыпи также может быть ассоциирован с ревматическими заболеваниями [9]. МЭ отличается от крапивницы, которая, как правило, сопровождается зудом, носит преходящий распространенный характер, состоит из уртикарных волдырей, возвышающихся над кожей. Точный механизм МЭ неизвестен, однако предполагается, что он опосредован брадикинином, что подтверждалось обнаружением гранул брадикинина в кожных биоптатах [10]. Традиционная антиаллергическая терапия (антигистаминные препараты, глюкокортикоиды, эпинефрин) неэффективна при МЭ, сочетанной с НАО. Имеются единичные сообщения об успешном лечении МЭ антагонистом В2-брадикининовых рецепторов икатибантом [11].
Представляем клиническое наблюдение пациентки с НАО и редким продромальным симптомом, МЭ, у которой постановка правильного диагноза была отсрочена на 6 лет.
Клиническое наблюдение
Пациентка, 34 года, наблюдается нами с 2018 г. Жалобы: отеки верхних и нижних конечностей, возникающие без видимой причины; появление на коже в разных частях тела кольцевидных высыпаний без волдырей; периодически острые боли в животе.
Анамнез болезни. Страдает ангиоотеками с 26 лет (с 2012 г.). В I триместре беременности, закончившейся замершим плодом, впервые возникли отеки мягких тканей верхних и нижних конечностей (рис. 1). Характер отеков — плотные, медленно проходящие (в течение 2–5 сут), не сопровождаются покраснением и зудом, а вызывают чувство распирания и боли, резистентные к глюкокортикоидам и антигистаминным препаратам. Первоначально отеки возникали 2–3 раза в год. Ставили диагноз «Аллергия неясной этиологии». Ухудшение состояния с 32 лет (июнь 2018 г.), после назначения гинекологом пероральных контрацептивов, когда отеки стали возникать без видимой причины еженедельно, проходили самостоятельно в течение 2–5 сут, антигистаминные препараты были неэффективны, незначительный положительный эффект от глюкокортикоидов.
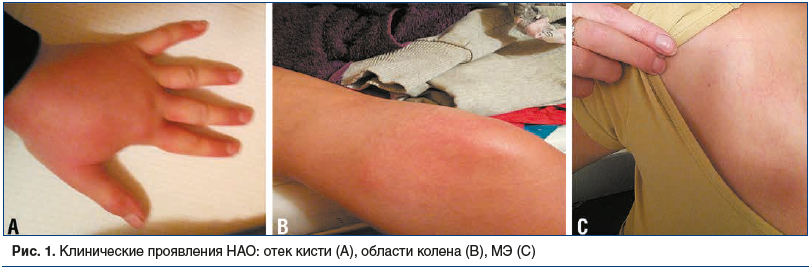
С 2018 г. на фоне регулярного применения контрацептивов стала отмечать появление не зудящих, без возвышений над кожей, кольцевидных высыпаний («разводов», по словам пациентки), которые возникали спонтанно или предшествовали развитию отеков (см. рис. 1). Обращалась к нескольким дерматологам, которые расценивали состояние как крапивницу либо как аллергический дерматит. Проводимая терапия антигистаминными препаратами и глюкокортикоидами была малоэффективной. В 2018 г. перенесла 3 эпизода интенсивных абдоминальных болей, сопровождаемых рвотой. С последним приступом была госпитализирована в хирургическое отделение стационара, но была впоследствии выписана, так как при тщательном обследовании (анализ крови, УЗИ брюшной полости, гастроскопия) данных за острый живот не получено, симптомы регрессировали самостоятельно. Была рекомендована консультация аллерголога.
Семейный анамнез: мама пациентки страдает подобными отеками с молодости. Попытки обращения к врачам не принесли желаемого эффекта. Далее к врачам не обращалась, дожидалась самостоятельного разрешения отеков.
Результаты обследования: общий IgЕ 19 МЕ/мл (норма <100 МЕ/мл), С3 компонент комплемента 1,08 г/л (норма 0,83–1,93 г/л), С4 компонент комплемента 0,08 г/л (норма 0,15–0,57 г/л), активность С1-ингибитора комплемента 28,43% (норма 70–130%), концентрация С1-ингибитора комплемента 5,4 мг/дл (норма 23–41 мг/дл).
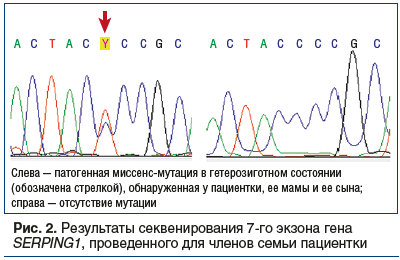
Генетическое исследование. У пациентки, ее мамы и ее сына обнаружена миссенс-мутация в 7-м экзоне гена SERPING1 (С1NH) (рис. 2). Нуклеотидная замена g. 15379C>T является патогенной и приводит к замене аминокислоты пролин на лейцин в 399-м положении (Pro399Leu) в последовательности белка согласно ресурсу HAEdb (http://hae.enzim.hu/). Все три члена семьи являются гетерозиготными носителями данного полиморфизма. Видно, что патогенный вариант присутствует в гетерозиготном состоянии. Справа приведена та же последовательность, полученная в результате секвенирования генетического материала мужа пациентки. Из рисунка видно, что у мужа данный полиморфизм отсутствует.
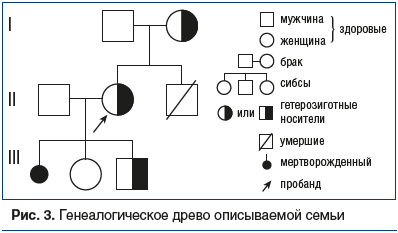
На рисунке 3 изображено генеалогическое древо данной семьи, где стрелкой отмечен пробанд (мама пациентки), а закрашенные наполовину фигуры соответствуют носителям мутации в гетерозиготном состоянии.
Диагноз: D 84.1 Наследственный ангиоотек I типа (первичный иммунодефицит).
С начала заболевания прошло 6 лет, прежде чем был поставлен корректный диагноз.
Динамическое наблюдение. Даны рекомендации по отказу от приема оральных контрацептивов. Пациентка была внесена в Регистр пациентов с первичными иммунодефицитными состояниями [12]. В феврале 2019 г. с целью купирования острого ангиоотека в стационаре вводился плазменный С1-ингибитор в дозе 1000 мг внутривенно капельно, с последовавшим регрессом ангиоотека в течение 3 ч. С учетом отдаленного проживания пациентки в области с целью долговременной профилактики был рекомендован прием транексамовой кислоты по 1 г 3 р/сут (от приема препарата пациентка воздержалась). В 2019 г. ангиоотек возникал 5 раз (дважды отек рук и трижды отек живота). Отекам предшествовала МЭ. В 2020 г.: в январе — отек живота и спины, прошел самостоятельно; в феврале — массивный отек рук, ног и живота. Для купирования эпизода самостоятельно использовала икатибант в дозе 30 мг подкожно, отек был купирован в течение 3 ч. Отмечала местную реакцию в виде выраженной болезненности в месте инъекции. В мае 2020 г. возникла распространенная МЭ и появились боли внизу живота. Был самостоятельно введен икатибант 30 мг подкожно. Через 30 мин МЭ регрессировала. Введение было менее болезненным, ангиоотека не последовало.
Обсуждение
У пациентки представлены все диагностические критерии, позволяющие сформулировать диагноз НАО I типа:
большие клинические критерии: наличие рецидивирующих невоспалительных отеков, без крапивницы, сохраняющихся более 12 ч, разрешающаяся самостоятельно абдоминальная боль и/или рецидивирующие отеки гортани;
малые критерии: наличие у кровных родственников (матери пробанда), рецидивирующих отеков или абдоминальных болей и/или отеков гортани;
лабораторные критерии: низкие уровни С4 компонента комплемента, С1-ингибитора (количественное снижение и нарушение функции), мутация в гене SERPING1.
Особенностью наблюдения является эстроген-зависимый характер отеков (дебют во время беременности, прием пероральных контрацептивов) и наличие МЭ. Вероятно, трудности в дифференциальной диагностике кожного синдрома, неосведомленность практикующих врачей в отношении клинических проявлений МЭ отсрочили правильную постановку диагноза. Этот факт подтверждают зарубежные исследователи: в Дании в случае сочетания НАО и МЭ диагноз запаздывает на 2 года [13].
Лечение НАО направлено на предотвращение фатального исхода и улучшение качества жизни. Методы терапии ориентированы на купирование острых симптомов и предотвращение развития атак, предусматривая долгосрочную и краткосрочную профилактику [14]. В представленном клиническом наблюдении назначение аттенуированных андрогенов молодой женщине неприемлемо, а от приема антифибринолитиков или самостоятельной внутривенной инфузии С1-ингибитора пациентка отказалась. Введение антагониста В2-рецепторов брадикинина (икатибанта) способствовало быстрому разрешению МЭ.
Заключение
Трудности в дифференциальной диагностике ангиоотеков и МЭ, как правило, не позволяют правильно и своевременно поставить диагноз. В нашем наблюдении отсрочка правильного диагноза составила 6 лет. По данным зарубежных авторов, в датской популяции правильный диагноз ставился спустя 2–11 лет от дебюта [13]. Для постановки правильного диагноза необходимо тщательно собирать анамнез, в том числе аллергологический и фармакологический, проводить детальный клинический осмотр, использовать все возможности лабораторной диагностики и генетических исследований.
Практикующие врачи должны быть осведомлены обо всех клинических проявлениях НАО, включая продромальные симптомы, такие как МЭ, а также о возможностях современной диагностики и эффективной терапии.
Информация с rmj.ru

