Коррекция системной эндотоксинемии у детей с атопическим дерматитом
Б. А. Шамов, доктор медицинских наук, профессор
Т. Г. Маланичева, доктор медицинских наук, профессор
КГМУ, Казань
Эндотоксин — биологически активное соединение, составной частью которого является липополисахарид, состоящий из липида А, ядра и О-антигена. Эндотоксин выделяется грамотрицательными бактериями в кишечнике человека, откуда он проникает в портальную кровь и приводит к антигенной стимуляции макроорганизма. В физиологических условиях основная масса эндотоксина выводится из кишечника с каловыми массами, а из портальной крови купферовскими клетками печени.
Системная эндотоксинемия развивается при попадании эндотоксина в системный кровоток человека в результате как жизнедеятельности кишечной микрофлоры, нарушения проницаемости слизистой тонкого кишечника (даже в условиях сохраненной функции купферовских клеток печени), так и при недостаточности функции поджелудочной железы, желчевыводящих путей, депрессии барьерной функции печени, снижения скорости портального кровотока и др. [1].
Присутствие в крови эндотоксина влияет на иммунокомпетентные клетки и является одним их факторов стимуляции иммунной системы. Системная эндотоксинемия поддерживает в тонусе не только иммунную систему, но и другие системы организма человека. В физиологических условиях в ответ на присутствие эндотоксина вырабатываются антиэндотоксиновые антитела. При патологической эндотоксинемии у детей отмечается снижение антиэндотоксиновых антител, что отражает снижение адаптационных возможностей и резистентности организма [2-4]. Также установлено, что при этом развивается клеточная гипоксия, нарушаются метаболические процессы, активизируется симпатическая нервная деятельность, система комплемента, приводящая к лизису лейкоцитов и агрегации тромбоцитов с выходом биологически активных веществ (кинины, гистамин, серотонин), что вызывает «медиаторный хаос».
Эндотоксиновая агрессия развивается при массивном поступлении эндотоксина на фоне недостаточной активности элиминирующих систем и зависит от резервных возможностей иммунокомпетентных органов. Регулярное поступление в кровоток избытка эндотоксина приводит к мобилизации резервных возможностей адаптационных систем (десинхронизации биологических ритмов клеток, их составляющих) и может быть причиной транзиторной полиорганной недостаточности независимо от возраста. Эндотоксиновая агрессия квалифицируется как универсальный механизм, участвующий в патогенезе большинства заболеваний инфекционного и неинфекционного генеза. Роль эндотоксиновой агрессии в развитии различной патологии зависит от предрасположенности к заболеванию и индивидуальных свойств инфекционного агента [5].
Все вышеизложенное позволило нам предположить возможное наличие системной эндотоксинемии и эндотоксиновой агрессии при атопическом дерматите у детей.
Цель исследования — определить показатели плазменного эндотоксина и его взаимосвязи с показателями иммунного статуса у детей с атопическим дерматитом для совершенствования методов терапии.
Под наблюдением находилось 30 детей с атопическим дерматитом в возрасте от 10 до 17 лет, которые составили основную группу, из них мальчики — 43% (13 человек), девочки — 57% (17), дети в возрасте от 10 до 12 лет — 50% (15), от 13 до 17 лет — 50% (15). Детей с эритематозно-сквамозной формой с лихенификацией было 40% (12), с лихеноидной формой атопического дерматита — 60% (18). Активность кожного процесса II степени была у 40% (12), активность III степени — у 60% детей (18).
Среднетяжелое течение заболевания отмечалось у 67% (20), тяжелое — у 33% (10) больных. У 67% пациентов (20 человек) отмечалось повышение общего IgE в сыворотке крови. Причем у 50% пациентов (15 детей) имело место многократное повышение общего IgE, а у 16% — незначительное. Среди детей с повышенным уровнем общего IgE в сыворотке крови (20) его значения до 300 МЕ установлены у 15% (3), более 500 МЕ — у 85% (17) больных детей. Специфические IgE к пищевым аллергенам выявлены у 60% (18), бытовым — у 13% (4), пыльцевым — у 16% детей (5). У 70% (21) больных отмечалась сенсибилизация ко всем трем группам аллергенов.
Контрольную группу составили 20 практически здоровых детей. Из них мальчиков — 40% (8), девочек — 60% (12), детей в возрасте от 10 до 12 лет — 50% (10), от 13 до 17 лет — 50% (10).
Эндотоксин определялся по методу Levin J., Bang F. B. LAL-тестом (Limulus Amebocyte Lysate), согласно инструкции фирмы-производителя. Результаты выражались в международных единицах (МЕ).
Анализ данных показал, что у детей, обследованных в период обострения атопического дерматита, концентрация плазменного эндотоксина была 0,140 ± 0,071 МЕ, тогда как в контрольной группе — 0,0024 ± 0,001 МЕ (р < 0,001). В период ремиссии показатели плазменного эндотоксина уменьшились до 0,0178 ± 0,0138 МЕ (р < 0,05), при этом уровень эндотоксина превышал данные в контрольной группе (р < 0,001). Уровень плазменного эндотоксина у детей с атопическим дерматитом в зависимости от половой структуры и возраста представлен в таблице.
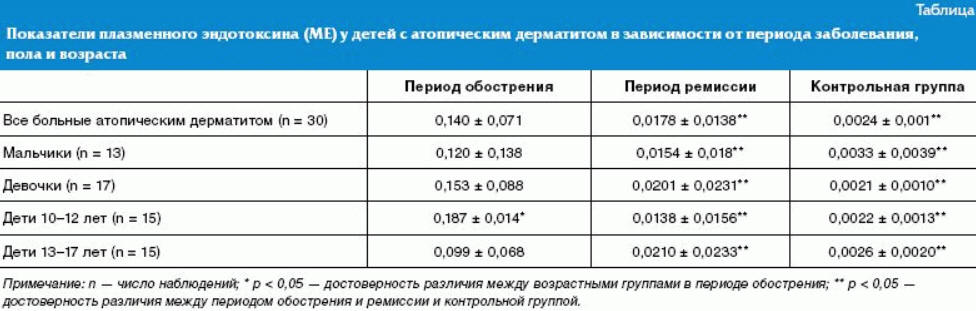
При тяжелом течении атопического дерматита показатели эндотоксина составили 0,168 ± 0,079 МЕ и значительно превышали показатели при среднетяжелом течении — 0,076 ± 0,023 МЕ (р < 0,05). У детей с эритематозно-сквамозной формой с лихенификацией и лихеноидной формой атопического дерматита показатели эндотоксина почти не отличались и составили 0,123 ± 0,118 МЕ и 0,124 ± 0,077 МЕ соответственно. У детей со II степенью активности кожного процесса концентрация эндотоксина была достоверно выше (0,143 ± 0,092 МЕ), чем при III степени (0,112 ± 0,061 МЕ), р < 0,05.
Таким образом, при обострении атопического дерматита содержание плазменного эндотоксина превышало контрольные показатели почти в 60 раз (р < 0,001), снизившись в 8 раз в период ремиссии (р < 0,05), однако его показатели не достигли значений контрольной группы (р < 0,001). Определяемое содержание эндотоксина у здоровых детей свидетельствует о наличии физиологической эндотоксинемии.
Наличие системной эндотоксинемии является показанием для проведения энтеросорбции [6] и включения в состав комплексной противоаллергической терапии атопического дерматита препаратов, оказывающих сорбционное, детоксикационное и цитопротекторное действие, а также благоприятно влияющее на микрофлору кишечника. Таким лекарственным средством с комплексным механизмом действия является препарат Энтеросгель — селективный сорбент нового поколения с высокой сорбционной способностью, обладающий цитопротекторным действием на слизистую оболочку желудочно-кишечного тракта, а также благоприятно влияющий на микрофлору толстого кишечника.
Для оценки эффективности энтеросорбции препаратом Энтеросгель пациенты были разделены на две группы. В основную группу вошли 16 детей с атопическим дерматитом, получающих с составе комплексной противоаллергической терапии препарат Энтеросгель в течение 2 недель в возрастной дозировке: дети до 5 лет — по 1 чайной ложке 3 раза в день (15 г), от 5 до 14 лет — по 1 десертной ложке 3 раза в день (30 г), старше 14 лет — по 1 столовой ложке 3 раза в день (60 г). В группу сравнения вошли 14 детей, получавших традиционную противоаллергическую терапию без препарата Энтеросгель. Традиционная терапия между сравниваемыми группами не различалась и включала в себя гипоаллергенную диету, антигистаминные препараты, наружную противовоспалительную терапию и лечебно-косметический уход за кожей.
Выявлено, что в основной группе детей общий терапевтический эффект составил 87,5% (14 детей). Из них у 62,5% пациентов (10 человек) отмечалось клиническое выздоровление. У 25% (4 человека) имело место значительное улучшение со стороны кожного процесса. Это проявилось выраженной динамикой со стороны кожного процесса, снижением индекса SCORAD более чем в 2,5 раза, а также снижением интенсивности зуда, восстановлением ночного сна. Отсутствие эффекта отмечалось у 12,5% больных (2 человека). На фоне проводимой терапии отмечалось сокращение периода обострения, а полное купирование морфологических элементов на коже и достижение клинической ремиссии заболевания наблюдалось в среднем на 12-й день от начала терапии. Индекс SCORAD снизился в среднем по группе в 5 раз — с 50 до 10 баллов.
Среди пациентов группы сравнения общий терапевтический эффект составил 64,3% (9 детей). Из них у 42,9% пациентов (6 человек) отмечалось клиническое выздоровление. У 21,4% (4 человека) имело место значительное улучшение со стороны кожного процесса. Отсутствие эффекта отмечалось у 35,7% больных (5 человек). На фоне проводимой терапии индекс SCORAD снизился в среднем в 3,3 раза — с 50 до 15 баллов. Достижение клинической ремиссии заболевания наблюдалось на 20-й день от начала терапии.
На фоне проводимой терапии отмечалось снижение уровня плазменного эндотоксина в основной группе в 12 раз — с 0,142 ЕU до 0,012 ЕU, тогда как в группе сравнения только в 6 раз — с 0,139 ЕU до 0,023 ЕU, р < 0,05.
Таким образом, у детей с атопическим дерматитом установлено наличие системной эндотоксинемии. Содержание плазменного эндотоксина в период обострения атопического дерматита превышает показатели в контрольной группе, снижается в период ремиссии, но не достигает показателей физиологической эндотоксинемии. Уровень плазменного эндотоксина зависит от тяжести и активности кожного процесса. Наличие синдрома системной эндотоксинемии является показанием для проведения энтеросорбции. Назначение препарата комплексного действия Энтеросгель в составе традиционной противоаллергической терапии приводит к сокращению периода обострения в 1,6 раза (с 20 до 12 дней), снижению индекса SCORAD в 5 раз на фоне снижения уровня плазменного эндотоксина.
Литература
- Yakovlev M. Elements of Endotoxin Theory of Human Physiology and Pathology: «Sistemic Endotoxinemia», «Endotoxin Agression» and «Endotoxin Insuficancy» // J. of Endotoxin Research. 2000; 2: 120.
- Аниховская И. А., Опарина О. Н., Яковлева М. М. и др. Кишечный эндотоксин как универсальный фактор адаптации и патогенеза общего адаптационного синдрома // Физиология человека. 2006; 2: 87-91.
- Вышегуров Я. Х., Аниховская И. А., Батманов Ю. Е. и др. Кишечный эндотоксин в патогенезе воспалительной патологии глаза и антиэндотоксиновая составляющая ее лечения // Патологическая физиология и экспериментальная терапия. 2007; 1: 12-14.
- Таболин В. А., Лазарева С. И., Яковлев М. Ю. Антифосфолипидный синдром: важная роль эндотоксиновой агрессии // Педиатрия. 2001; 5: 80-84.
- Яковлев М. Ю. Элементы эндотоксиновой теории физиологии и патологии человека // Физиология человека. 2003; 3: 154-164.
- Чернихова Е. А., Аниховская И. А., Гатауллин Ю. К. и др. Энтеросорбция как важное средство устранения хронической эндотоксиновой агрессии // Физиология человека. 2007; 3: 135-136.
Статья опубликована в журнале Лечащий Врач
материал с сайта MedLinks.ru



