К вопросу о патогенезе воспалительных заболеваний кишечника у детей, коррекция терапии
О. В. Федорова, кандидат медицинских наук
Э. Н. Федулова, кандидат медицинских наук
О. А. Тутина
Л. В. Коркоташвили, кандидат медицинских наук
Нижегородский НИИ детской гастроэнтерологии, Нижний Новгород
Согласно этиопатогенетической модели воспалительных заболеваний кишечника (ВЗК), разработанной в Нижегородском НИИ детской гастроэнтерологии, эти заболевания, к которым относят неспецифический язвенный колит (НЯК) и болезнь Крона, представляются как каскад самоподдерживающихся патофизиологических реакций: адаптационно-микроциркуляторных, гипоксическо-метаболических, аутоиммунного воспаления и дисбиотических нарушений, развивающихся на фоне генетических особенностей организма под влиянием неблагоприятных воздействий факторов внешней среды.
Учитывая представленную концепцию, терапия ВЗК предусматривает воздействие на все ее звенья: уменьшение антигенной нагрузки, противовоспалительное действие, улучшение микроциркуляции, детоксикация, нормализация биоценоза кишечника, коррекция дефицитных состояний, иммунокоррекция, снятие психоэмоционального напряжения. Для решения поставленных задач используются следующие виды лечения: диетотерапия, лекарственная терапия, фитотерапия, оперативное лечение [1, 2].
Повышение эффективности современной терапии невозможно без учета отдельных, вновь уточняемых звеньев патогенеза. Одно из них связано с развитием эндогенной интоксикации (ЭИ). Возникновение ЭИ у детей с ВЗК обусловлено повышенной проницаемостью кишечной стенки, степень которой зависит от распространенности, глубины и характера поражения толстой кишки.
По основному механизму развития различают следующие виды ЭИ: обменная (продукционная) — вследствие нарушения тканевых обменных процессов; ретенционная — результат задержки конечных или промежуточных продуктов нормального обмена; резорбционная — вследствие поступления во внутреннюю среду организма продуктов распада тканей или содержимого кишечника; интоксикационная — обусловленная воздействием бактериальных токсинов. По-видимому, механизм развития ЭИ у больных ВЗК смешанный, а развивающаяся в результате ЭИ перестройка обменных процессов, перенапряжение адаптации, срыв работы компенсаторных механизмов ведут к структурно- метаболическим нарушениям и поддержанию эндотоксикоза.
Что же представляют собой эндогенные токсины? Это: 1) бактериальные экзо- и эндотоксины, поступающие в кровь из энтеральной среды и очагов деструкции; 2) конечные метаболиты и промежуточные продукты обмена в высоких концентрациях; 3) биологически активные вещества различных классов в концентрациях, превышающих физиологические; 4) перекисные продукты; 5) протеолитические, липолитические и другие виды ферментов. Существует также классификация токсинов по размерам, в соответствии с которой выделяют четыре группы: I группа — низкомолекулярные токсины, размер до 500 дальтон; II группа — среднемолекулярные токсины, размер от 500 до 5000 дальтон; III группа — крупномолекулярные токсины, с размером молекул свыше десяти тысяч дальтон; IV группа — сверхмолекулярные токсины, с размером молекул в миллионы дальтон.
Действие эндотоксинов на клеточные структуры весьма разнообразно: повреждение клеточных мембран, активация лизосомальных ферментов клетки, блокада митохондриального окисления, ингибирование рибосомального синтеза, инициирование свободнорадикальных процессов и др. Развивающаяся при этом разбалансировка иммунологических процессов и различных метаболических циклов создает условия для поддержания активности воспалительного процесса в слизистой оболочке и сопровождающих его микроциркуляторных нарушений, которые опосредованно способствуют развитию и стойкости дисбиоза.
Действие эндотоксинов осуществляется путем прямых или опосредованных механизмов взаимодействия с эффекторными органами, клетками или субклеточными структурами. К веществам смешанного действия можно отнести продукты деструкции тканей, бактериальные экзотоксины, фракцию веществ низкой и средней молекулярной массы (ВНСММ). Они представляют собой вещества различной природы с молекулярной массой до 10000 Дн. К ним относятся, в том числе, продукты свободнорадикального окисления, промежуточного метаболизма, накапливающиеся в организме в превышающих нормальные концентрациях. Эти вещества можно подразделить на две фракции: катаболическую и анаболическую. В физиологических условиях как концентрация, так и распределение ВНСММ поддерживаются в организме на постоянном и индивидуальном уровне.
При этом они распределяются в крови между белками-носителями и гликокаликсом эритроцитов, способными транспортировать эти вещества. Областями влияния ВНСММ являются одновременно система коагуляции, сосудистая стенка, гладкомышечные элементы, митохондрии, лизосомы и другие элементы, на которые эти вещества влияют непосредственно или через включение каких-либо посредников. Анализ ВНСММ на токсичность показал, что они обладают также иммунодепрессивным эффектом — ингибируют реакции бласттрансформации лимфоцитов, образование розеток лимфоцитами, фагоцитарную активность лейкоцитов, замедляют нервную проводимость, а также влияют на процессы тканевого дыхания, подавляя способность аккумулировать и трансформировать энергию. Поэтому ВНСММ в настоящее время большинством авторов рассматриваются как универсальные маркеры эндогенной интоксикации, а определение концентрации ВНСММ в биологических средах организма является одним из наиболее информативных и доступных способов оценки выраженности ЭИ.
В целом развитие процесса эндогенной интоксикации можно представить как поступление эндогенных патологических субстанций из очага их образования (толстая кишка) через кровь в органы фиксации и биотрансформации (печень, иммунная система, легкие), органы выведения (печень, почки, желудочно-кишечный тракт, легкие, кожа), а также органы и ткани депонирования патологических субстанций (жировая ткань, нервная, костная ткань, органы эндокринной системы, лимфоидная ткань). Кровь и ее компоненты не являются только пассивными органами доставки эндотоксинов к системам детоксикации, выведения и депонирования, а активно принимают участие во всех этих процессах.
Сорбционная емкость эритроцитов по отношению к таковой белков плазмы значительно больше. Способность к транспортировке и накоплению разных веществ небольшой молекулярной массы зависит от специфического строения мембраны эритроцита. Эритроцит способен адсорбировать на своей поверхности значительное количество веществ разных классов, особенно олигопептидов (ОП), и транспортировать имеющиеся в плазме ВНСММ, ОП. Концентрация токсических веществ в организме увеличивается, если поступление и образование патологических субстанций превышает возможности их биотрансформации и элиминации, а также при функциональной недостаточности органов фиксации, инактивации, выведения и депонирования. Эти функциональные системы сами становятся опосредованным источником поступления токсинов в кровь.
Известно, что клинические проявления ЭИ очень многообразны и включают большой комплекс жалоб астеновегетативного характера, диспепсических и трофических нарушений. Такой полиморфизм объясняется тем, что развитие ЭИ связано с процессом накопления в организме больных избыточного количества промежуточных и конечных метаболитов, оказывающих токсическое действие на все органы и системы жизнеобеспечения. Развившийся эндотоксикоз, формирующий клиническое проявление ЭИ, определяет и исход заболевания, поскольку перестройка обменных процессов, перенапряжение адаптации, срыв работы компенсаторных механизмов ведут к структурно-метаболическим нарушениям.
Клинические симптомы ЭИ при ВЗК неспецифичны. Это так называемые «общие», во многом субъективные симптомы: слабость, быстрая утомляемость, снижение работоспособности, головная боль, нарушение сна, плохой аппетит, похудание, потливость, эмоциональная лабильность (как проявление нейротоксикоза), общая температурная реакция и т. д.
Цель работы: изучение эндогенной интоксикации при воспалительных заболеваниях толстой кишки у детей как нового аспекта патогенеза и обоснование эфферентной терапии.
Материалы и методы. Нами проведено клиническое наблюдение за 25 больными ВЗК от 5 до 17 лет; параллельно обследовались 40 детей с хроническими запорами различной выраженности. Неспецифический язвенный колит в соответствии с классификацией различали по форме с указанием локализации процесса и активности; фазе заболевания с указанием степени тяжести и течению. Кроме этого отмечали наличие внекишечных проявлений, осложнений, сопутствующих заболеваний. У детей с болезнью Крона толстой кишки изучаемые показатели рассматривались в зависимости от локализации, протяженности процесса и фазы заболевания.
При клиническом исследовании больных, помимо тщательного сбора анамнестических сведений, уделяли внимание абдоминальному болевому синдрому, диспепсическому и колитическому синдрому. Особое значение придавали наличию и выраженности проявлений общей интоксикации, в том числе нарушению общего состояния (ухудшение сна, беспокойство, недомогание, слабость, головные боли, снижение успеваемости, немотивированный субфебрилитет) и наличию трофических нарушений (снижение эластичности и сухость кожных покровов, дистрофические изменения волос и ногтей, периорбитальный цианоз). Физическое развитие оценивалось по ростовесовым показателям. При работе был использован комплекс методик, применяемый в педиатpии, в том числе клинико-лабораторные, биохимические, иммунологические, микробиологические исследования. Инструментальное обследование желудочно-кишечного тракта включало ультразвуковое сканирование органов брюшной полости, рентгеновское и эндоскопическое исследование толстой кишки с морфологическим анализом биоптатов слизистой оболочки.
Эндогенная интоксикация оценивалась по содержанию ВНСММ в эритроцитах, плазме и моче методом Малаховой М. Я. и соавт. [3]. Суть последнего способа состоит в осаждении крупномолекулярных частиц плазмы крови и эритроцитов раствором трихлоруксусной кислоты (ТХУ) 150 г/л и регистрации спектральной характеристики водного раствора супернатанта в зоне длин волн 238–298 нм. Регистрация спектра в данной зоне ультрафиолетовой части позволяет произвести комплексную оценку токсичных продуктов и более 200 наименований веществ, образующихся при нормальном и нарушенном метаболизме [4].
Результаты. У всех наблюдаемых зафиксирована ЭИ. Было выявлено, что в начальной фазе интоксикации наблюдается увеличение сорбционной емкости эритроцитов без подъема концентрации этих веществ в плазме крови (компенсаторная фаза). Во второй фазе наблюдается умеренное увеличение концентрации ВНСММ как в плазме крови, так и эритроцитах (фаза накопления продуктов из очага агрессии). В третьей фазе концентрация ВНСММ на эритроцитах остается неизменной (фаза полного насыщения), а в плазме крови концентрация их продолжает нарастать, достигая значительных величин (фаза обратимой декомпенсации органов детоксикации).
Наконец, четвертая фаза интоксикации характеризуется снижением концентрации ВНСММ на эритроцитах (вероятные изменения структуры мембран) и ростом содержания ВНСММ в плазме крови (фаза несостоятельности систем гомеостаза и необратимой декомпенсации органов детоксикации). Пятая, терминальная стадия эндогенной интоксикации характеризуется значительным повреждением мембран, сопровождающимся снижением содержания ВНСММ как на эритроцитах, так и в плазме крови (поступление продуктов катаболизма внутриклеточно, фаза полной дезинтеграции систем и органов).
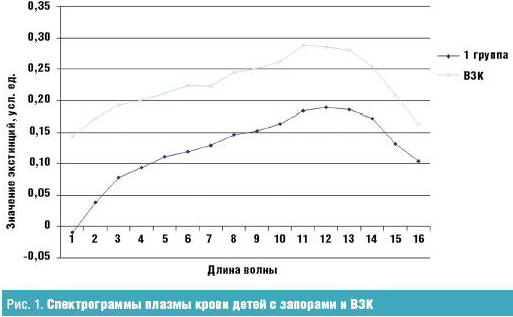
Профиль спектрограммы эритроцитов при анализе средних значений супернатанта после осаждения эритроцитарной массы ТХУ имел вид гиперболы с максимумом экстинции при длине волны 258 нм. Это обусловлено преимущественным наличием ВНСММ, содержащих фрагменты нуклеиновых кислот, имеющих максимум на данной длине волны. Содержание ВНСММ плазмы у больных с ВЗК было в 1,5 раза выше, чем у детей с запорами. Профили самих спектрограмм по форме практически одинаковы, при этом площадь поверхности под кривыми наибольшая у больных с ВЗК (рис. 1).
Определение содержания ВНСММ в моче позволило оценить детоксикационные возможности организма. У детей с ВЗК содержание ВНСММ в моче было достоверно выше, чем у детей контрольной группы. Спектрограмма мочи (рис. 2) у детей контрольной группы имела два максимума: первый, соответствующий пику содержания мочевины, мочевой кислоты, креатинина и других азотсодержащих продуктов — при длине волны 240–244 нм, и второй, соответствующий основному максимуму веществ плазмы крови — при длине волны 282 нм.
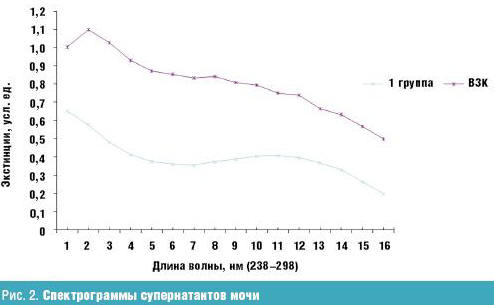
У больных с ВЗК кривая имела несколько иной профиль и была расположена значительно выше с максимумом стояния при длине волны 242 нм. Одномоментное определение олигопептидов, дающих Лоури-положительную реакцию, позволило количественно оценить меру активности протеолитических процессов в крови. Достоверное повышение значений OП отмечено у больных с ВЗК (рис. 3).

Индекс токсемии — суммарное отражение содержания ВНСММ в каждой среде и адекватно характеризует тяжесть токсикоза. Индекс интоксикации (ИИ) представляет собой сумму ИТ плазмы и эритроцитов. Он является интегральным показателем ЭИ крови и высчитывается по формуле: ИИ = ВНСММпл. × ОПпл. + ВНСММэр. × ОПэр. Оба этих показателя были достоверно более высокими у детей с ВЗК (р = 0,05).
Коэффициент степени эндогенной интоксикации (КСЭИ) рассчитывается как отношение ВНСММ крови и мочи и характеризует адекватность выведения почками токсических веществ. Обратный ему показатель — коэффициент степени выведения токсинов (КСВТ) представляет собой отношение ВНСММ мочи и крови. Коэффициент смещения спектрограммы плазмы (КССП) рассчитывается как отношение интегральных показателей ВНСММ плазмы при длинах волн до и после 282 нм, и у больных с ВЗК смещение спектрограммы плазмы было более выраженным (р = 0,05). О преимущественном накоплении ВНСММ в плазме у больных с ВЗК из-за снижения сорбционной емкости эритроцитов (р = 0,05) свидетельствует возрастание соотношения ВНСММ плазмы и эритроцитов (К1).
Обсуждение. Таким образом, развитие хронической толстокишечной интоксикации протекает фазово и достигает значительных значений у больных с ВЗК.
Эндогенная интоксикация и взаимосвязанные с ней метаболические, иммунологические сдвиги, морфофункциональные нарушения в слизистой оболочке толстой кишки, помимо диеты и назначения патогенетической противовоспалительной терапии с коррекцией дисбиотических нарушений, обосновывают необходимость и целесообразность применения препаратов из группы энтеросорбентов (ЭС). Как известно, энтеросорбция — метод, основанный на связывании и выведении из организма через желудочно-кишечный тракт эндогенных и экзогенных веществ, надмолекулярных структур и клеток. ЭС — лечебные препараты различной структуры и состава, осуществляющие связывание веществ в желудочно-кишечном тракте путем адсорбции, ионообмена и комплексообразования. У хорошо зарекомендовавших себя методов экстракорпоральной детоксикации выявлены и отрицательные стороны непосредственного контакта сорбентов с кровью, плазмой или лимфой. Они выражаются в повреждающем действии поглотителей на ферментные элементы, белки и ферментные системы крови, перераспределении жидкости между секторами организма, трансминерализации, нарушении проницаемости клеточных мембран. В связи с этим при ВЗК обосновано применение более щадящего метода — энтеросорбции [5].
Лечебное действие энтеросорбции обусловлено прямыми и опосредованными механизмами. К прямому относится: сорбция ядов и ксенобиотиков, поступающих per os; сорбция ядов, выделяемых в химус с секретом слизистых оболочек, печени, поджелудочной железы; сорбция эндогенных продуктов секреции и гидролиза; сорбция биологически активных веществ (БАВ) — нейропептидов, простагландинов, серотонина, гистамина и др.; сорбция патогенных бактерий и бактериальных токсинов; связывание газов и др. Опосредованное действие обусловлено предотвращением или ослаблением токсикоаллергических реакций, снижением метаболической нагрузки на органы экскреции и детоксикации, коррекцией обменных процессов и иммунного статуса, улучшением гуморальной среды, устранением дисбаланса БАВ, восстановлением целостности и проницаемости слизистых оболочек, устранением метеоризма, улучшением кровоснабжения кишечника.
Наиболее патогенетически обоснованным является назначение в качестве энтеросорбента Энтеросгеля, действующим веществом которого является полиметилсилоксана полигидрат (продукт нелинейной поликонденсации 1,1,3,3-тетрагидрокси-1,3-диметилдисилоксана полигидрат). Он имеет пористую структуру кремнийорганической матрицы (молекулярная губка) гидрофобной природы, которая характеризуется сорбционным действием по отношению к среднемолекулярным токсическим метаболитам (м. м. от 70 до 1000 атомных единиц).
Препарат обладает выраженными селективным сорбционным и детоксикационным свойствами, не уменьшая всасывания витаминов и микроэлементов, способствуя восстановлению нарушенной микрофлоры кишечника и не подавляя его двигательную функцию. Более крупные вещества (молекулярный вес sIgA — 150 000 атомных единиц) сорбент выводит из просвета кишечника. Поверхность препарата в сравнении с другими сорбентами обладает исключительной гидрофобностью.
Это свойство достигается благодаря избыточности метильных радикалов на поверхности глобул. Как показывают результаты микробиологических исследований, патогенная и условно-патогенная микрофлора адгезируется к его поверхности и разрушается, в то же время непатогенная микрофлора не подвергается адгезии и не разрушается. Компоненты погибших патогенных и условно-патогенных бактерий, включая фрагменты стенок, остаются на поверхности энтеросорбента. Не сорбируя sIgA и удаляя из просвета кишечника повреждающие энтерогематический барьер вещества, полиметилсилоксана полигидрат создает «комфортные условия» для регенерации эпителия слизистой оболочки кишечника, что значительно улучшает морфофункциональное состояние кишечника при ВЗК. Применение в комплексной терапии энтеросорбента способствует снижению токсической нагрузки на системы естественной детоксикации.
Клинический эффект применения энтеросорбции был доказан в многочисленных группах больных с разнообразным генезом ЭИ, в том числе и у детей с патологией толстой кишки. В частности, полиметилсилоксана полигидрат не всасывается в желудочно-кишечном тракте, выводится в неизмененном виде в течение 12 часов. Удобен для приема у детей энтеросорбент в виде пасты, которая легко разводится водой и назначается внутрь за 1–2 часа до или после еды или приема других лекарств по 1 десертной ложке (10 г) 2–3 раза в сутки курсами по 7–10 дней.
Заключение. Таким образом, ВЗК у детей сопровождаются развитием эндогенной интоксикации, выраженность которой обусловлена тяжестью процесса и зависит от характера поражения. Применение в комплексной терапии больных с ВЗК энтеросорбции снижает токсическую нагрузку на системы естественной детоксикации и риск развития инфекционных и аутоиммунных осложнений. Удобство и простота применения, а также хорошая переносимость и высокая эффективность позволяют рекомендовать полиметилсилоксана полигидрат для широкого применения у детей с ВЗК в комплексе лечебных мероприятий.
Литература
- Федулова Э. Н. Прогноз течения и оценка эффективности лечения неспецифического язвенного колита у детей: Дисс. канд мед. наук. Нижний Новгород. 2003. 177 с.
- Копейкин В. Н. Механизмы формирования и система оптимизации лечения неспецифического язвенного колита у детей: Дисс. докт. мед. наук. М., 1996. С. 189.
- Малахова М. Я. Метод регистрации эндогенной интоксикации / Пособие для врача. 1995. С. 4–30.
- Малахова М. Я., Оболенский С. В., Ершов А. Л. Диагностика стадий эндогенной интоксикации и дифференцированное применение методов эфферентной терапии // Вестн. хир. 1991. № 3. С. 95–100.
- Федорова О. В. Клиническое значение эндогенной интоксикации у детей с хроническими заболеваниями толстой кишки: Дисс. канд мед.наук. Нижний Новгород. 1999. 215 с.
Статья опубликована в журнале Лечащий Врач
материал с сайта MedLinks.ru