Введение
В последние десятилетия отмечается общемировая тенденция к увеличению продолжительности жизни и доли людей старше трудоспособного возраста. Старение ассоциировано с развитием многих заболеваний и инвалидизирующих состояний, что ухудшает качество жизни пожилых людей и их семей и увеличивает расходы на общественное здравоохранение и долговременный уход. Поэтому обеспечение здорового старения является важной задачей, ставшей одной из стратегий Всемирной организации здравоохранения.
Наиболее интересной для изучения процессов успешного старения и вместе с тем наименее изученной является группа долгожителей, т. е. людей в возрасте 90 лет и старше. В качестве интегрального клинического показателя старения у людей пожилого возраста можно использовать старческую астению (СА). Это гериатрический синдром, характеризующийся возраст-ассоциированным снижением физиологического резерва и функций многих систем организма, приводящий к повышенной уязвимости организма пожилого человека к воздействию эндо- и экзогенных факторов и высокому риску развития неблагоприятных исходов для здоровья, потере автономности и смерти [1].
Выявление факторов, ассоциированных со СА, может быть полезным для определения ее биомаркеров, более глубокого понимания причин ее развития и, в дальнейшем, определения терапевтических мишеней для ее профилактики. По данным мировой литературы был описан ряд лабораторных параметров — потенциальных биомаркеров СА, к которым можно отнести маркеры воспаления и оксидативного стресса, иммунологические, биохимические, эпигенетические, гормональные показатели, маркеры метаболизма глюкозы и липидов и др. [2, 3].
Однако, несмотря на то, что в настоящее время накоплено некоторое количество данных о взаимосвязи гормонально-метаболических параметров, процессов старения и СА, многие из них остаются противоречивыми, а исследований, в которых бы они оценивались в модели успешного старения на когорте долгожителей, практически нет. В российской популяции исследования на большой выборке долгожителей ранее не проводились.
Целью исследования явилось изучение связи гормонально-метаболического статуса с синдромом СА у российских долгожителей.
Материал и методы
Содержание статьи
Место и время проведения исследования
Исследование продолжается по настоящее время, для анализа были отобраны данные за период с января 2019 г. по декабрь 2021 г. Исследование выполнено на базе обособленного структурного подразделения «Российский геронтологический научно-клинический центр» ФГАОУ ВО РНИМУ им. Н.И. Пирогова совместно с Центром стратегического планирования и управления медико-биологическими рисками здоровью Федерального медико-биологического агентства.
Исследование было одобрено локальным этическим комитетом ОСП РГНКЦ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, протокол № 30 от 24.12.2019.
В исследование включались лица в возрасте 90 лет и старше, предоставившие письменное информированное согласие на участие в исследовании. В общей сложности было включено 3007 человек, соответствующих критериям включения.
Выборка формировалась произвольным способом: поиск участников осуществлялся с привлечением социальных служб, пансионатов для ветеранов труда, геронтологических центров и других гериатрических служб.
Дизайн исследования
Проведено обсервационное когортное исследование. Участникам исследования во время визита врача и медицинской сестры проводилась комплексная гериатрическая оценка со сбором анамнеза, применением гериатрических шкал и опросников с целью выявления наличия и тяжести синдрома СА (шкала оценки функционального статуса Бартел, шкала инструментальной активности Лоутона, краткая батарея тестов физического функционирования, скрининг «Возраст не помеха»). Подтверждение диагноза СА проводилось при наборе 7 и менее баллов по результатам краткой батареи тестов физического функционирования и по решению врача-гериатра на основе актуальных клинических рекомендаций.
Также у участников был совершен забор образцов крови с дальнейшей оценкой параметров липидограммы, показателей углеводного обмена, гормональных факторов, длины теломер. Определялись следующие биохимические показатели: общий холестерин, холестерин липопротеинов низкой плотности (ЛПНП), холестерин липопротеинов высокой плотности (ЛПВП) (энзиматический метод), глюкоза (фотометрический метод), альбумин, общий белок (биуретовый метод), гликированный гемоглобин (капиллярный электрофорез), аполипопротеин А1, аполипопротеин В (иммунотурбодиметрический метод). Оценивались гормональные показатели: тиреотропный гормон (ТТГ), свободный трийодтиронин (свТ3), инсулиноподобный фактор роста 1 (ИФР-1), кортизол, тестостерон, эстрадиол, 25-ОН витамин D, адипонектин, лептин, инсулин (хемилюминесцентный анализ).
Анализ длины теломер проводился методом ПЦР в реальном времени. Оценивалось количество ДНК с теломерной последовательностью в геноме. Параллельно проводилась ПЦР в реальном времени к однокопийному участку геномной ДНК. Отношение количества теломерной и однокопийной матриц пропорционально длине теломер. В качестве реперной точки использовалась геномная ДНК из клеточной линии HEK293 [4].
Статистический анализ
На первом этапе анализа данных для числовых переменных были использованы методы описательной статистики с указанием следующих характеристик.
Для переменных с нормальным распределением:
-
число непропущенных значений (N);
-
арифметическое среднее (M);
-
стандартное отклонение (SD).
-
Для переменных с распределением, отличным от нормального:
-
число непропущенных значений (N);
-
медиана (Ме);
-
значения 1-го и 3-го квартиля (Q1; Q3).
Для проверки выборок на отклонения от нормального распределения использовался тест Колмогорова — Смирнова. Далее в рамках первичного межгруппового сравнения была оценена статистическая значимость различий в гормонально-метаболическом статусе пациентов со СА и без СА.
Для параметров с нормальным распределением использовали независимый t-тест, а для параметров с распределением, отличным от нормального, — тест Манна — Уитни. Для исключения ошибки первого рода была введена поправка Бонферрони.
Далее в рамках первичного межгруппового сравнения была оценена статистическая значимость различий в гормонально-метаболическом статусе пациентов со СА и без СА.
Полученные результаты и выводы были использованы для описания выборки и предварительного отбора факторов, которые могут иметь потенциальную взаимосвязь с изучаемым синдромом. В качестве потенциальных факторов были отобраны тиреоидные гормоны, кортизол, половые гормоны, показатели углеводного обмена, показатели липидограммы, адипонектин, лептин, ИФР-1, 25-ОН витамин D, общий белок, альбумин.
По результатам межгруппового сравнения был проведен предварительный отбор факторов, которые оказались статистически значимыми на первом этапе анализа (см. таблицу). Далее были исключены факторы, которые высоко коррелировали при проведении попарного корреляционного анализа. Из оставшихся факторов была составлена модель логистической регрессии, где зависимой переменной было наличие СА.
Для каждого фактора, включенного в модель, были рассчитаны отношения шансов (ОШ) наличия синдрома, значение p для значимости этого фактора в модели, а также 95% доверительный интервал (ДИ) для ОШ.
Анализ данных был проведен с помощью программы RStudio (версия 4.1.2) с использованием релевантных пакетов статистического анализа.
Результаты исследования
Старческая астения была обнаружена у 627 (82,6%) из 759 мужчин и у 2061 (91,7%) из 2248 женщин. В первую очередь был проведен анализ взаимосвязи пола и возраста с изучаемым синдромом.
По его результатам было показано, что лица более молодого возраста имели значительно меньший риск наличия СА (см. таблицу). Кроме того, СА была достоверно более распространена среди женщин. В связи с выявленными закономерностями для всех последующих анализов были введены поправки на пол и возраст. Для избежания случайных находок также вводилась поправка на множественное сравнение.
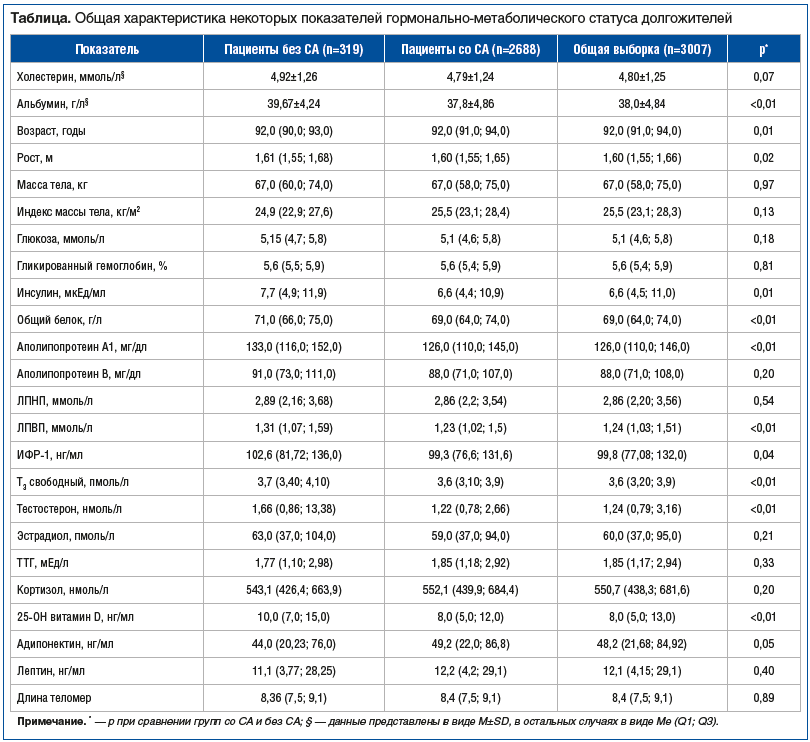
Общая характеристика исследуемой группы долгожителей, а также клинические различия участников со СА и без СА представлены в таблице и на рисунках 1, 2.
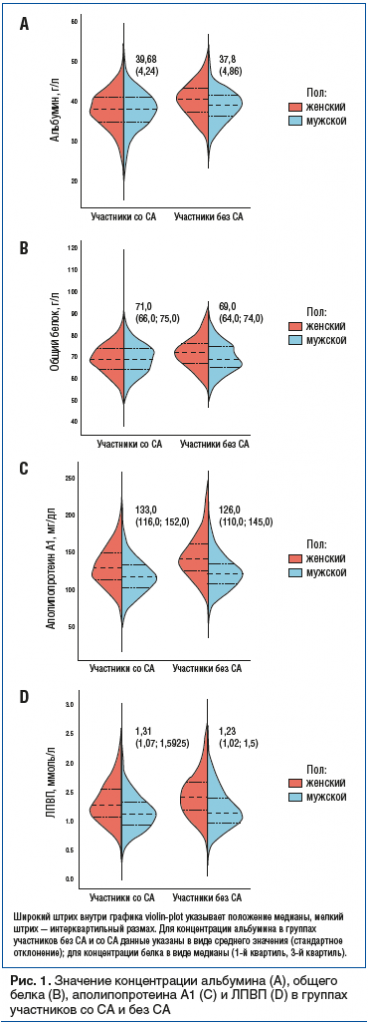
Большинство изучаемых параметров находились в пределах референсных значений по возрасту и полу, однако необходимо отдельно отметить выраженный дефицит витамина D, который наблюдался как в общей выборке, так и в группе пациентов со СА.
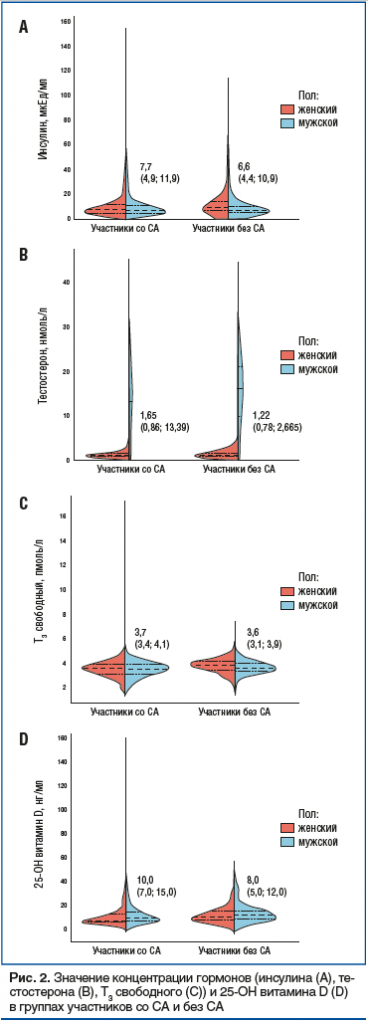
При составлении модели логистической регрессии были исключены факторы, которые высоко коррелировали при проведении попарного корреляционного анализа (рис. 3): ЛПВП и общий белок (рис. 4).
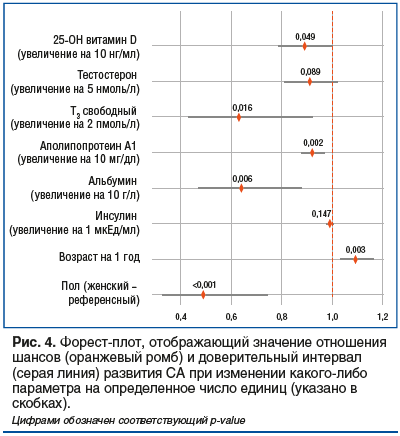
Согласно полученным результатам увеличение возраста на 1 год повышало шанс наличия CА на 9% (95% ДИ 3%, 16%). Повышение уровня альбумина на 10 г/л снижало шансы наличия CА на 36% (95% ДИ 12%, 53%). Повышение уровня аполипопротеина А1 на 10 мг/дл снижало шансы наличия CА на 8% (95% ДИ 3%, 12%). Повышение уровня свободного Т3 на 2 пмоль/л снижало шансы наличия CА на 37% (95% ДИ 8%, 57%). Увеличение концентрации 25-ОН витамина D на 10 нг/мл снижало шансы наличия СА на 11% (95% ДИ 0,0001%, 21%).
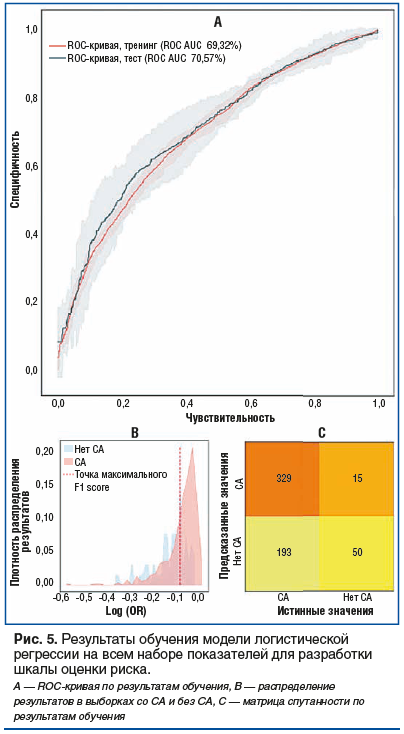
На основании полученных данных была обучена модель логистической регрессии для предсказания риска развития СА среди пациентов. Результаты обучения модели представлены на рисунке 5. После кросс-валидации была выбрана модель с точностью 70,57% (ROC AUC). Метрика точности F1 составила 31,6. Несмотря на относительно низкие показатели точности модели, она может применяться для базовой оценки рисков развития СА и коррекции состояния, используя связи различных параметров по результатам обучения.
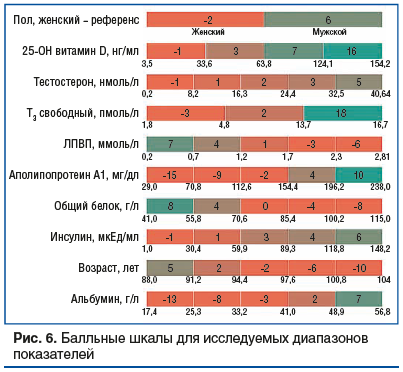
С целью повышения практической применимости исследования на базе объединенной модели логистической регрессии была разработана шкала риска (рис. 6), которая позволяет по результатам биохимического анализа крови и общих данных оценить риск развития астении в старческом возрасте. Был учтен вес различных показателей в объединенной модели, и, согласно этим весам, рассматриваемые диапазоны различных параметров были переформатированы в балльную шкалу для возможности использования исследователями.
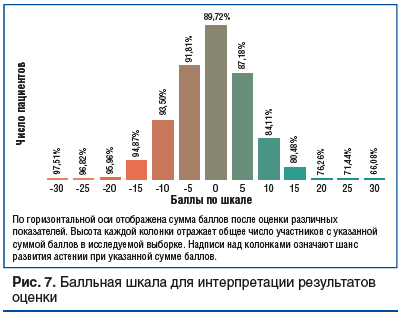
На приведенной шкале для всех исследуемых параметров указаны диапазоны и баллы, которые соответствуют данному диапазону. После проведения анализов и суммирования всех баллов риск развития СА рассчитывается по шкале, которая представлена на рисунке 7. Общая сумма баллов 0 соответствует среднепопуляционному риску развития астении в старческом возрасте, который в рассматриваемой выборке составил 89,7%.
Обсуждение
Сопоставление с другими публикациями. Частота встречаемости СА варьирует по результатам различных исследований. На настоящий момент имеются данные по частоте встречаемости СА среди пожилых людей, демонстрирующие гораздо более низкую распространенность СА, чем в изучаемой нами группе. Так, по данным исследования В.С. Остапенко [5], распространенность СА среди пациентов поликлиник г. Москвы в возрасте 65 лет и старше составляет от 4,2 до 8,9%, преастении — от 45,8 до 61,3%. В свою очередь, по результатам проспективного исследования на китайской популяции было установлено, что распространенность СА с возрастом увеличивается, составляя в группе пациентов в возрасте 65–79 лет 4,8%, в группе 80–89 лет — 19,4%, достигает максимума у долгожителей (в группе 90–99 лет — 39,8%, после 100 лет — 58,9%) [6]. Таким образом, можно говорить о высокой значимости синдрома СА для лиц старческого возраста, в том числе долгожителей.
Полученные нами результаты продемонстрировали, что наличие СА обратно коррелировало с увеличением концентрации 25-ОН витамина D, альбумина, аполипопротеина А1, свТ3. Таким образом, эти показатели могут играть протективную роль в отношении СА либо быть ее отражением.
Наши данные относительно связи 25-ОН витамина D со СА согласуются с данными других авторов.
В частности, по данным метаанализа O. Bruyère et al. [7], было показано обнаружение низкого уровня 25-ОН витамина D у пожилых людей со СА. По данным ряда проспективных исследований, включенных в анализ, также было отмечено, что низкий уровень 25-ОН витамина D связан с повышенным риском ухудшения состояния здоровья. Недавние исследования предполагают, что взаимосвязь между уровнем витамина D и СА в значительной степени опосредована развитием саркопении. Полученные нами данные о выраженном дефиците 25-ОН витамина D в когорте долгожителей со СА подтверждают общемировую тенденцию. Связь между уровнем 25-ОН витамина D и СА, по данным вышеупомянутого метаанализа, реализуется с помощью еще нескольких механизмов, включая повышение уровня паратиреоидного гормона у пациентов с первичным гиперпаратиреозом, что приводит к снижению эффектов 25-ОН витамина D, оказываемых на мышечную ткань. Также снижение уровня 25-ОН витамина D рассматривается как триггер усиления некоторых мультисистемных патофизиологических процессов, включая хроническое воспаление, что в свою очередь потенцирует развитие СА.
В исследовании A.M.M. Vaes et al. [8] также была установлена взаимосвязь между уровнем 25-ОН витамина D и наличием СА. В этом исследовании концентрации 25-ОН витамина D в сыворотке были в значительной степени связаны с наличием СА и такими показателями функционального статуса, как скорость ходьбы и тест «Встань и иди». В еще одном небольшом исследовании на когорте пожилых госпитализированных пациентов с СА [9] было продемонстрировано, что 25-ОН витамин D является независимым фактором, влияющим на возникновение данного гериатрического синдрома.
Механизмы действия аполипопротеина А1 изучались в течение длительного времени. Известно, что аполипопротеин А1 обладает выраженным противовоспалительным и антиоксидантным эффектом. Кроме того, аполипопротеин А1 продемонстрировал протективный эффект относительно развития СА. Известно, что аполипопротеин A1 усиливает фибринолиз, снижает агрегацию тромбоцитов, увеличивает выработку и стабилизацию простациклина и предотвращает атерогенные иммунные и воспалительные реакции. Активация генов, ответственных за синтез аполипопротеина А1, позволяет уменьшать проявления атеросклеротических изменений в сосудистой стенке и вносить свой положительный вклад в увеличение продолжительности жизни [10]. В последнее время проводится активное изучение полиморфизма аполипопротеина А1 и идентификация аллелей с наиболее выраженным противовоспалительным и антиоксидантным эффектом, а также оценка их влияния на продолжительность жизни [11].
Еще в одном исследовании на когорте долгожителей [12] были проанализированы уровни различных аполипопротеинов и их влияние на физическую и когнитивную функцию. Отрицательная взаимосвязь с уровнем аполипопротеина А1 и состоянием физической и когнитивной функции была продемонстрирована у женщин, причем это взаимовлияние становилось менее выраженным с увеличением возраста.
Вклад концентрации тиреоидных гормонов в развитие и прогрессирование СА подробно изучался в последнее время. Тиреоидные гормоны играют ключевую роль в процессах метаболизма, термогенеза, иммунного ответа. Биоактивной формой тиреоидных гормонов щитовидной железы является Т3. С возрастом концентрация как свТ4, так и свТ3 снижается, но в процессе здорового старения компенсаторное увеличение концентрации 5-дейодиназ позволяет избежать клинически значимого изменения концентрации данного гормона [13].
Однако исследование уровня Т3 у пациентов пожилого и старческого возраста еще не вошло в рутинную практику. Тем не менее Т3 оказывает существенное влияние на процессы старения. В частности, в исследовании B. Arosio et al. [14] было показано, что более высокие концентрации свТ3 и более высокое отношение свТ3/свТ4 отрицательно коррелируют с наличием СА в когорте долгожителей и могут являться независимым маркером СА в данной группе пациентов, что соотносится с полученными нами результатами.
Альбумин — широко используемый в гериатрической практике маркер статуса питания, функции почек, воспаления, а также СА, которая часто сочетается с мальнутрицией. Многие эффекты действия альбумина опосредуются через взаимодействие с осью соматотропный гормон/ИФР-1. Снижение концентрации альбумина приводит к снижению концентрации ИФР-1, что в свою очередь негативно сказывается на мышечной ткани, функциональном статусе и потенцирует развитие СА в пожилом возрасте [15].
Обнаруженная нами значимая ассоциация уровня альбумина и СА у долгожителей подтверждает данную тенденцию. С другой стороны, выявление данной ассоциации может указывать на возможную терапевтическую мишень СА.
Клиническая значимость результатов. Полученные результаты представляют клинический интерес в связи с обнаружением факторов, ассоциированных со СА среди долгожителей. Разработанная на основе результатов логистической регрессии балльная шкала представляет собой инструмент, который позволит врачу быстро и даже дистанционно оценить риск развития СА у пациента на основании рутинных показателей анализа крови и данных пола и возраста. Поэтому такая балльная шкала может представлять практический интерес для врачей-гериатров.
Ограничения исследования. Исследование ограничивается поперечным дизайном, а также не имеет своей целью набор репрезентативной выборки долгожителей ввиду ограниченного доступа к данной возрастной группе.
Направления дальнейших исследований. С целью продолжения нашей работы планируется дальнейший набор пациентов и проведение проспективной части исследования.
Заключение
Таким образом, согласно полученным нами результатам, достоверно связанными со СА можно считать уровни 25-ОН витамина D, аполипопротеина А1, свТ3 и альбумина в крови. Поддержание этих показателей на оптимальном уровне потенциально может оказаться эффективным средством профилактики СА. Однако с целью окончательного решения этого вопроса необходимо проведение масштабных проспективных исследований для того, чтобы детально изучить влияние данных факторов на развитие и прогрессирование СА.
Источник финансирования
Исследование выполнено при финансовом обеспечении ФГБУ «ЦСП» ФМБА России.
Благодарность
Авторский коллектив выражает благодарность Л.В. Майтесян, А.С. Кругликовой, И.В. Тарасовой, В.Р. Матюхиной, а также всем остальным врачам и медицинским сестрам, участвовавшим в работе, за набор пациентов и организацию исследования; А.А. Акопян — за набор участников исследования и формирование базы данных, Д.Е. Королеву — за организацию забора, транспортировки и хранения биообразцов.
Информация с rmj.ru






