Введение
На фоне неустойчивой эпидемической обстановки в мире проблеме профилактики острых респираторных вирусных инфекций (ОРВИ) уделяется пристальное внимание. Основным методом специфической профилактики гриппа и новой коронавирусной инфекции COVID-19 является вакцинация. Тем не менее, несмотря на эффективность данного метода, сохраняются значительные проблемы, связанные именно с его специфичностью, отсутствием вакцин против большей части возбудителей ОРВИ и достаточно высоким числом отказов от вакцинации, связанных с дискуссиями о возможных осложнениях данного метода [1, 2]. Кроме того, грипп и ОРВИ остаются практически неконтролируемыми заболеваниями из-за высокой изменчивости антигенной структуры циркулирующих вирусов гриппа и гетерогенности возбудителей острых респираторных инфекций, насчитывающих более 200 видов. Новые исследования по коронавирусной инфекции COVID-19, вызванной SARS-CoV-2, также показали механизмы подавления интерфероногенеза и уклонения от иммунного ответа, как и при других ОРВИ [3, 4].
В современной научной литературе продолжается дискуссия о роли и эффективности неспецифической иммунопрофилактики при ОРВИ. Естественно, что многочисленные коллективы исследователей настойчиво ищут дополнительные пути и средства решения этой серьезной проблемы.
Комплексный препарат Цитовир®-3 представляет собой развитие концепции трехкомпонентной схемы профилактики и раннего патогенетического лечения гриппа и ОРВИ, предусматривающей сочетанное применение хорошо изученных фармакопейных лекарственных средств: бендазола, тимогена натрия и аскорбиновой кислоты — в течение 4 дней. Приведенная методика защищена патентом РФ № 2107498 (1998 г.). Прием препаратов по данной комбинированной схеме позволял снизить респираторную заболеваемость как взрослых, так и детей в организованных коллективах в 1,5–3 раза. Опыт проведенных доклинических и клинических исследований свидетельствует о возможности применения препарата Цитовир®-3 в очагах ОРВИ и гриппа для различных видов массовой профилактики [1, 4]. Вместе с тем некоторые механизмы иммунотропной активности данного препарата остаются не вполне изученными.
Цель исследования: изучить безопасность, переносимость и иммунотропную активность (фармакодинамику) у здоровых лиц, получавших пролонгированный курс
(14 дней) различных лекарственных форм препарата
Цитовир®-3.
Материал и методы
Исследование проведено на основании разрешения Минздрава России и после экспертизы совета по этике при Минздраве России. В соответствии с дизайном, предполагавшим открытое исследование иммунологических параметров на фоне приема двух лекарственных форм препарата Цитовир®-3 в форме порошка для приготовления раствора и сиропа, обследовано 40 добровольцев мужского пола, средний возраст которых составил 25,9±3,6 года. Все добровольцы, включенные в исследование (для каждой лекарственной формы препарата по 20 человек), были совершеннолетними здоровыми мужчинами без жалоб на момент выполнения процедур скрининга, не имеющими хронических заболеваний и не принимающими какие-либо препараты сопутствующей терапии. Согласно критериям включения все показатели, характеризующие состояние основных витальных функций всех прошедших скрининг добровольцев, находились в пределах нормальных значений. При анализе данных клинического и биохимического исследований крови, общего анализа мочи на этапе скрининга не было зарегистрировано ни одного клинически значимого случая отклонения показателей от референсных значений. Общая продолжительность участия в исследовании для одного добровольца составила 18 дней: скрининг — 2 дня, прием препарата — 14 дней, заключительное обследование (период наблюдения) — 2 дня. Добровольцы получали препарат Цитовир®-3 по одинаковой схеме: по 12 мл готового раствора или сиропа за 30 мин до еды 3 р/день.
Согласно протоколу клиническое исследование имело следующие реперные точки. В каждой группе на скрининге, на 7-й и 17-й дни исследования оценивались иммунологические показатели, влияющие на резистентность организма к возбудителям респираторных инфекций: индуцированная окислительная активность гранулоцитов и моноцитов периферической крови по величине флуоресценции и фагоцитарная активность (фагоцитарный индекс) гранулоцитов и моноцитов периферической крови с помощью лазерной проточной цитофлуориметрии. В эти же сроки оценивали содержание в сыворотке общего интерферона (ИФН) и выработку клетками индуцированного вирусом болезни Ньюкасла ИФН-α и ИФН-β биологическим методом (результат представлен в титрах, равных международным единицам (МЕ) активности ИФН в 1 мл сыворотки крови (МЕ/мл)) [5]. Содержание секреторного иммуноглобулина А (sIgA) в слюне и сывороточного IgA определяли методом ИФА. Помимо иммунологических параметров ежедневно оценивались безопасность и переносимость лекарственного препарата по абсолютному/относительному количеству и степени тяжести нежелательных явлений (НЯ) у добровольцев. Регистрировались НЯ, объективно зафиксированные врачом-исследователем, а также субъективно отмеченные самим добровольцем. В первом случае НЯ выявлялись по клиническим показателям витальных функций в рамках стандартного физикального осмотра, а также по лабораторным и инструментальным параметрам (клиническое и биохимическое исследование крови, общий анализ мочи, ЭКГ) в 1, 7 и 17-й дни исследования. Кроме того, определяли маркеры гепатитов В и С, ВИЧ и сифилиса в 1-й день исследования.
Для проведения статистического анализа был использован пакет статистических программ Statistica 12.0 for Windows. За уровень статистической значимости было принято значение p<0,05. Данные, распределение которых соответствовало нормальному, были представлены в виде средних арифметических значений с указанием стандартных квадратических отклонений. Данные, распределение которых отличалось от нормального (для оценки отличия распределения от нормального был использован критерий Лиллиефорса), были представлены в виде медианы и квартильных интервалов. В связи с небольшим объемом выборки для оценки динамики показателей между визитами в большинстве случаев использовались непараметрические критерии. Оценка динамики показателей проводилась с использованием критерия Уилкоксона и критерия МакНемара. При необходимости применялась поправка Бонферрони на множественность сравнения. Достоверность различий между показателями зависимых групп для параметрических данных с нормальным распределением оценивалась с помощью t-критерия Стьюдента для связанных групп [6]. С целью контроля валидности полученных данных формирование баз и их статистическая обработка проводились параллельно специалистами по биостатистике в двух независимых центрах.
Результаты и обсуждение
Нежелательных явлений в ходе клинического исследования зарегистрировано не было. Клинически значимых негативных отклонений клинических и лабораторных показателей не зафиксировано. Выбывших участников на этапе клинического исследования не было. Все добровольцы завершили исследование в плановом порядке согласно протоколу.
На фоне приема различных лекарственных форм препарата Цитовир®-3 не отмечено существенного изменения уровня IgA в крови добровольцев (медианные значения показателя в 2, 7, 17-й дни исследования соответственно: 1,835 г/л, 1,505 г/л, 1,465 г/л при приеме препарата в форме порошка и 1,415 г/л, 1,315 г/л, 1,335 г/л — в форме сиропа).
При анализе изменений содержания sIgA в слюне от скрининга к 17-му дню исследования отмечен статистически значимый (р=0,012) рост данного показателя (скрининг — 23,6 мкг/мл; 7-й день — 47,8 мкг/мл; 17-й день — 54,9 мкг/мл)
в процессе приема исследуемого препарата в форме порошка. На фоне приема препарата в виде сиропа к 7-му дню отмечено незначительное снижение, а в дальнейшем рост уровня sIgA в слюне — на 18,4% к 17-му дню. Однозначно трактовать разнонаправленные изменения у здоровых добровольцев достаточно сложно, так как изменения уровня sIgA могут быть обусловлены различными экзо- и эндогенными факторами (состоянием органов ротовой полости, носоглотки; хроническими воспалительными заболеваниями; изменением пейзажа микрофлоры при формировании нового коллектива добровольцев; уровнем аллергизации и т. д.). Критическая оценка статистической значимости вышеописанных внутригрупповых различий в полученных результатах и их трактовка проводились с учетом пересечения межквартильных диапазонов выборок на всех визитах [7, 8].
В начале исследования титр вирус-индуцированного ИФН-α и ИФН-β 1/80 был у каждого третьего волонтера, что ниже нормы (128–640 МЕ/мл) [5]. Оценка динамики уровня вирус-индуцированного ИФН-α и ИФН-β от дня скрининга к 17-му дню показала статистически значимое (χ2=6,0;p=0,015) увеличение количества лиц с титрами 1/160 по сравнению с исходными данными с 20% до 50%. Данный факт явился непосредственным положительным результатом применения исследуемой схемы препарата Цитовир®-3 в двух лекарственных формах и может быть отнесен к категории клинически значимых (рис. 1).

При этом базальный (спонтанный) уровень in vitro не стимулированной секреции ИФН-α и ИФН-β и общего ИФН в сыворотке крови у всех участников находился в пределах нормальных титров 1/10–1/20. Таким образом, анализ полученных результатов показал, что исследуемый препарат не оказывает прямого стимулирующего влияния на уровень выработки общего ИФН.
Применение различных лекарственных форм препарата Цитовир®-3 практически не влияло на уровень стимулированной окислительной активности моноцитов, который сохранялся стабильным на протяжении всего клинического исследования (медианные значения показателя в 2, 7 и 17-й дни исследования соответственно: 58,5 у. е., 59,5 у. е., 59,5 у. е. при приеме препарата в форме порошка и 93,5 у. е.,
64,0 у. е., 77,0 у. е. — в форме сиропа).
Однако применение различных лекарственных форм препарата Цитовир®-3 показало достоверное повышение медианы стимулированной окислительной активности нейтрофильных гранулоцитов в течение исследования: от 275 у. е.
до начала приема препарата (скрининг) до 945,5 у. е. к 17-му дню (порошок) и от 282 у. е. до 453 у. е. соответственно (сироп), что свидетельствует об усилении потенциальной способности нейтрофильных гранулоцитов к дезинтеграции антигенов и повышении резистентности к инфекционным заболеваниям (рис. 2) [9, 10].
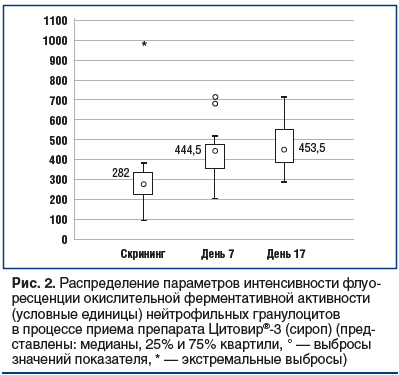
Выявленный статистически значимый прирост стимулированной окислительной активности нейтрофильных гранулоцитов (скрининг / день 7, р=0,000449; скрининг /
день 17, р=0,000089; день 7 / день 17, р=0,000089) у здоровых добровольцев свидетельствует о наличии у комплекса Цитовир®-3 иммуномодулирующей активности, заключающейся в потенцировании метаболических параметров клеток врожденного иммунитета, которые не изменяют иммунный гомеостаз здоровых людей, но могут быть реализованы при взаимодействии организма с патогенами (вирусами, бактериями, грибами, простейшими) [9–12].
Результаты оценки параметров распределения относительного количества моноцитов, фагоцитирующих стандартную культуру бактерий Escherichia coli (фагоцитарный индекс), на скрининге, на 7-й и 17-й дни показали, что динамика изменения данного показателя на фоне приема исследуемого препарата носила линейный характер и была отнесена к категории положительных (при сравнении данных 2-го
и 7-го дней: Z=3,379, р<0,001; при сравнении данных скрининга и 17-го дня: t=-9,46, р<0,001), так как повышение данного показателя характеризует усиление иммунорезистентности организма к инфекционным агентам (рис. 3) [11, 12].
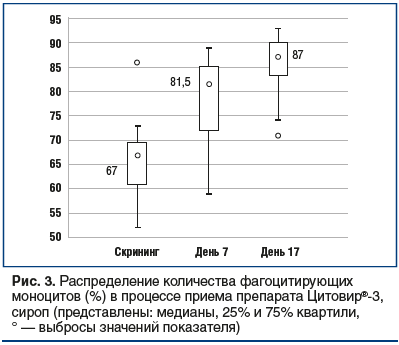
Следует отметить, что динамика данного показателя на фоне пролонгированного курса приема исследуемого препарата Цитовир®-3 характеризуется линейным ростом со статистически значимым увеличением при сравнении данных, полученных на скрининге и в 7-й день, а также на скрининге и в 17-й день исследования.
Несмотря на то, что во всех реперных точках исследования средние значения относительного количества гранулоцитов, фагоцитирующих E. coli, находились в пределах референсного интервала (что является свидетельством сохранения благоприятного профиля безопасности исследуемого препарата), отмечался вместе с тем статистически значимый рост этого показателя при сравнении данных в день скрининга и в 17-й день исследования — 93,5% и 97,5% соответственно (Z=3,621, р<0,001). Сходные результаты получены и при использовании порошка для приготовления сиропа, что характеризует стабильную воспроизводимость изученных параметров как клеточного, так и гуморального врожденного иммунитета независимо от лекарственной формы препарата.
Увеличение фагоцитарной и ферментативной активности гранулоцитов и моноцитов имеет большую клиническую значимость, которая заключается в повышении микробицидной активности клеток врожденного иммунитета, способствующего предотвращению манифестации респираторных инфекций и уменьшению количества бактериальных осложнений гриппа, ОРВИ и COVID-19, что показано и другими авторами [13–15].
Выводы
В ходе оценки полученных лабораторных данных было выявлено, что препарат Цитовир®-3 в двух лекарственных формах (сироп и порошок для приготовления раствора) в рамках заявленных показаний к применению (профилактика и лечение гриппа и ОРВИ) оказывает положительное влияние на ряд показателей иммунологической реактивности организма.
Отмечено влияние на параметры врожденного клеточного иммунитета (прирост стимулированной окислительной ферментативной активности нейтрофильных гранулоцитов и увеличение количества фагоцитирующих моноцитов и нейтрофилов), это позволяет усилить врожденную иммунорезистентность организма к инфекционным агентам, что особенно важно в эпидемический период.
Выявленное повышение содержания sIgA в слюне на фоне приема препарата свидетельствует об усилении иммунореактивности организма и служит подтверждением наличия у исследуемого лекарственного средства профилактического действия.
Исследуемый препарат оказывает положительное влияние на выработку вирус-индуцированного ИФН-α и ИФН-β преимущественно у лиц с исходно низкими значениями данного показателя, что говорит о повышении функциональной активности ИФН-продуцирующих клеток и противовирусной активности препарата.
Длительный прием препарата в обеих лекарственных формах показал высокий уровень безопасности, так как ни один из исследованных параметров не имел значимых отклонений от нормы.
Исследование проведено при поддержке АО «Медико-биологический научно-производственный комплекс «Цитомед» и имеет статус официально одобренного и зарегистрированного в реестре Минздрава России.
Конфликт интересов
Левина А.В., Апрятина В.А. являются сотрудниками компании.
Участие авторов
Головачева Е.Г. — написание и редактирование текста публикации, утверждение и ответственность за окончательный вариант статьи.
Афанасьева О.И. — редактирование текста статьи.
Попова В.В. — проведение исследования.
Краснов А.А. — написание дизайна и проведение исследования, статистическая обработка клинических данных, редактирование статьи.
Левина А.В. — научное консультирование.
Апрятина В.А. — научное консультирование.
Петленко С.В. — написание дизайна исследования, экспертная оценка и контроль его выполнения, научное редактирование статьи.
.
Информация с rmj.ru





