Введение
Хроническая сердечная недостаточность широко распространена в клинической практике и представляет собой серьезную проблему для практического здравоохранения в Российской Федерации. Численность больных с ХСН различной степени выраженности составляет более 64 млн человек в мире [1]. В различных регионах РФ данный показатель варьирует в пределах 7–10% в общей популяции [2]. Увеличение числа новых случаев ХСН в последнее время является одним из ожидаемых последствий новой коронавирусной инфекции [3].
После постановки диагноза ХСН 5- и 10-летняя выживаемость пациентов составляет 50 и 10% соответственно [4]. Пациенты с ХСН с низкой фракцией выброса левого желудочка (ФВЛЖ) подвержены наиболее высокому риску смерти от сердечно-сосудистых заболеваний (CCЗ). Годичная смертность при ХСН в российской популяции составляет 6%, при клинически выраженной ХСН — 12% [5], однако по результатам исследования ЭПОХА-ХСН, полученным за 20-летний период наблюдения, смертность в течение года значительно выше и составляет 26–29% [6]. Внутрибольничная летальность среди госпитализированных пациентов с ХСН составляет 9%, смертность в течение 1 мес. после выписки — 13%, в течение года общая смертность составляет 43% [7]. Декомпенсация ХСН является причиной каждого второго случая госпитализации в кардиологическое отделение. Частота повторных госпитализаций в течение месяца и года после выписки из стационара составляет 31 и 63,4% соответственно [7].
В настоящее время в РФ регистрируется недостаточно эффективное ведение пациентов с ХСН на амбулаторном этапе. По результатам проведенного фармакоэпидемиологического анализа рутинной практики ведения пациентов с ХСН в РФ [8], тактика ведения пациентов не в полном объеме соответствует клиническим рекомендациям [5]. В части анализа структуры наблюдения показано, что при достаточном количестве визитов к врачу объем лабораторного и инструментального обследования недостаточен. Анализ медикаментозной терапии продемонстрировал ее неполное соответствие актуальным клиническим рекомендациям [8].
По данным проспективных российских регистров, в которые было включено 5126 пациентов, установлено, что ингибиторы ангиотензинпревращающего фермента (иАПФ) применялись лишь в 52,9% случаев, блокаторы рецепторов ангиотензина II (БРА) — в 21,1%, антагонисты минералокортикоидных рецепторов (АМКР) — в 17,4%, β-адреноблокаторы (БАБ) — в 52% [9–15].
Кроме того, сохраняется проблема низкой приверженности пациентов лечению, которая снижается с увеличением срока наблюдения. По данным регистра пациентов с хронической ишемической болезнью сердца (ИБС), являющейся одной из ведущих причин развития сердечной недостаточности (СН), препараты с доказанной клинической эффективностью (антиагреганты, статины, иАПФ, БРА, БАБ) при поступлении в кардиологический стационар принимали лишь 15% пациентов, при выписке — 69%. После выписки из стационара на амбулаторном этапе через 4 года уже 41% пациентов принимали данные препараты, а через 7 лет наблюдения — 35% [16].
Изучение частоты назначения препаратов, входящих в четырехкомпонентную схему лечения у пациентов с ХСН, было проведено в 2023 г. в шести регионах РФ (Свердловская, Челябинская, Тюменская, Кемеровская, Тульская области и Пермский край). В четырех из шести регионов оценка частоты назначения препаратов на основе схемы квадротерапии в регистрах ХСН была возможна только в общей группе больных с ХСН без разделения в зависимости от значений ФВЛЖ. По результатам проведенного анализа установлено, что иАПФ были назначены в 42–75% случаев, БАБ — в 62–95%, АМКР — в 57–92%, ангиотензиновых рецепторов и неприлизина ингибитор (АРНИ) — в 8–31%, ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ2) — в 9–27% случаев. Данные пациентов с различными значениями ФВЛЖ были представлены на примере Пермского края и Тюменской области. Продемонстрированы следующие результаты: в Тюменской области и Пермском крае почти все пациенты с СН со сниженной ФВЛЖ (СНнФВ) получали терапию ингибиторами ренин-ангиотензин-альдостероновой системы (РААС), при этом 43 и 47% пациентов с СНнФВ соответственно в Тюменской области и Пермском крае принимали АРНИ. В 45 и 38% случаев пациентам с СНнФВ в Тюменской области и Пермском крае соответственно был также рекомендован прием иНГЛТ2. Терапия препаратами БАБ и АМКР назначена подавляющему числу (85%) пациентов с СНнФВ. В итоге пациенты с СНнФВ в Пермском крае принимали сразу 4 базовых препарата для лечения ХСН в 38% случаев, в Тюменской области — в 43% случаев [17].
На фоне применения современных лекарственных препаратов и оказания высокотехнологичной медицинской помощи возможно значительное предотвращение прогрессирования и декомпенсации ХСН. Однако проблема несоответствия назначенного лечения принятым клиническим рекомендациям и низкая приверженность больных лечению на амбулаторном этапе способствуют снижению эффективности лечения данной группы больных.
Эффективная организация медицинской помощи пациентам с ХСН в РФ является приоритетной задачей здравоохранения. Назначение оптимальной медикаментозной терапии пациентам с ХСН, качественное диспансерное наблюдение (ДН) и использование современных цифровых технологий могут существенно снизить риск неблагоприятного исхода или госпитализации среди этой категории больных.
Программы лекарственного обеспечения больных с ССЗ повышают доступность фармацевтической помощи всем слоям населения, при этом льготное лекарственное обеспечение (ЛЛО) существенно повышает приверженность терапии [18].
Льготное лекарственное обеспечение осуществляется в рамках ДН пациентов с ХСН. В условиях существующих кадровых проблем — недостаточного количества врачей, среднего медицинского персонала, а также ограниченного времени, отведенного на врачебный прием, — нагрузка на медицинский персонал оказывается чрезмерной и затрудняет качественное выполнение ДН больных с ССЗ — одной из самых тяжелых категорий пациентов.
Для улучшения качества оказания медицинской помощи при ХСН перспективным ресурсом является применение современных информационных технологий, таких как сервисы поддержки принятия врачебных решений (СППВР), методы, основанные на применении искусственного интеллекта (ИИ), прежде всего технологий машинного обучения [19].
Целью настоящего обзора является анализ и обсуждение качества лекарственного обеспечения пациентов с хронической сердечной недостаточностью (ХСН), организации диспансерного наблюдения и перспектив использования цифровых технологий в лечении пациентов с ХСН.
Поиск статей для научного обзора проведен в базах данных PubMed, eLIBRARY. При поиске литературы использовались следующие ключевые слова: сердечная недостаточность, медикаментозная терапия, лекарственное обеспечение, программы обеспечения льготных категорий граждан незаменимыми лекарственными препаратами, федеральные льготники, диспансерное наблюдение, цифровые технологии, система поддержки принятия врачебных решений, искусственный интеллект, сердечно-сосудистые заболевания, heart failure, treatment, drug reimbursement, assurance program of supporting beneficiaries with indispensable drugs, free medication, federal beneficiaries, dispensary observations, artificial intelligence, medical decision support system, cardiovascular diseases.
Использованы источники, опубликованные с 2015 по 2023 г.
Диспансерное наблюдение больных с ХСН
Возможным ресурсом повышения продолжительности жизни, снижения смертности от болезней системы кровообращения является повышение качества ДН, что будет способствовать снижению числа обострений и прогрессирования заболеваний путем своевременной корректировки лечебно-диагностических мероприятий.
Согласно клиническим рекомендациям наблюдение в первичном звене оказания медицинской помощи рекомендуется осуществлять у стабильных пациентов с ХСН, получающих оптимальное лечение — для долгосрочного наблюдения и оценки эффективности лечения, прогрессирования заболевания и приверженности терапии [5].
В Российской Федерации ДН пациентов с ХСН регламентируется приказом Минздрава России от 15 марта 2022 г. № 168н «Об утверждении порядка проведения диспансерного наблюдения за взрослыми». Согласно приказу врачом-кардиологом осуществляется ДН пациентов с ХСН стадии 2–3Б, и/или с ФВЛЖ<40%, и/или III–IV функционального класса (ФК) по NYHA, а также с ХСН стадии 1–2А I–II ФК по NYHA и ФВЛЖ≥40% в сочетании с сахарным диабетом и/или хронической болезнью почек стадии 4 и 5. ДН терапевтом подлежат только пациенты с первично установленным клиническим диагнозом заболевания и имеющие ХСН I–III ФК, но не выше 2А стадии, которые не подлежат (не обеспечиваются) ДН врачом-специалистом по профилю вызвавшего ХСН заболевания, за исключением случаев отсутствия (недоступности) указанного врача-специалиста [20].
Вовлечение кардиологов в непосредственное осуществление ДН за пациентами с ХСН существенно повышает качество оказания медицинской помощи. При этом значительную проблему представляет кадровый дефицит кардиологов в амбулаторном звене. Согласно Порядку оказания медицинской помощи больным ССЗ на 1 кардиолога амбулаторного звена рекомендованная численность обслуживаемого населения составляет 20 тыс. человек1. По данным мониторинга Минздрава России, на 1 кардиолога в большинстве субъектов РФ приходится 30 и более тысяч обслуживаемого населения, причем кардиологи зачастую отсутствуют в поликлиниках населенных пунктов, удаленных от областных центров [21].
На сегодняшний день наиболее эффективным представляется комплексный подход к организации наблюдения за пациентами с ХСН в амбулаторных условиях — при участии кардиологов, терапевтов, врачей смежных специальностей и медсестер, с использованием современных цифровых технологий. Для повышения качества и эффективности ДН необходимы организация и контроль регулярных визитов пациента к врачу с целью мониторинга клинико-лабораторных параметров и оптимизации медикаментозного лечения.
В соответствии с порядком ДН пациентам с ХСН рекомендуется проведение рутинных анализов для оценки динамики состояния, исключения сопутствующей патологии, появившейся за время ДН, а также для исключения осложнений проводимого лечения. В перечень обследований входят: общетерапевтический биохимический анализ крови (с расчетом скорости клубочковой фильтрации), общий (клинический) анализ крови, определение уровня N-концевого пропептида натрийуретического гормона (B-типа) (не реже 1 раза в 2 года); электрокардиография (ЭКГ) (не реже 1 раза в год); рентгенография органов грудной клетки (не реже 1 раза в год); эхокардиография (ЭхоКГ) с определением ФВЛЖ (не реже 2 раз в год).
В рамках реализации мероприятий по мониторингу и анализу качества ДН, внедрения клинических рекомендаций в медицинских организациях в субъектах РФ в 2023 г. экспертами ФГБУ «НМИЦК им. акад. Е.И. Чазова» Минздрава России был проведен анализ эффективности ДН за пациентами, выписанными из региональных сосудистых центров и/или первичных сосудистых отделений после перенесенного инфаркта миокарда (ИМ), в том числе с сопутствующей ХСН с ФВЛЖ<40%. Анализ ДН показал недостаточное соответствие Порядку1 в части соблюдения диагностического алгоритма при ДН и своевременности постановки на ДН. Выполнение ЭКГ с рекомендованной частотой проводилось в среднем в 91% случаев, выполнение ЭхоКГ — в 73% случаев. Метод ультразвукового определения ФВЛЖ (по Симпсону) в ходе ДН применяется в 100% случаев только в 27% анализируемых субъектов. Широкое внедрение в амбулаторную практику ультразвуковой оценки сократимости ЛЖ по методу Симпсона является одной из важных задач программы совершенствования оказания помощи при ХСН. В настоящее время определение ФВЛЖ наиболее часто проводится по методу Тейхольца как менее трудоемкому. Данный метод менее точен и информативен, что приводит к искажению реальной распространенности СН в целом и различных ее фенотипов в частности [22].
У больных с ХСН первые 7–10 дней после выписки из стационара наиболее опасны развитием повторных случаев ухудшения состояния («уязвимый период») при недостаточном лечении. В этот период пациент должен находиться под наблюдением врача и принимать необходимые для лечения ХСН лекарственные средства. Однако проблема недостаточной врачебной преемственности на стационарном и амбулаторном этапах и низкая приверженность больных с ХСН лечению на амбулаторном этапе приводят к изменению подобранных в стационарах схем эффективной терапии СН. Соблюдение сроков постановки на ДН является важным условием его эффективности, так как обеспечивает непрерывность проводимого медикаментозного лечения. Анализ сроков постановки на ДН пациентов, подлежащих ЛЛО после выписки из стационара, по пока не опубликованным данным, показал соблюдение сроков (в течение трех рабочих дней) в 64% случаев. Сроки выдачи рецептов на лекарственные препараты после выписки из стационаров в регионах варьировали от 1 до 60 дней. В установленные сроки в регионах рецепты выдавались в среднем в 70% случаев. В 13% случаев рецепты выдавались в течение 3–9 рабочих дней и в 16% случаев — в течение 10 рабочих дней и более. Несвоевременная постановка на ДН может способствовать отсроченному получению льготных лекарственных препаратов данной категорией больных и увеличению «уязвимого периода». Важным аспектом является участие врача и среднего медицинского персонала в процессе обучения пациентов («школа ХСН»), в том числе с целью осуществления регулярных визитов к врачу в рамках ДН и повышения приверженности лечению.
Наблюдательное исследование QUALIFY, в котором приняли участие 6669 пациентов с ХСН и ФВЛЖ≤40%, свидетельствовало о приверженности лечению лишь каждого пятого (23%) пациента. Более высокая приверженность лечению чаще выявлялась при ХСН I ФК по NYHA у коморбидных больных при наличии фибрилляции предсердий, дислипидемии, артериальной гипертензии, хронической болезни почек и др. Более низкая приверженность чаще наблюдалась у лиц старческого возраста с более тяжелым течением ХСН. Было показано влияние низкой степени приверженности на общую смертность (отношение шансов (ОШ) 2,21), риск госпитализации (ОШ 2,6) и смертности (ОШ 1,32) в связи с ХСН, комбинированной госпитализации и смертности от ССЗ (ОШ 1,35) [23].
В исследовании, анализирующем базы данных здравоохранения в Швеции, Великобритании и США, приводятся сведения об отказе от дальнейшего приема иАПФ 55% пациентов, БРА — 33%, АРНИ — 27% [24].
В другом исследовании, оценивавшем приверженность лечению больных ХСН, выявлено, что общая приверженность оказалась существенно ниже, чем приверженность конкретным препаратам. Хуже всего пациенты принимали иАПФ (71%) и АМКР (77%), регистрировалась более высокая приверженность (86%) приему БАБ. Наиболее частым фактором неприверженности лечению является большое количество препаратов со сложной схемой их приема [25].
Ограниченные временные рамки амбулаторного приема терапевта и кардиолога не позволяют уместить в себя курс обучения больных с ХСН элементарным навыкам самоконтроля и самопомощи, затрудняют контроль базисной терапии ХСН с учетом множества клинических параметров, определяющих тактику ведения полиморбидного пациента, своевременное планирование высокотехнологичной медицинской помощи.
Совершенствование оказания медицинской помощи таким пациентам с налаженным взаимодействием между учреждениями всех уровней здравоохранения, рациональным использованием ресурсов первичного звена, с более активным включением среднего медицинского персонала на амбулаторном этапе могло бы позитивно отразиться на качестве лечения больных с ХСН.
В настоящее время в различных странах реализуются программы амбулаторного наблюдения за пациентами, предполагающие активное наблюдение лиц с ССЗ, прежде всего врачами общей практики и семейными врачами. Активное вовлечение пациентов, страдающих ХСН, в процесс амбулаторного наблюдения позволяет существенно улучшить прогноз их жизни. Так, по данным анализа программ амбулаторной медицинской помощи в Германии [26], вовлечение пациентов с ХСН в программу интенсивного амбулаторного наблюдения позволяет снизить у них смертность от всех причин и частоту повторных госпитализаций на 13,6%.
Содержание статьи
Меры по совершенствованию оказания помощи при ХСН в РФ
В 2020 г. коллективом авторов ФГБУ «НМИЦК им. акад. Е.И. Чазова» Минздрава России были предложены меры по совершенствованию оказания медицинской помощи при ХСН. Рекомендовано создание системы оказания специализированной медицинской помощи в рамках трехуровневой модели, в которой ведение пациентов согласовано между специалистами по СН во всех звеньях системы здравоохранения («бесшовная помощь»). Принципиальной задачей этой системы является неоставление таких пациентов без постоянного контроля со стороны специально подготовленных медицинских работников. После оказания специализированной медицинской помощи в медицинских организациях здравоохранения 3-го и 2-го уровня пациенты с ХСН должны постоянно наблюдаться в кабинетах ХСН. На амбулаторном этапе происходит основная ключевая работа по предотвращению госпитализаций, закрепляются достигнутые в стационаре успехи в лечении. Для решения проблемы низкой приверженности лечению предлагается активно привлекать к ведению пациентов с ХСН средний медицинский персонал, что достаточно успешно осуществляется во многих странах мира. Именно медицинские сестры могут мониторировать состояние пациентов (оценивать выраженность симптомов ХСН, приверженность лечению), проводить обучающие школы для пациентов, обозначая их личную роль и возможности управления своим заболеванием. Не меньшее значение имеет обучение пациентов с ХСН и их родственников основным навыкам контроля заболевания, знанию методов лечения, показаний к терапии, принципов дозирования и ожидаемых эффектов препаратов, а также возможных побочных эффектов, умению контролировать симптомы заболевания и своевременно распознавать начинающуюся декомпенсацию. Реализация комплекса мер по совершенствованию оказания медицинской помощи больным с ХСН в РФ продемонстрировала положительную динамику госпитализаций с острой декомпенсацией СН [17].
В настоящее время имеется тенденция к увеличению количества кабинетов ХСН в субъектах РФ. Увеличение количества пациентов, наблюдающихся в таких кабинетах, напрямую зависит от врачебной преемственности в стационарном и амбулаторном звеньях здравоохранения при осуществлении ДН и передаче информации о таких пациентах.
Важным аспектом амбулаторного наблюдения за пациентами с ХСН является возможность получения бесплатного лекарственного обеспечения. Снижение финансовых затрат со стороны пациента существенно повышает его приверженность лечению [27].
Льготное лекарственное обеспечение пациентов с ССЗ
В настоящее время для обеспечения качественного оказания медицинской помощи необходим комплексный подход, связывающий в одно целое организацию ДН и лекарственное обеспечение, включая льготную его часть. Доступность лечения ССЗ, обеспеченная постоянным применением эффективных лекарственных препаратов, является главным аргументом в пользу внедрения программы ЛЛО на амбулаторном этапе в рамках национального проекта «Здравоохранение» для категорий граждан, не имеющих социальной льготы в соответствии с Федеральным законом «О государственной социальной помощи» и обеспечивающихся лекарственными препаратами в соответствии с Федеральным законом от 17 июля 1999 г. № 178-ФЗ «О государственной социальной помощи».
С 2020 г. в Российской Федерации осуществляется бесплатное ЛЛО пациентов высокого сердечно-сосудистого риска на основании приказа Минздрава России от 9 января 2020 г. № 1н «Об утверждении перечня лекарственных препаратов для медицинского применения для обеспечения в течение одного года в амбулаторных условиях лиц, которые перенесли острое нарушение мозгового кровообращения, инфаркт миокарда, а также которым были выполнены аортокоронарное шунтирование, ангиопластика коронарных артерий со стентированием и катетерная абляция по поводу сердечно-сосудистых заболеваний». У пациентов высокого риска сердечно-сосудистых осложнений ЛЛО осуществляется в течение одного года после индексируемого события. Перечень лекарственных средств состоит из 23 наименований, имеющих наивысший уровень доказанности согласно клиническим рекомендациям. В 2022 г., в соответствии с приказом от 29 сентября 2022 г. № 639н, программа ЛЛО продолжила свое развитие, в перечень лекарственных средств были добавлены препараты для лечения сопутствующей ХСН — валсартан + сакубитрил, дапаглифлозин, эмпаглифлозин, ацетазоламид, дигоксин, ивабрадин, спиронолактон, фуросемид. С 2022 г. ЛЛО пациентов, перенесших острые сердечно-сосудистые события и оперативные вмешательства, осуществляется в течение двух лет с даты постановки диагноза и/или выполнения хирургического вмешательства.
В настоящее время согласно постановлению Правительства РФ от 26 декабря 2017 г. № 1640 «Об утверждении государственной программы Российской Федерации «Развитие здравоохранения» (с изменениями и дополнениями от 30.11.2023) в программу ЛЛО входят две категории пациентов:
а) лица, находящиеся под ДН, которые перенесли острое нарушение мозгового кровообращения или ИМ, а также которым выполнены аортокоронарное шунтирование, ангиопластика коронарных артерий со стентированием и катетерная абляция по поводу ССЗ;
б) лица, находящиеся под ДН, страдающие ИБС в сочетании с фибрилляцией предсердий и ХСН с подтвержденным ЭхоКГ в течение предшествующих 12 мес. значением ФВЛЖ 40%.
В перечень лекарственных препаратов входит 31 наименование (международное непатентованное название) лекарств, имеющих наивысший уровень доказанности, согласно клиническим рекомендациям для лечения больных, в том числе и с ХСН, в соответствии с приказом Минздрава России от 6 февраля 2024 г. № 37н «Об утверждении перечня лекарственных препаратов в целях обеспечения в амбулаторных условиях лекарственными препаратами лиц, находящихся под диспансерным наблюдением, которые перенесли острое нарушение мозгового кровообращения, инфаркт миокарда, страдающих ишемической болезнью сердца в сочетании с фибрилляцией предсердий и хронической сердечной недостаточностью с подтвержденным эхокардиографией в течение предшествующих 12 месяцев значением фракции выброса левого желудочка ≤40%, а также которым выполнены аортокоронарное шунтирование, ангиопластика коронарных артерий со стентированием и катетерная абляция по поводу сердечно-сосудистых заболеваний». Среди фенотипов СН только для ХСН с ФВЛЖ<40%, составляющей около половины всех случаев заболевания, существует лекарственная терапия, которая доказанно увеличивает выживаемость пациентов. Стратегия комбинированной терапии ренин-ангиотензин-альдостероновой системы и симпатической нервной системы с помощью иАПФ или БРА и АРНИ, БАБ и АМКР доказанно улучшает выживаемость, снижает риск госпитализаций по поводу СН и уменьшает симптомы у пациентов с СН и СНнФВ. Триада иАПФ/АРНИ, ББ и АМКР рекомендуется в качестве основной терапии для этих пациентов [28]. Также пациентам с СН и СНнФВ с сохраняющимися симптомами СН, несмотря на терапию иАПФ/АРА/валсартан+сакубитрил, БАБ и альдостерона антагонистами рекомендованы иНГЛТ2 [5] (дапаглифлозин и эмпаглифлозин), доказавшие свою эффективность в снижении риска сердечно-сосудистой смерти и госпитализаций по поводу СН, снижая комбинированную первичную конечную точку смерти от ССЗ или госпитализации при СН на 25% у пациентов с клинической картиной на уровне II–IV ФК (NYHA) и ФВЛЖ≤40% [28].
Такое комплексное комбинированное лечение ХСН основными классами препаратов — АРНИ, БАБ, АМКР и иНГЛТ2 — модифицирует течение этого заболевания, приводя к увеличению продолжительности жизни. Так, в перекрестном сравнительном анализе трех рандомизированных клинических исследований EMPHASIS-HF (n=2737), PARADIGM-HF (n=8399) и DAPA-HF (n=4744) совокупный эффект комплексной модифицирующей терапии пациентов с ХСН с СНнФВ составил 8,3 года прибавления жизни (у 55-летнего пациента), увеличив продолжительность жизни с 6,5 до 14,7 года [29].
Другие лекарственные препараты, применяемые при ХСН, при длительном приеме обеспечивают суммарное снижение риска смерти и потребности в стационарном лечении из-за декомпенсации СН, а также улучшают качество жизни пациентов. Таким образом, крайне важно четкое соблюдение клинических рекомендаций по применению именно комбинированной терапии у больных с ХСН, которое должно осуществляться в ходе ДН таких пациентов. Применение актуальной комбинированной терапии ХСН в настоящее время возможно в рамках ЛЛО в соответствии с приказом Минздрава России от 6 февраля 2024 г. № 37н.
Недостаточный охват пациентов ЛЛО может являться одной из причин несоблюдения клинических рекомендаций в амбулаторных условиях, отмеченного в российском исследовании ЭПОХА-Декомпенсация-ХСН, следствием которого стали высокая частота повторных госпитализаций и высокая смертность при ХСН [30].
Результаты анализа эффективности ЛЛО пациентов [31] показали, что годичная смертность пациентов, получавших бесплатно препараты (анализ 8578 событий с 1 января по 30 июня 2021 г., 4 субъекта РФ, население — 7 447 814 человек), составила 3,53%, тогда как у пациентов, не получавших по каким-либо субъективным причинам препараты, она составила 7,56% [31]. Анализ результатов эффективности программы ЛЛО показал снижение годичной смертности среди пациентов, находящихся на ДН и ЛЛО, практически в 2,1 раза в сравнении с пациентами, не получающими препараты по данной программе. Расширение программы ЛЛО на пациентов с ХСН позволит обеспечить дополнительное снижение показателей смертности от ССЗ и снизить потребность в стационарном лечении этой категории больных.
В развитых зарубежных странах системой организации лекарственного обеспечения при амбулаторном лечении предусмотрено частичное возмещение назначенных пациенту и выписанных врачом лекарственных средств. Помимо системы сооплаты существуют схемы мотивации, предназначенные не только для пациентов, но и для аптек. В экономически развитых странах на больного переносится лишь часть затрат на приобретение лекарственных средств, и, как правило, доля, оплачиваемая пациентом, меняется в зависимости от типа препарата: если лекарство предназначено для лечения хронических заболеваний или имеет жизненно важный терапевтический эффект, то доля соплатежа незначительна. Существуют различные варианты соплатежей, такие как фиксированная доплата на лекарственные средства, рецепт или упаковку, доплата определенного процента от стоимости лекарственных средств. Этот процент варьирует в зависимости от группы населения, причем социально уязвимые категории населения освобождены от соплатежей. Введение доплат мотивирует пациентов к применению более дешевых препаратов, в том числе и воспроизведенных лекарственных средств (дженериков).
В настоящее время в РФ реализуются базовые условия ЛЛО различных социальных групп населения (амбулаторная помощь) согласно приказу от 13 февраля 2013 г. № 66 «Об утверждении Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года и плана ее реализации» (см. таблицу).
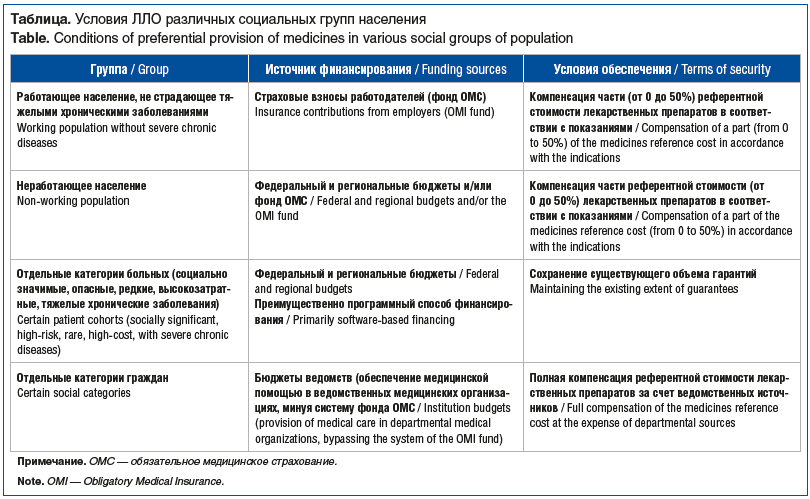
Таким образом, в настоящее время в РФ создана и продолжает свое развитие система обеспечения бесплатными лекарственными препаратами наиболее уязвимой группы пациентов с ХСН, включающая все необходимые препараты в соответствии с действующими клиническими рекомендациями. Данная система позволит повысить приверженность лечению, снизить частоту декомпенсации ХСН, госпитализаций и уровень смертности среди данной категории больных.
Информационные технологии в системе оказания медицинской помощи при ХСН
В целом ведение пациентов с ХСН является сложной многофакторной задачей, решение которой требует командной работы, персонифицированного подхода к алгоритмам диагностики, фармакологических и немедикаментозных вмешательств. Для улучшения качества оказания медицинской помощи при ХСН перспективно применение СППВР, ИИ, технологий машинного обучения [19]. Цифровые инструменты могут повысить качество, безопасность и эффективность системы здравоохранения, обеспечить дистанционный мониторинг пациентов, прогнозировать развитие болезней задолго до их появления и оптимизировать решения врачей, способствуя соблюдению ими актуальных клинических рекомендаций.
Системы поддержки принятия врачебных решений, интегрированные в медицинскую информационную систему, предоставляют врачам структурированную информацию и персонализированные рекомендации для ведения каждого пациента, делая доступным применение на практике клинических рекомендаций и повышая качество лечения. СППВР демонстрируют врачу данные о лекарственных взаимодействиях, о необходимых обследованиях и их частоте, о доступной для данного пациента терапии. Использование СППВР снижает частоту ошибок диагностики и лечения, обеспечивает врачу быстрый доступ к достоверной информации на рабочем месте, что повышает качество и скорость принятия правильных решений [32].
В исследовании влияния рекомендаций на выбор лечения BETTER CARE-HF (Building Electronic Tools to Enhance and Reinforce Cardiovascular Recommendations for Heart Failure) [33] продемонстрировано преимущество применения СППВР в практике ведения пациентов с ХСН и СНнФВ в 60 клиниках США (2200 пациентов). Стандартный подход сравнивали с дополнительным оповещением в медицинских информационных системах (МИС) во время посещения пациента и электронными сообщениями врачу с напоминанием об оптимальной терапии 1 раз в месяц. Было показано, что данная тактика увеличивала количество назначений АМКР в группе пациентов с дополнительным оповещением в МИС по сравнению с группой электронного сообщения более чем в 3 раза (24,6% против 5,8%; относительный риск (ОР) составил 3,76, 95% доверительный интервал (ДИ) 2,37–5,98, р<0,0001) [33].
В другом исследовании оценивалось влияние рекомендаций на выбор лечения PROMPT-AHF (Pragmatic trial of messaging to providers about treatment of Acute Heart Failure) среди 1012 пациентов, госпитализированных с острой СН и ХСН с СНнФВ. Рутинное лечение сравнивали с дополнительным оповещением в МИС о необходимости назначения терапии, соответствующей клиническим рекомендациям. Было показано, что на момент выписки из стационара в обеих группах назначение терапии, соответствующей клиническим рекомендациям, наблюдалось в 34% случаев (ОР 0,95, 95% ДИ 0,81–1,12, р=0,99) статистически значимые различия были получены только для назначений АМКР в группе пациентов с дополнительным оповещением в МИС по сравнению рутинной клинической практикой. Добавление АМКР или увеличение их дозы было на 41% чаще в группе оповещения (ОР 1,41, 95% ДИ 1,05–1,89, р=0,02) [34].
Основой эффективного лечения больных с ХСН является оптимальная и своевременно изменяемая при необходимости медикаментозная терапия. Подавляющее большинство пациентов нуждаются в одномоментном приеме большого количества лекарственных препаратов, более 50% больных СН при госпитализации в стационар одномоментно получают пять и более лекарственных препаратов, что значимо повышает риск нежелательных явлений, связанных как с фармакодинамическими показателями, так и с комплексными взаимодействиями лекарственных препаратов. Создание специализированного СППВР облегчит выбор эффективных лекарственных средств и снизит вероятность нежелательных лекарственных взаимодействий [35].
Особая роль в улучшении системы здравоохранения отводится ИИ. Действия в данном направлении на перспективу до 2030 г. были определены распоряжением Правительства РФ от 17 апреля 2024 г. № 959р, в котором утверждено стратегическое направление в области цифровой трансформации здравоохранения.
В основе использования ИИ в здравоохранении лежат алгоритмы машинного обучения, компьютерного зрения и глубокого обучения, с помощью которых возможно осуществлять автоматизированную диагностику, дистанционный мониторинг, персонифицировать выбор лекарственной терапии, определять стратегию лечения пациентов и снижать затраты на него.
В алгоритмах ИИ используются модели машинного обучения, с помощью которых проводится поиск и сбор медицинских данных, осуществляется получение информации и прогнозируются параметры заболеваний, осложнения и отдаленные последствия. Поскольку СН является многофакторным заболеванием, методы ИИ могут использоваться в оценке вероятности ее развития, в том числе с учетом генетической предрасположенности [36]. Также актуальна и ранняя диагностика ХСН с помощью ИИ. В настоящее время существующая клиническая практика приводит к диагностике заболевания после необратимого ремоделирования миокарда и функциональных нарушений. Было показано, что модели ИИ при использовании данных электронной медицинской карты могут прогнозировать развитие ХСН за два года до установки клинического диагноза, достигая 83% точности [37]. Создание и обучение нейронной сети, прогнозирующей модели персонализированного подхода к постановке диагноза путем выявления диагностических детерминант и выбору фармакотерапии у больных с ХСН, могут стать перспективным направлением развития клинической медицины [38].
Методы ИИ широко используются в программном обеспечении индивидуальных устройств (смарт-часы и фитнес-браслеты) и способствуют выявлению нарушений ритма сердца. Зарегистрированные с помощью индивидуальных устройств эпизоды аритмии указывают на целесообразность углубленного инструментального обследования, которое впоследствии в большинстве случаев подтверждает диагноз фибрилляции предсердий (ФП) [39, 40]. Другие дистанционные технологии и устройства также могут использоваться для мониторинга СН, начиная от измерения массы тела и артериального давления и заканчивая применением имплантированных устройств для многопараметрической оценки риска при ХСН. В одном из исследований технологии ИИ были применены среди пациентов с имплантированными устройствами — кардиовертерами-дефибрилляторами (ИКД). Модель ИИ использовала вариабельность сердечного ритма для предсказания возникновения желудочковой тахикардии, создав 10-секундную или 5-минутную систему оповещения для пациента, позволяя ему подготовиться к шоку при наличии ИКД [41].
Важным направлением использования методов ИИ в лечении больных с СН может стать повышение точности стратификации риска осложнений, прежде всего кардиоэмболических инсультов, особенно при сопутствующей ФП [42].
В одном из исследований изучались возможности ИИ на модели машинного обучения для определения феногрупп ХСН. На основании ретроспективного машинного анализа данных 1693 пациентов, госпитализированных в стационар с различной ФВЛЖ, было выделено 6 феногрупп, основанных на коморбидности (ИБС, пороки сердца, хроническая обструктивная болезнь сердца, ФП, апноэ сна). Примечательно, что выделение этих феногрупп не зависело от степени снижения ФВЛЖ, а определение риска смерти от всех причин, госпитализации, связанной с декомпенсацией ХСН, или смерти от сердечно-сосудистых осложнений, необходимости повторной госпитализации в течение 6 и 12 мес. было выполнено с большей точностью, чем стратификация только по ФВЛЖ [41].
Применение методов сбора и обработки информации на основе ИИ в лечении больных с ХСН имеет широкие перспективы, однако для их внедрения необходимы крупномасштабные популяционные исследования, целью которых будет подтверждение точности и эффективности предлагаемых методик. Существенными препятствиями развития данного направления могут оказаться: ограниченное наполнение МИС, межоператорские различия в субъективной оценке параметров, вносимых в МИС, и высокая стоимость методов, на основании которых производится сбор первичной информации [43].
Заключение
Распространенность СН в современной популяции продолжает расти. Оптимальная и своевременно скорректированная медикаментозная терапия является основой эффективного лечения больных с ХСН.
Отсутствие единых медицинских информационных систем и регистров больных с ХСН с возможностью проведения аналитической работы в большинстве регионов РФ не позволяет в полном объеме оценить качество медикаментозной терапии при СН. Оценка медикаментозной терапии у пациентов с ХСН в амбулаторных условиях показывает неполное соответствие лечения действующим клиническим рекомендациям.
Диспансерное наблюдение за больными с ХСН в РФ, осуществляемое в рамках действующих нормативно-правовых актов, нуждается в регулярном контроле не только частоты визитов, но и соответствия объемов проводимых лабораторных и инструментальных исследований действующим клиническим рекомендациям. Включение пациентов с ХСН в программу интенсивного амбулаторного наблюдения позволит улучшить прогноз жизни этой категории больных.
Разработка и внедрение в практическое здравоохранение методов анализа массивов цифровых данных, СППВР, машинного обучения на основе ИИ будут способствовать повышению качества оказания медицинской помощи пациентам с ХСН. Применение цифровых технологий на основе ИИ в лечении больных с ХСН имеет широкие перспективы, однако для их внедрения необходимы крупные популяционные исследования, целью которых будет подтверждение точности и эффективности предлагаемых методик.
Для улучшения качества оказания медицинской помощи необходимо обеспечение оптимальной медикаментозной терапией пациентов с ХСН, в том числе в рамках ЛЛО, осуществление качественного ДН и использование современных цифровых технологий. Все это поможет существенно снизить риск неблагоприятных исходов и госпитализаций среди данной категории больных.
Сведения об авторах:
Долгушева Юлия Александровна — к.м.н., научный сотрудник научно-организационного отдела ФГБУ «НМИЦК им. акад. Е.И. Чазова» Минздрава России; 121552, Россия, г. Москва, ул. Академика Чазова, д. 15; старший научный сотрудник научной лаборатории «Медицинская информатика» научно-исследовательского объединения ФГБОУ ВО «РЭУ им. Г.В. Плеханова»; 117997, Россия, г. Москва, Стремянный пер., д. 36; ORCID iD 0000-0002-9326-2071.
Ефремова Юлия Евгеньевна — к.м.н., старший научный сотрудник научно-организационного отдела ФГБУ «НМИЦК им. акад. Е.И. Чазова» Минздрава России; 121552, Россия, г. Москва, ул. Академика Чазова, д. 15; ORCID iD 0000-0001-8674-9669.
Горнякова Наталья Бадриевна — к.м.н., старший научный сотрудник научно-организационного отдела ФГБУ «НМИЦК им. акад. Е.И. Чазова» Минздрава России; 121552, Россия, г. Москва, ул. Академика Чазова, д. 15; ORCID iD 0000-0003-2382-8727.
Кудрина Валентина Григорьевна — д.м.н., профессор, главный научный сотрудник научно-исследовательского объединения ФГБОУ ВО «РЭУ им. Г.В. Плеханова»; 117997, Россия, г. Москва, Стремянный пер., д. 36; заведующая кафедрой медицинской статистики и цифрового здравоохранения ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-4329-1165.
Айрапетян Анна Артуровна — лаборант-исследователь лаборатории мониторинга программ по снижению смертности от сердечно-сосудистых заболеваний ФГБУ «НМИЦК им. акад. Е.И. Чазова» Минздрава России; 121552, Россия, г. Москва, ул. Академика Чазова, д. 15; ORCID iD 0000-0002-7064-5328.
Миронов Николай Юрьевич — к.м.н., старший научный сотрудник отдела клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца ФГБУ «НМИЦК им. акад. Е.И. Чазова» Минздрава России; 121552, Россия, г. Москва, ул. Академика Чазова, д. 15; старший научный сотрудник научной лаборатории «Медицинская информатика» ФГБОУ ВО «РЭУ им. Г.В. Плеханова»; 117997, Россия, г. Москва, Стремянный пер., д. 36; ORCID iD 0000-0002-6086-6784.
Богданова Валерия Олеговна — к.м.н., старший научный сотрудник научной лаборатории «Медицинская информатика» ФГБОУ ВО «РЭУ им. Г.В. Плеханова»; 117997, Россия, г. Москва, Стремянный пер., д. 36; врач клинический фармаколог ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России; 117292, Россия, г. Москва, ул. Дм. Ульянова, д. 11; ORCID iD 0000-0001-7762-7854.
Сорокин Евгений Владимирович — к.м.н., руководитель научно-организационного отдела ФГБУ «НМИЦК им. акад. Е.И. Чазова» Минздрава России; 121552, Россия, г. Москва, ул. Академика Чазова, д. 15; ORCID iD 0000-0001-8395-937X.
Контактная информация: Долгушева Юлия Александровна, e-mail: dol.85@mail.ru.
Прозрачность финансовой деятельности: исследование выполнено при финансовой поддержке РНФ (№ 23-75-30012).
Конфликт интересов отсутствует.
Статья поступила 10.06.2024.
Поступила после рецензирования 04.07.2024.
Принята в печать 29.07.2024.
About the authors:
Yulia A. Dolgusheva — C. Sc. (Med.), Researcher at the Research and Organizational Department, Acad. E.I. Chazov National Medical Research Center for Endocrinology; 15, Academician Chazov str., Moscow, 121552, Russian Federation; Senior Researcher of the «Medical Informatics» Laboratory of the Research Association, Plekhanov Russian University of Economics; 36, Stremyanny Lane, Moscow, 117997, Russian Federation; ORCID iD 0000-0002-9326-2071.
Yulia E. Efremova — C. Sc. (Med.), Senior Researcher at the Research and Organizational Department, Acad. E.I. Chazov National Medical Research Center for Endocrinology; 15, Academician Chazov str., Moscow, 121552, Russian Federation; ORCID iD 0000-0001-8674-9669.
Natalya B. Gornyakova — C. Sc. (Med.), Senior Researcher at the Research and Organizational Department, Acad. E.I. Chazov National Medical Research Center for Endocrinology; 15, Academician Chazov str., Moscow, 121552, Russian Federation; ORCID iD 0000-0003-2382-8727.
Valentina G. Kudrina — Dr. Sc. (Med.), Professor, Chief Researcher of the Research Association, Plekhanov Russian University of Economics; 36, Stremyanny Lane, Moscow, 117997, Russian Federation; Head of the Department of Medical Statistics and Digital Healthcare, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barricadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-4329-1165.
Anna A. Ayrapetyan — Research Assistant at the Laboratory for Monitoring Programs Reducing Mortality from Cardiovascular Diseases, Acad. E.I. Chazov National Medical Research Center for Endocrinology; 15, Academician Chazov str., Moscow, 121552, Russian Federation; ORCID iD 0000-0002-7064-5328.
Nikolay Yu. Mironov — C. Sc. (Med.), Senior Researcher of the Department of Clinical Electrophysiology and X-ray Surgical Methods for the Treatment of Cardiac Arrhythmias, Acad. E.I. Chazov National Medical Research Center for Endocrinology; 15, Academician Chazov str., Moscow, 121552, Russian Federation; Senior Researcher of the «Medical Informatics» Laboratory of the Research Association, Plekhanov Russian University of Economics; 36, Stremyanny Lane, Moscow, 117997, Russian Federation; ORCID iD 0000-0002-6086-6784.
Valeria O. Bogdanova — C. Sc. (Med.), Plekhanov Russian University of Economics; 36, Stremyanny Lane, Moscow, 117997, Russian Federation; Clinical Pharmacologist of the National Medical Research Center for Endocrinology; 11, Dm. Ulyanov str., Moscow, 117292, Russian Federation; Senior Researcher of the «Medical Informatics» Laboratory; ORCID iD 0000-0001-7762-7854.
Evgeny V. Sorokin — C. Sc. (Med.), Head of the Research and Organizational Department, Acad. E.I. Chazov National Medical Research Center for Endocrinology; 15, Academician Chazov str., Moscow, 121552, Russian Federation; ORCID iD 0000-0001-8395-937X.
Contact information: Yulia A. Dolgusheva, e-mail: dol.85@mail.ru.
Financial Disclosure: the research was conducted with financial support of the Russian Science Foundation (№ 23-75-30012).
There is no conflict of interest.
Received 10.06.2024.
Revised 04.07.2024.
Accepted 29.07.2024.
1Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 918н «Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями».
Информация с rmj.ru




