В настоящее время наблюдается увеличение распространенности цереброваскулярных заболеваний, существенно снижающих качество жизни и нередко приводящих к инвалидизации пациентов. Болезнь сосудов головного мозга мелкого калибра — это около 40% деменций в мире и пятая часть инсультов, которые случаются в течение года во всем мире. Структурное повреждение головного мозга, связанное с церебральной микроангиопатией (диффузное поражение белого вещества, множественные лакунарные инфаркты, микрокровоизлияния, вторичная церебральная атрофия), может длительное время оставаться клинически незаметным, но существенно увеличивать риск деменции и инвалидизирующих инсультов. Основным этиопатогенетическим фактором церебральной микроангиопатии является артериальная гипертензия, вызывающая артериосклероз мелких пенетрирующих артерий и артериол. Важнейшим инициирующим звеном этого процесса служит эндотелиальная дисфункция. Имеющиеся данные свидетельствуют об увеличении циркулирующих маркеров повреждения эндотелия у пациентов с церебральной микроангиопатией. Своевременная комплексная терапия — решающий фактор обратного развития эндотелиальной дисфункции и надежная профилактика цереброваскулярной болезни. Препарат Диваза, обладающий плеотропными эффектами, является патогенетически обоснованным адъювантным лекарством для лечения тревожно-депрессивных симптомов, ассоциированных с церебральной микроангиопатией.
Ключевые слова: цереброваскулярная болезнь, церебральная микроангиопатия, артериальная гипертензия, эндотелиальная дисфункция, Диваза.
Для цитирования: Воробьева О.В. Хроническая ишемия головного мозга: от патогенеза к терапии (рекомендации неврологу амбулаторного звена) // РМЖ. Медицинское обозрение. 2018. №5. С. 26-31
O.V. Vorobyeva
Sechenov University, Moscow
Currently, there is an increase in the prevalence of cerebrovascular diseases, which significantly decreases the quality of life and often leads to disability of patients. The disease of small cerebral vessels accounts for about 40% of dementias and one fifth of the strokes that occur throughout the year all over the world. Structural brain damage associated with cerebral microangiopathy (diffuse white matter lesion, multiple lacunar infarctions, microcirculation, secondary cerebral atrophy) can remain clinically invisible for a long time, but it significantly increases the risk of dementia and disabling strokes. The main etiopathogenetic factor of cerebral microangiopathy is arterial hypertension, which causes arteriosclerosis of small penetrating arteries and arterioles. The most important trigger of this process is endothelial dysfunction. The available data indicate an increase in the circulating markers of endothelial damage in patients with cerebral microangiopathy. Timely complex therapy is a decisive factor in the reverse development of endothelial dysfunction and reliable prevention of cerebrovascular disease. The preparation Divaza with a pleiotropic effect is a pathogenetically relevant adjuvant medication for the treatment of anxiety-depressive symptoms associated with cerebral microangiopathy.
Key words: cerebrovascular disease, cerebral microangiopathy, arterial hypertension, endothelial dysfunction, Divaza.
For citation: Vorobyeva O.V. Chronic cerebral ischemia: from pathogenesis to therapy (guidelines for an outpatient neurologist) //
RMJ. Medical Review. 2018. № 5. P. 26–31.
Представлены рекомендации неврологу амбулаторного звена по ведению пациентов с хронической ишемией головного мозга. Показано, что препарат Диваза, обладающий плеотропными эффектами, является патогенетически обоснованным адъювантным лекарством для лечения тревожно-депрессивных симптомов, ассоциированных с церебральной микроангиопатией.
В последние годы во всем мире наблюдается увеличение распространенности цереброваскулярных заболеваний, существенно снижающих качество жизни и нередко приводящих к инвалидизации пациентов. В структуре цереброваскулярной болезни ишемическое поражение мозга занимает доминирующее положение и представлено двумя основными синдромами: инфарктом мозга, связанным с патологией крупных экстра- и интракраниальных артерий или кардиогенными эмболиями, и церебральной микроангиопатией (поражение пенетрирующих артерий мелкого и среднего калибра — дисциркуляторная энцефалопатия). Церебральная микроангиопатия протекает менее драматично, чем острое нарушение мозгового кровообращения, но исподволь приводит к выраженным потерям в качестве жизни возрастной популяции людей. Болезнь сосудов головного мозга мелкого калибра — это около 40% деменций в мире [1] и пятая часть инсультов, которые случаются в течение года во всем мире [2]. Инсульты, ассоциированные с церебральной микроангиопатией (или лакунарные), не являются тяжелыми, и большинство пациентов выживают и физически остаются независимыми, но в 36% случаев в последующем имеют когнитивные нарушения той или иной степени [3]. Структурное повреждение головного мозга, связанное с церебральной микроангиопатией (диффузное поражение белого вещества, множественные лакунарные инфаркты, микрокровоизлияния, вторичная церебральная атрофия), может длительное время оставаться клинически незаметным, но существенно увеличивать риск деменции и инвалидизирующих инсультов [4]. Поэтому особое внимание уделяется вопросам лечения, предупреждения или замедления прогрессирования сосудистой патологии мозга и главное — улучшению качества жизни этой категории пациентов. В первую очередь качественное лечение связано с ранней диагностикой болезни мелких церебральных сосудов, что предполагает хорошее знание клиницистами начальных симптомов клинической манифестации заболевания.
Содержание статьи
Клиническая манифестация хронической ишемии головного мозга
Церебральная микроангиопатия проявляется комплексом неврологических и нейропсихологических нарушений. Полезно при оценке клинической картины ориентироваться на три кластера симптомов (табл. 1).
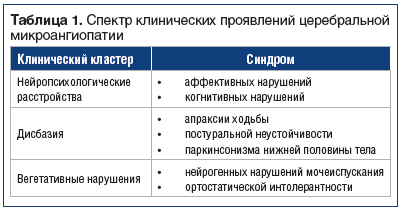
Клинициста должно настораживать наличие у пациента легкого когнитивного дефицита. Обычно это нарушение регуляторных когнитивных функций и внимания при полном сохранении бытовой независимости и профессиональных навыков. Сочетание нарушения концентрации внимания с легкими или умеренными симптомами тревожно-депрессивного свойства и едва заметными изменениями походки в виде замедления, укорочения шага, неустойчивости (жалобы на головокружение) могут свидетельствовать о клиническом дебюте сосудистой энцефалопатии. Эти симптомы могут быть показанием для проведения магнитно-резонансной томографии (МРТ) головного мозга, которая обычно не требуется в рутинной практике. МРТ помогает верифицировать различные варианты морфологических изменений, связанных с патологией мелких мозговых артерий, главные из которых — диффузное поражение белого вещества (лейкоэнцефалопатия), лакунарные инфаркты, микрокровоизлияния, вторичная церебральная атрофия.
Наиболее ранним клиническим маркером недостаточности церебральной перфузии являются тревожно-депрессивные расстройства, преимущественно астенического характера, за фасадом которых скрываются мягкие когнитивные нарушения. Тревожно-депрессивные симптомы, ассоциированные с церебральной микроангиопатией, часто описывают как трудно диагностируемые и трудно поддающиеся лечению. Трудности диагностики депрессии у пожилых в первую очередь связаны с особенностями клинической картины депрессии и преимущественным обращением этой категории больных к врачам общесоматического профиля, не имеющим навыков и опыта в оценке психического статуса.
Особенности клинической картины депрессии у пожилых пациентов:
превалирование соматических симптомов депрессии над психическими симптомами;
выраженное нарушение витальных функций, особенно сна;
маской психических симптомов депрессии могут быть тревога, раздражительность, ворчливость, которые окружающими часто рассматриваются как особенности пожилого возраста;
когнитивные симптомы депрессии часто оцениваются в рамках старческой забывчивости или начальных проявлений слабоумия;
значительные колебания симптоматики;
неполное соответствие критериям депрессивного эпизода (отдельные симптомы депрессии);
тесная связь между обострениями соматического заболевания и депрессии;
наличие общих симптомов депрессии и соматического заболевания.
Развернутая клиническая картина церебральной микроангиопатии характеризуется клинически значимым когнитивным снижением, соответствующим умеренному когнитивному расстройству. Дополнительно у больного могут отмечаться клинически значимая депрессия, умеренно выраженные лобная дисбазия или постуральная неустойчивость, четкие псевдобульбарные проявления в виде дизартрии и эмоциональной расторможенности. Повседневная активность может быть ограничена преимущественно за счет наиболее сложных, инструментальных ее видов.
Диагностика церебральной микроангиопатии
В первую очередь врачу не следует пренебрегать активной жалобой пациента на забывчивость. Необходимо проанализировать, как забывчивость пациента отражается на его ежедневном функционировании. Также важно получить объективное свидетельство родственников о чрезмерной забывчивости пациента в последнее время. Например, о том, что пациент не может запомнить новые имена, затрудняется при счете. Умеренные когнитивные нарушения характеризуются постоянной забывчивостью, утомляемостью при выполнении обычной умственной работы. Описанные нарушения вызывают у пациента затруднения, но не лишают его независимости. Такой пациент не может правильно организовать свою деятельность, быстро устает, часто допускает ошибки из-за невнимательности. При беседе с пациентом врач может заметить, что пациент затрудняется самостоятельно изложить анамнез, не понимает рекомендаций врача. Если такой пациент оказывается на приеме у врача с сопровождающим родственником, то при попытке ответить на вопрос врача он поворачивается к сопровождающему за поддержкой или подсказкой. Этот феномен получил название «симптом поворачивающейся головы». Множество неспецифических жалоб у пожилого пациента также должно настораживать клинициста, особенно если пациент не может объяснить их суть. Предположив когнитивный дефицит в анамнезе пациента, врач должен выявить и взвесить факторы риска сосудистых когнитивных нарушений: артериальную гипертензию неустановленной давности, наличие избыточного веса в прошлом, кардиальную патологию, нарушение гликемического контроля и др. Сосудистые когнитивные нарушения обязательно сопровождаются нарушениями со стороны неврологического статуса, в частности почти всегда нарушается походка. Нарушения походки легко может рассмотреть даже врач, не имеющий навыков неврологического осмотра. Походка у пациента становится замедленной, он испытывает трудности при начале ходьбы, поворотах, шаркает, возможны падения, активно жалуется на неустойчивость. В целом походка напоминает осторожную ходьбу.
Диагностический поиск при наличии когнитивных нарушений включает два основных этапа. На первом этапе осуществляется синдромальная диагностика.
Синдромальная диагностика выявляет снижение когнитивных способностей по сравнению с индивидуальной нормой и оценивает тяжесть когнитивных нарушений. Значительную помощь в синдромальной диагностике могут оказать нейропсихологические тесты. Простой в использовании тест Мини-Ког (Mini-Cog) применяется для скрининговой оценки когнитивной сферы. Наиболее чувствительной и специфичной к умеренным когнитивным нарушениям является Монреальская шкала оценки когнитивных функций (MoCa), включающая исследование различных когнитивных сфер: концентрации внимания, исполнительных функций, памяти, речи, зрительно-конструктивных навыков, абстрактного мышления, счета и ориентации.
На втором этапе диагностического поиска определяется наиболее вероятная причина когнитивных расстройств, т. е. осуществляется нозологическая диагностика. Для верификации сосудистой природы когнитивных нарушений большое значение имеют результаты нейровизуализации. В соответствии с современными требованиями диагноз сосудистых когнитивных расстройств не является правомерным при отсутствии нейровизуализационного подтверждения.
Дальнейшее прогрессирование заболевания у части больных может привести к развитию деменции с ограничением базовых видов повседневной активности и зависимостью от посторонней помощи. Прогрессирование двигательных нарушений (ходьбы и равновесия) часто приводит к падениям, которые в значительной степени ограничивают мобильность пациента. Бремя сосудистой деменции для пациента, его окружения и общества в целом является важным фактором, побуждающим врача к ранней диагностике и лечению церебральной микроангиопатии.
Патогенез церебральной микроангиопатии
Безусловным требованием адекватного лечения симптомов церебральной микроангиопатии является не только симптоматическая, но и патогенетическая терапия. Последнее должно мотивировать клинициста к пониманию основ патогенеза хронической ишемии мозга. Основным этиопатогенетическим фактором церебральной микроангиопатии является артериальная гипертензия, вызывающая артериосклероз (липогиалиноз, фибриноидный некроз или микроатероматоз) мелких пенетрирующих артерий и артериол. Эндотелиальная дисфункция (ЭД) — важнейшее инициирующее звено этого процесса [5]. Большинством экспертов нарушение свойств эндотелия рассматривается как основной механизм артериальной гипертензии. Сердечно-сосудистые факторы риска хронической ишемии мозга, такие как старение, гипергомоцистеинемия, постменопауза, курение, сахарный диабет, гиперхолестеринемия и гипертония, также могут инициировать или усугубить ЭД. В настоящее время нет специфических исследований, оценивающих связь между функциями периферического эндотелия и эндотелия церебральных сосудов. Однако имеющиеся данные показывают увеличение циркулирующих маркеров повреждения эндотелия у пациентов с церебральной микроангиопатией [5, 6]. Например, наше собственное исследование, включающее 262 пациента с васкулярными депрессивными симптомами, показало связь между уровнем биомаркеров эндотелиальной функции (эндотелин-1, С-реактивный белок, моноцитарный хемоаттрактантный протеин, циркулирующие десквамированные эндотелиоциты и фибриноген) и уровнем депрессии [7].
Сегодня уже совершенно понятно, что эндотелий — важный гомеостатический орган, контролирующий регуляцию сосудистого тонуса. Эндотелиальные клетки способны синтезировать широкий спектр антиатеросклеротических веществ, в частности оксид азота (NO), который вырабатывается в результате метаболизма L-аргинина под воздействием эндотелиальной NO-синтазы (eNOS), синтезируемой в эндотелиальных клетках. На ранних стадиях повреждения эндотелия возникают только функциональные обратимые изменения эндотелиальной функции, которые принято обозначать как «эндотелиальную дисфункцию».
Фундаментальным признаком ЭД является нарушение биодоступности NO и соответственно уменьшение сосудистой дилатации в ответ на эндотелиальные раздражители. Хотя точные механизмы нарушения биодоступности NO у пациентов, страдающих артериальной гипертензией, остаются неизвестными, наиболее вероятным считается нарушение L-аргининового пути синтеза NO. Помимо нарушения NO-связанной вазодилатации, снижение биодоступности NO приводит к усилению адгезии лейкоцитов, пролиферации клеток мышечной стенки сосуда, экспрессии молекул адгезии, а также адгезии и агрегации тромбоцитов [8]. Оксидативный стресс, при котором происходит накопление в крови большого количества активных форм кислорода (свободнорадикальных соединений), значительно стимулирует прогрессирование ЭД [9]. Даже при нормальном синтезе NO при выраженном окислительном стрессе происходит очень быстрая его инактивация.
Основное последствие нарушения эндотелийзависимой вазодилатации — это увеличение периферического сопротивления. Артериальная ригидность способствует увеличению импульсного давления, что является гемодинамическим стрессором для мозга, поскольку мозг имеет низкую резистентность к пульсовому ударному потоку. Ударное давление в первую очередь наносит ущерб сосудам головного мозга мелкого калибра. Нарушение функционирования пенетрирующих артерий и артериол приводит к расстройству механизмов ауторегуляции мозгового кровообращения и нарушению целостности гематоэнцефалического барьера [10]. Повышение проницаемости гематоэнцефалического барьера сопровождается экстравазацией компонентов плазмы как непосредственно в артериальную стенку (что способствует ее утолщению и дезинтеграции), так и в прилегающие области мозга с развитием периваскулярного отека (что может быть одним из механизмов поражения белого вещества), а также процессами асептического воспаления. Эти изменения — важный этап, предшествующий повреждению ткани мозга, включая инсульт (в первую очередь лакунарного подтипа). Ввиду более неблагоприятных условий кровоснабжения подкорковое и перивентрикулярное белое вещество полушарий головного мозга может страдать в большей степени, чем серое вещество мозга, этим обусловлена клиническая картина хронической ишемии мозга. В результате повреждения мелких сосудов головного мозга нарушается перфузия в лобных подкорковых областях мозга. В белом веществе появляются обширные зоны неполных инфарктов с демиелинизацией, утратой олигодендроцитов и аксонов. В последнее время накапливаются работы, показывающие связь артериальной ригидности и структурных изменений головного мозга: гиперинтенсивности белого вещества в Т2-режиме МРТ (лейкариоз), лакунарных инфарктов и атрофии коры головного мозга [11, 12].
Лечение пациентов с церебральной микроангиопатией
На ранних этапах церебральной микроангиопатии проводится лечение с учетом факторов риска, имеющее целью предотвратить или значительно замедлить прогрессирование заболевания, в т. ч. развитие острых состояний. Основные стратегии включают:
нормализацию артериального давления, углеводного и липидного обмена;
борьбу с курением, ожирением и гиподинамией;
ограничение употребления алкоголя, соли, животных жиров.
Для реализации этих мероприятий в первую очередь следует мотивировать пациента к соблюдению правильной диеты, богатой антиоксидантами, увеличению физической активности. Например, так называемая средиземноморская диета предупреждает когнитивные нарушения [13]. В экспериментальных исследованиях показано, что высокие дозы витаминов-антиоксидантов чрезвычайно эффективны для восстановления нормальной функции эндотелия, но интервенционные исследования с клиническим использованием этих веществ (витамины С и Е) не смогли убедительно подтвердить это [14]. Однако другие антиоксиданты, такие как флавоноиды, содержащиеся в красном вине и шоколаде, недавно продемонстрировали улучшение функции эндотелия в периферических крупных артериях [15]. Преимущества шоколада связаны с полифенолами, присутствующими в какао, которые повышают биодоступность NO и редуцируют ЭД.
В качестве гипотензивных препаратов наиболее обоснованным считается применение ингибиторов ангиотензинпревращающего фермента и антагонистов ангиотензиновых рецепторов, поскольку эти препараты повышают реактивность мелких церебральных сосудов, а также обладают антиоксидантной и антивоспалительной активностью [16]. При нарушении липидного обмена следует рассмотреть назначение статинов. Существуют убедительные доказательства в пользу того, что снижение уровня холестерина ЛПНП увеличивает показатель эндотелийзависимой вазодилатации [17]. Это связано с тем, что, помимо снижения уровня холестерина в крови, статины обладают холестеринонезависимым плейотропным эффектом, в основе которого лежит стабилизация сосудистой стенки.
Безусловно, система данных мероприятий оказывает положительный эффект на эндотелиальную функцию и систему NO, но не является оптимальной, что предполагает поиск более эффективных средств, воздействующих как на эндотелий, так и на клинические симптомы. Одним из препаратов с целевым воздействием на эндотелий является хорошо знакомый клиницистам препарат
Диваза, обладающий целым комплексом фармакологических эффектов. Доклинические исследования Дивазы были проведены в соответствии с национальными и международными рекомендациями в ведущих исследовательских центрах России и за рубежом.
Клинические исследования подтвердили снижение уровня маркеров ЭД на фоне приема Дивазы у больных с клиническими проявлениями церебральной микроангиопатии. Например, в открытом сравнительном исследовании под руководством О. В. Колоколова и соавт. (2016) было показано, что на фоне приема Дивазы статистически значимо снижались уровни основных маркеров ЭД (С-реактивного белка, моноцитарного хемоаттрактантного протеина-1, эндотелина-1 и др.), С-реактивный белок и моноцитарный хемоаттрактантный протеин-1 достигали нормальных значений. В группе же сравнения уровни маркеров не изменялись, а уровень эндотелина-1 даже статистически значимо повысился, что свидетельствует о прогрессировании патологического процесса [18]. Кроме того, Диваза оказывает позитивное влияние на показатели свертывающей системы крови — фибриногена и фактора Виллебранда [19].
Большие многоцентровые исследования показали успешность Дивазы в отношении начальных клинических симптомов церебральной микроангиопатии. Результаты подтвердили, что применение Дивазы приводит к улучшению показателей астении, когнитивных функций, сна, качества жизни и безопасно при лечении пациентов пожилого и старческого возраста с астеническими и когнитивными расстройствами [20]. Наличие тревожно-астенического симптомокомплекса следует рассматривать как основное показание для назначения Дивазы у пациентов с хронической ишемией головного мозга. С учетом времени регресса основных симптомов и повышения активности пациентов курсовое лечение Дивазой составляет 8–12 нед.
Заключение
Эндотелиальная дисфункция, ассоциированная с артериальной гипертензией, может рассматриваться как инициирующее патогенетическое звено развития церебральной микроангиопатии. На ранних стадиях повреждения эндотелия возникают обратимые функциональные изменения эндотелиальной функции, что является важным мотивационным фактором к ранней диагностике начальных клинических проявлений церебральной микроангиопатии и целевой терапии эндотелия. Успех лечения в каждом конкретном случае зависит от правильной коррекции индивидуальных факторов риска, в первую очередь оптимально подобранной гипотензивной терапии. Одним из препаратов с целевым воздействием на эндотелий является препарат Диваза, показавший в клинико-лабораторных исследованиях позитивное влияние на маркеры эндотелиальной дисфункции. Дополнительное включение Дивазы в комплексное лечение не только улучшает эндотелиальную функцию, но и позитивно влияет на аффективные и когнитивные симптомы.
Литература
1. Iadecola C. The pathobiology of vascular dementia // Neuron. 2013. Vol. 80. P.844–866.
2. Lozano R., Naghavi M., Foreman K. et al. Global and regional mortality fr om 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010 // Lancet. 2013. Vol. 380. P.2095–2128.
3. Makin S., Turpin S., Dennis M., Wardlaw J. Cognitive impairment after lacunar stroke: systematic review and meta-analysis of incidence, prevalence and comparison with other stroke sub-types // J Neurol Neurosurg Psychiatry. 2013. Vol. 84. P.893–900.
4. Valdes Hernandez M. C., Maconick L. C., Munoz Maniega S. et al. Acomparison of location of acute symptomatic versus ‘silent’small vessel lesions // Int J Stroke. 2015. Vol. 10. P.1044–1050.
5. Higashi Y., Kihara Y., Noma K. Endothelial dysfunction and hypertension in aging // Hypertension Research. 2012. Vol. 35. P.1039–1047.
6. Hassan A., Markus H. S. Genetics and ischaemicstroke // Brain. 2000. Vol. 123. P.1784–1812.
7. Fateeva V., Vorob’eva O. V. The correlation between endothelial dysfunction and depressive disorder in middle-aged patients with hypertension-associated microangiopathy. 4th European Stroke Organisation Conference (Gothenburg, Sweden 2018) AS23–028.
8. Taddei S., Ghiadoni L., Virdis A. et al. Mechanisms of endothelial dysfunction: clinical significance and preventive non-pharmacological therapeutic strategies // Curr Pharm Des. 2003. Vol. 9. P.2385–2402.
9. Heitzer Th., Schlinzig T., Krohn K. et al. Endothelial dysfunction, oxidative stress, and risk of cardiovascular events in patients with coronary artery disease // Circulation. 2001. Vol. 104. P.2673–2678.
10. Benarroch E. Neurovascular unit dysfunction // Neurology. 2007. Vol. 68. P. 1730–1732.
11. Kearney-Schwartz A., Rossignol P., Bracard S. et al. Vascular structure and function is correlated to cognitive performance and white matter hyperintensities in older hypertensive patients with subjective memory complaints // Stroke. 2009. Vol. 40. P.1229–1236.
12. Ohmine T., Miwa Y., Yao H. et al. Association between arterial stiffness and cerebral white matter lesions in community-dwelling elderly subjects // Hypertens Res. 2008. Vol. 31. P.75–81.
13. Shah R. The role of nutrition and diet in Alzheimer disease: A systematic review // J Am Med Dir Assoc. 2013. P. S1525.
14. Virdis A., Ghiadoni L., Salvetti G. et al. Endothelial dysfunction, vascular damage and clinical events: role of antioxidant therapy // High Blood Press Cardiovasc Prev. 2004. Vol. 11. P.15–27.
15. Grassi D., Necozione S., Lippi C. et al. Cocoa reduces blood pressure and insulin resistance and improves endothelium-dependent vasodilation in hypertensives // Hypertension. 2005. Vol. 46. P.398–405.
16. Bohm M. Angiotensin receptor blockers versus angiotensin-converting enzyme inhibitors: wh ere do we stand now? // Am J Cardiol. 2007. Vol. 100. P.38J– 44J.
17. Deanfield J. E., Halcox J. P., Rabelink T. J. Endothelial function and dysfunction: testing and clinical relevance // Circulation. 2007. Vol. 115. P.1285–1295.
18. Фатеева В. В., Колоколов О. В., Захарова Н. Б. и др. Нарушение сна и когнитивных функций как проявление хронической ишемии головного мозга и патогенетические основы их коррекции // Лечащий врач. 2016. № 5. С.1–6 [Fateyeva V.V., Kolokolov O. V., Zakharova N. B. i dr. Narusheniye sna i kognitivnykh funktsiy kak proyavleniye khronicheskoy ishemii golovnogo mozga i patogeneticheskiye osnovy ikh korrektsii // Lechashchiy vrach. 2016. № 5. S.1–6 (in Russian)].
19. Чуканова Е. И., Боголепова А. Н., Чуканова А. С. Опыт применения препарата диваза в терапии цереброваскулярной недостаточности // Журнал неврологии и психиатрии им. С. С. Корсакова. 2015. Т.115. № 6. С.110–114 [Chukanova Ye.I., Bogolepova A. N., Chukanova A. S. Opyt primeneniya preparata divaza v terapii tserebrovaskulyarnoy nedostatochnosti // Zhurnal nevrologii i psikhiatrii im. S. S. Korsakova. 2015. T.115. № 6. S.110–114 (in Russian)].
20. Парфенов В. А., Камчатнов П. Р., Воробьева О. В. и др. Результаты многоцентрового исследования эффективности и безопасности применения препарата диваза при астенических и легких или умеренных когнитивных расстройствах в пожилом и старческом возрасте // Журнал неврологии и психиатрии им. C. C. Корсакова. 2017. Т.117. № 9. С.43–50 [Parfenov V.A., Kamchatnov P. R., Vorob’yeva O.V. i dr. Rezul’taty mnogotsentrovogo issledovaniya effektivnosti i bezopasnosti primeneniya preparata divaza pri astenicheskikh i legkikh ili umerennykh kognitivnykh rasstroystvakh v pozhilom i starcheskom vozraste // Zhurnal nevrologii i psikhiatrii im. C. C. Korsakova. 2017. T.117. № 9. S.43–50 (in Russian)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru



