Введение
Синдром раздраженного кишечника (СРК) является самым часто встречаемым функциональным расстройством пищеварительного тракта с глобальной распространенностью от 7 до 21% [1]. В настоящее время СРК рассматривается как многофакторное заболевание, возникающее в результате комплексного взаимодействия множественной генетической изменчивости, условий окружающей среды и образа жизни [2]. Общепризнано, что наследственность играет важную роль в патогенезе заболевания, при этом СРК принято относить к сложным генетическим заболеваниям, которые имеют тенденцию накапливаться в семьях, но не таким предсказуемым образом, как классические менделевские расстройства [3]. Наследственный компонент удается установить у 33% пациентов [4]. Большинство ранних исследований, оценивающих семейную кластеризацию заболевания, были основаны преимущественно на сообщениях самих пациентов о том, что у другого члена семьи имеется СРК, а, как было показано, такая оценка достаточно субъективна и ее точность невысока [5]. В последующем для подтверждения роли генетики в развитии СРК был проведен ряд исследований типа «случай — контроль», в которых анализировались данные историй болезней непосредственно пациентов, лиц контрольной группы и их ближайших родственников. В частности, в исследовании Y.A. Saito et al. [6] с большим количеством участников (477 пациентов с СРК и 1492 родственника, 297 лиц группы контроля и 936 родственников) продемонстрировано, что 50% пациентов с СРК имеют по крайней мере еще одного больного родственника, и это оказалось в 2,75 (95% доверительный интервал (ДИ) 2,01–3,76) раза чаще, чем среди лиц группы контроля (p<0,05). При этом степень семейной агрегации не зависела от пола, возраста, однако эпизоды острой кишечной инфекции, жестокое обращение, депрессия или тревога были более распространены среди пациентов с СРК и их больных родственников по сравнению с группой контроля и здоровыми родственниками. В заключение авторы делают вывод о том, что у члена семьи пациента с СРК шансы также иметь заболевание в 2–3 раза выше, но при условии воздействия известных факторов риска.
Проведенное в Швеции общенациональное исследование, включающее более 50 000 случаев, аналогично показало повышенный риск развития СРК среди родственников пациентов первой, второй и третьей степени родства [7].
Концепцию СРК как комплексного заболевания с вовлечением факторов генетики и окружающей среды подтверждают и исследования с участием близнецов. На сегодняшний день было проведено не менее пяти таких исследований, по данным которых генетическая предрасположенность при СРК и других функциональных расстройствах кишечника колеблется в пределах 22–57% [8–12]. Во всех случаях, кроме одного, уровень конкордантности для монозиготных близнецов (генетически идентичных) был выше, чем уровень конкордантности для дизиготных близнецов, что подчеркивает важную роль генетики в патогенезе заболевания. Тем не менее I. Mohammed et al. [11] обнаружили одинаковые показатели конкордантности для монозиготных и дизиготных близнецов, предположив, что не генетическая предрасположенность, а воздействие внешних факторов в конечном итоге определяет риск развития заболевания. К сожалению, отсутствуют исследования близнецов, воспитанных отдельно друг от друга, которые позволили бы оценить влияние различных условий окружающей среды на генетически идентичных лиц.
В настоящее время изучено более сотни вариантов нуклеотидной последовательности более чем в 60 генах-кандидатах, предположительно ассоциированных с развитием СРК, включая гены, участвующие в активации иммунных клеток и инициации воспаления в слизистой оболочке толстой кишки, процессах центральной и периферической нейротрансмиссии, ноцицепции, синтезе желчных кислот, кишечной секреции и экспрессии белков плотных контактов [13].
Предполагается, что взаимодействие факторов генетики с факторами окружающей среды, такими как диета, перенесенная острая кишечная инфекция, стресс и психологическая травма, определяет формирование общего фенотипа СРК. При этом различные комбинации генетических вариантов и факторов окружающей среды, вероятно, могут объяснить клиническую гетерогенность заболевания. Очевидно, что существуют гены, ответственные за формирование диареи, и они отличаются от тех, которые определяют развитие запора или абдоминальной боли, необходимой для постановки диагноза СРК и исключающей другие функциональные расстройства кишечника, такие как функциональный запор и функциональная диарея. С учетом того, что СРК является многофакторным, полигенным заболеванием, изучение взаимодействия генов и факторов окружающей среды представляется крайне важным для последующей разработки эффективных методов лечения и профилактики заболевания.
Цель исследования: оценить влияние взаимодействия факторов генетики и эпигенетики на формирование и персистенцию симптомов СРК.
Материал и методы
Для достижения поставленной цели проведено открытое исследование методом поперечного среза с включением 263 пациентов (189 женщин, 74 мужчины, средний возраст 29 [25; 35] лет) с диагнозом СРК, установленным в соответствии с клиническими рекомендациями Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению СРК [14]. Протокол исследования одобрен локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России (протокол № 2 от 01.12.2021). Все участники подписывали информированное согласие на участие в исследовании.
Критериями невключения являлись любые органические заболевания пищеварительного тракта, других органов и систем, которые могут протекать с симптомами, характерными для СРК, а также тяжелое течение сопутствующих заболеваний, беременность или период лактации, психиатрические заболевания, отказ от участия.
Пациенты с СРК составили основную исследовательскую группу. В группу контроля вошли 40 здоровых лиц, по полу и возрасту сопоставимых с участниками основной группы.
В зависимости от характера нарушения кишечной моторики все пациенты с СРК были разделены на подгруппы: СРК с преобладанием диареи (СРК-Д) — 84 (31,9%) пациента, СРК с преобладанием запора (СРК-З) — 92 (34,8%), СРК со смешанным вариантом нарушения моторики (СРК-См) — 71 (26,9%), неклассифицируемый вариант СРК (СРК-Н) — 16 (6,4%). Ввиду малой выборки пациентов с СРК-Н и отсутствием специфических характеристик группы данные пациенты были объединены в одну группу с пациентами с СРК-См.
Степень тяжести СРК определялась по опроснику IBS-SSS путем оценки частоты и интенсивности абдоминальной боли и вздутия живота, удовлетворенности работой кишечника, а также влияния симптомов СРК на повседневную активность пациента [15]. При итоговой сумме баллов от 75 до 175 течение СРК расценивалось как легкое, от 175 до 300 — как среднетяжелое, более 300 — как тяжелое. Среди включенных в исследование легкое течение заболевания отмечалось у 110 (41,9%) пациентов, среднетяжелое — у 99 (37,6%), тяжелое — у 54 (20,5%).
Структура рациона среди включенных в исследование изучалась по опроснику WHO CINDI program questionnaire, пищевые предпочтения и доступность различных продуктов питания — по опроснику «Информация о питании и пищевом поведении», разработанному на кафедре гигиены питания человека ФГБОУ ВО ОмГМУ Минздрава России [16].
Для анализа распространенности и выраженности тревоги и депрессии использовалась госпитальная шкала тревоги и депрессии (HADS), состоящая из двух подшкал — HADS-A и HADS-D для тревоги и депрессии соответственно, с суммой баллов по каждой от 0 до 21 [17]. При итоговой сумме баллов ≥11 по любой из подшкал диагностировалась клинически значимая тревога или депрессия. Проводилась также оценка индекса висцеральной чувствительности VSI (Visceral Sensitivity Index), который отражает уровень специфической гастроинтестинальной тревоги с учетом когнитивных, эмоциональных и поведенческих реакций в ответ на такие симптомы, как абдоминальная боль, нарушения стула, метеоризм и вздутие живота [18]. Итоговая сумма баллов по опроснику VSI колеблется от 0 до 75, бóльшая сумма указывает на более выраженную тревогу, связанную с гастроинтестинальными симптомами. Качество жизни оценивалось по данным опросника IBS-QoL (Irritable Bowel Syndrome Quality of Life) в баллах от 0 до 100, при этом меньшее число соответствовало более низкому качеству жизни [19].
Дополнительно всем лицам основной группы и группы контроля на базе ЦНИЛ ФГБОУ ВО ОмГМУ Минздрава России (заведующий — к.м.н., доцент Д.Г. Новиков) проводилось лабораторное исследование по определению следующих вариантов нуклеотидной последовательности: rs4680 (катехол-О-метилтрансферазы Val158Met) гена COMT («Литех», Россия), играющего ключевую роль в деградации катехоламинов, 5-HTTLPR гена SLC6A4 («Синтол», Россия), кодирующего синтез транспортера обратного захвата серотонина (SERT), rs4988235 (C-13910 T) гена LCT («Литех», Россия), ответственного за риск лактазной недостаточности, rs6277 (С-957 T) гена DRD2 («Литех», Россия), регулирующего экспрессию рецептора дофамина 2-го типа, — методом полимеразной цепной реакции (ПЦР) в режиме реального времени, а также rs9939609 гена FTO («Литех», Россия), ассоциированного с жировой массой и ожирением, и rs5743836 (C-1237T>C ) гена TLR9 («Литех», Россия), опосредующего иммунный ответ на бактериальные антигены, — методом ПЦР с детекцией продуктов в электрофоретическом геле.
Кроме того, всем включенным в исследование проводилась оценка уровня кортизола в утренней и вечерней порциях слюны, серотонина в сыворотке крови, дофамина в плазме крови и зонулина в кале методом иммуноферментного анализа с помощью тест-систем Cortisol Saliva ELISA (Diagnostics Biochem Canada Inc, Канада), Serotonin ELISA (IBL, Германия), Dopamine ELISA (IBL, Германия) и IDK Zonulin ELISA (Immundiagnostik, Германия) соответственно.
Статистический анализ полученных данных проведен с использованием пакетов прикладных программ Microsoft Excel и Statistica v.6.1 (русифицированная версия). В связи с наличием распределения, отличного от нормального, для всех количественных признаков описательная статистика представлена в виде медианы (Ме), 25-го и 75-го процентилей (Р25 и Р75 соответственно). Для сравнения двух независимых групп использовали критерий Манна — Уитни (U), трех и более групп — критерий Краскела — Уоллиса (Н). Для анализа качественных данных (номинальных, порядковых, ранговых) и анализа частот использовали критерий сопряженности χ2 Пирсона. Результаты считались статистически значимыми при p<0,05.
Результаты и обсуждение
При анализе полученных результатов по частоте встречаемости генотипов изучаемых генов между пациентами с СРК и лицами группы контроля статистически значимые различия получены для гена COMT и гена DRD2 (табл. 1). Так, среди пациентов с СРК статистически значимо чаще встречались гомозиготы по аллелям val (41,8%) и met (31,9%), тогда как среди здоровых лиц — гетерозиготы val/met (50,0%). Полученные нами результаты согласуются с имеющимися данными о том, что генотипы val/val и met/met являются генотипами высокого риска в отношении СРК, тогда как генотип val/met ассоциирован с низким риском развития СРК [20].
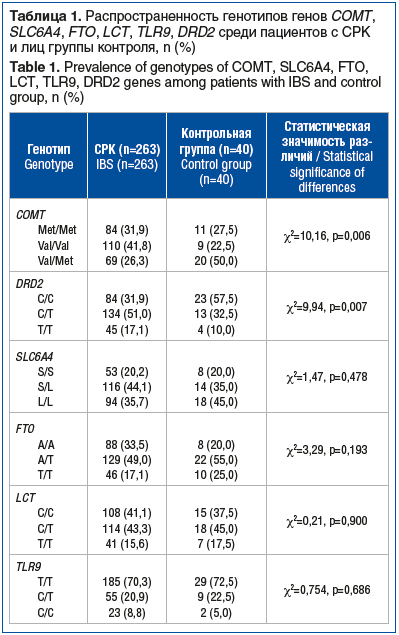
Известно, что ген COMT, кодирующий синтез фермента катехол-О-метилтрансферазы, играет ключевую роль в деградации катехоламинов (дофамина, норадреналина и адреналина) в пресинаптической щели. Распространенным вариантом нуклеотидной последовательности гена COMT, расположенного на хромосоме 22q11.2, является val158met (rs4680), который вызывает замену валина (val) на метионин (met) и отвечает за изменение функции фермента. Генотип val/val приводит к повышению активности фермента СОМТ в 3–4 раза по сравнению с генотипом met/met, а генотип val/met проявляет промежуточную активность [21–23].
Поскольку биологические эффекты дофамина зависят также от плотности и активности специфических рецепторов, с которыми он связывается, среди генов-кандидатов, ассоциированных с развитием СРК, нами был изучен вариант нуклеотидной последовательности rs6277 (c.957C>T) гена DRD2, кодирующего экспрессию рецепторов D2 на нейронах. В проведенном нами исследовании получены статистически значимые различия по частоте встречаемости генотипов указанного гена между пациентами с СРК и здоровыми лицами (χ2=9,94, p=0,007). В частности, в группе пациентов с СРК чаще встречались носители гетерозиготного генотипа C/Т (51,0%), а в группе контроля — гомозиготного генотипа С/С (57,5%). Вместе с тем показано, что лица с гомозиготным генотипом С/С, ассоциированным с более высокой плотностью D2-рецепторов, характеризуются более эффективным связыванием дофамина [24, 25], в то время как наличие аллели Т связано со снижением трансляции матричной РНК и снижением синтеза белка до 50% во всех участках полосатого тела (комплекс подкорковых базальных ганглиев, входящих в экстрапирамидную систему головного мозга) [26, 27]. В нашем исследовании носители аллели Т встречались среди 68,1 (179 из 263) % пациентов с СРК по сравнению с 42,5 (17 из 40) % лиц в группе контроля.
При анализе распространенности различных генотипов изучаемых генов среди пациентов с СРК в зависимости от подтипа заболевания обнаружены статистически значимые различия для генов COMT, DRD2 и SLC6A4 (табл. 2).
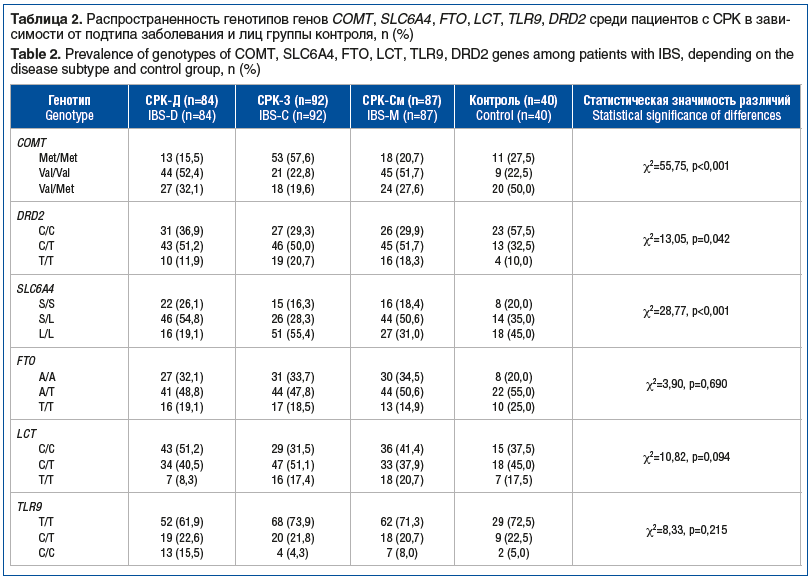
В проведенном нами исследовании среди пациентов с СРК-Д и СРК-См преобладал генотип val/val гена COMT, а среди пациентов с СРК-З — генотип met/met. Имеющиеся в литературе сведения демонстрируют аналогичные результаты. К примеру, в исследовании P. Karling et al. [20] среди пациентов с СРК у носителей генотипа val/val наблюдалось значительное увеличение частоты стула (2,6 раза против 1,8 раза в день; χ2=5,3, p=0,03) по сравнению с носителями генотипов val/met и met/met. Интересными представляются данные о том, что генотип val/val гена COMT не только статистически значимо связан с развитием СРК-Д, но и предрасполагает к рефрактерному течению заболевания у женщин, тогда как генотип met/met, напротив, повышает вероятность развития рефрактерного СРК-З [28].
Кроме того, в проведенном нами исследовании достоверные различия между пациентами с СРК в зависимости от подтипа заболевания были выявлены по распространенности генотипов гена DRD2 (χ2=13,05, p=0,042). Генотип T/T со сниженной плотностью рецепторов в головном мозге встречался у 19 (20,7%) пациентов с СРК-З, у 16 (18,3%) — с СРК-См, у 10 (11,9%) — с СРК-Д, тогда как генотип С/С с высокой плотностью рецепторов выявили у 31 (36,9%) пациента с СРК-Д, у 26 (29,9%) — с СРК-См, у 27 (29,3%) — с СРК-З. Таким образом, носители аллели Т чаще (70,7% случаев) встречались среди пациентов с преобладанием запоров. Недавние исследования показали, что нисходящие пути торможения боли, опосредованные действием дофамина, контролируют не только ноцицепцию, но и рефлекс дефекации. В частности, в эксперименте интратекальное введение дофамина на уровне L6–S1, где расположен пояснично-крестцовый центр дефекации, вызывало пропульсивные сокращения толстой кишки через D2-подобные дофаминовые рецепторы [29].
При анализе частот распространенности генотипов гена SLC6A4, кодирующего синтез транспортера обратного захвата серотонина (SERT), нами установлено, что среди пациентов с СРК-Д наиболее часто встречаются носители генотипов S/S и S/L, а среди пациентов с СРК-З — генотипа L/L. Полиморфизм в промоторной области гена, кодирующего SERT, представлен длинной (L) и короткой (S) аллелями, где присутствие длинной аллели обеспечивает более высокий уровень экспрессии гена и бóльшую интенсивность метаболизма серотонина, а наличие короткой аллели связано со снижением обратного захвата серотонина [30, 31]. В ряде работ также обнаружена ассоциация между генотипом S/S варианта нуклеотидной последовательности гена SERT и СРК-Д, которую объясняли пониженной скоростью поглощения серотонина, а следовательно, более продолжительной персистенцией серотонина, усилением нейронной стимуляции и двигательной функции кишечника [32–34]. Вместе с тем необходимо отметить некоторую разнородность данных, полученных в различных этнических группах. Так, в метаанализе 25 клинических исследований, проведенных в Восточной Азии, отмечен наибольший риск развития СРК-З у лиц с генотипом L/L и отсутствие корреляции варианта нуклеотидной последовательности SLC6A4 с другими подтипами СРК [35]. Напротив, в исследованиях, проведенных в Юго-Восточном Иране и Северной Индии, фенотип СРК-З значительно чаще встречался у пациентов с генотипами S/S и L/S гена SLC6A4 по сравнению с СРК-Д и СРК-См [36, 37].
Закономерно, что среди пациентов с СРК, включенных в наше исследование, носители разных генотипов гена SLC6A4 имели статистически значимо бóльшую частоту стула за последнюю неделю (Н=45,63, p<0,001). Так, среди носителей генотипа S/S средняя частота стула 12 [4; 18] раз в неделю, S/L — 9 [4; 17] раз в неделю, L/L — 3 [2; 5] раза в неделю. При попарном сравнении различия сохранялись между носителями генотипов S/S и L/L (U=70,09, p<0,001), а также S/L и L/L (U=63,67, p<0,001), при этом показатели частоты стула за последнюю неделю у лиц с генотипами S/S и S/L были сопоставимы (U=6,43, p=0,092). Данный факт подтверждает предположение о том, что именно мутантная аллель S связана со склонностью к диарее.
При анализе распространенности различных генотипов изучаемых генов среди пациентов с СРК в зависимости от степени тяжести заболевания достоверные различия получены для генов COMT и DRD2 (табл. 3). Так, среди пациентов с тяжелым течением заболевания число лиц с промежуточной активностью фермента (генотип val/met) было наименьшим, тогда как подавляющее большинство имели генотип val/val с высокой активностью фермента. Примечательно, что наличие генотипа met/met гена COMT было ассоциировано с наличием запоров (χ2=16,09, p<0,001), выраженной абдоминальной боли (χ2=11,04, p=0,004), генотипа val/val — с диареей (χ2=53,39, p<0,001).
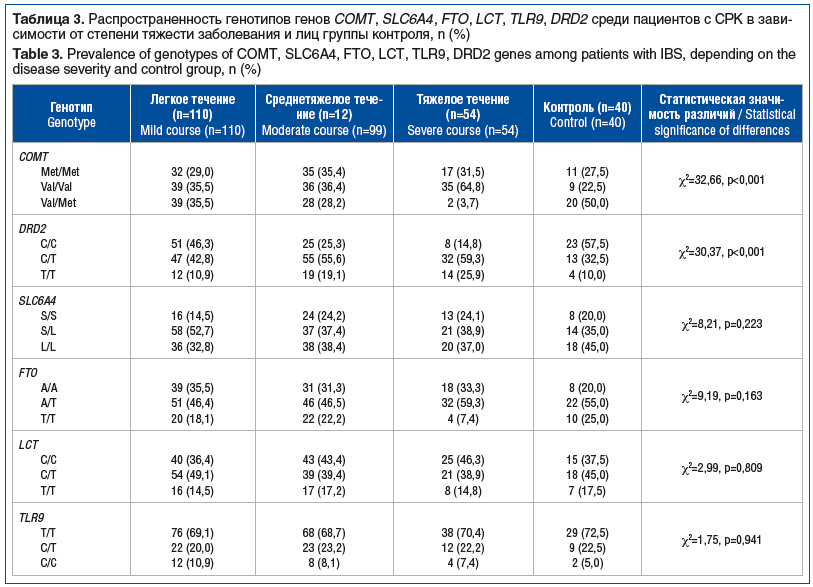
Установлено, что варианты нуклеотидной последовательности в гене COMT могут влиять на уровни катехоламинов и энкефалинов, которые связаны с регуляцией систем модуляции висцеральной боли [38]. Низкая активность фермента COMT (генотип met/met) приводит к более высокому уровню дофамина в синапсе и хронической активации дофаминергических нейронов, а следовательно, к более низкому содержанию энкефалина в нейронах и снижению уровня активности эндогенной системы торможения боли. Экспериментально показано, что инфузия гипертонического солевого раствора в жевательную мышцу у лиц с генотипом met/met приводит к снижению активности регионарных μ-опиоидных рецепторов и более высокой сенсорной оценке боли в ответ на раздражитель по сравнению с лицами, имеющими генотип val/val [21]. В ряде исследований низкая активность COMT была связана с такими хроническими болевыми состояниями, как лицевая боль [39], фибромиалгия [40], немигренозная головная боль [41]. Кроме того, по данным функциональной магнитно-резонансной томографии у носителей аллели met отмечается повышенная активация миндалины и гиппокампа после воздействия неприятных эмоциональных визуальных стимулов [42, 43]. Предполагается, что COMT-опосредованное изменение содержания дофамина в лимбических областях приводит к усилению возбуждения и преувеличенным аффективным реакциям на стрессоры окружающей среды [44].
В проведенном нами исследовании в группе пациентов с СРК обнаружены значимые различия по содержанию дофамина в зависимости от выявленного генотипа гена COMT (Н=21,07, p<0,001). При этом самое низкое содержание дофамина в плазме было отмечено у носителей гомозигот met/met — 23,74 [17,92; 32,56] нг/мл по сравнению с носителями val/val и val/met — 36,55 [25,76; 48,72] и 29,76 [21,04; 42,39] нг/мл соответственно. Полученные данные подчеркивают сложность дофаминергической передачи в центральной нервной системе и на периферии у пациентов исследуемой когорты. Хорошо известно, что для метаболизма дофамина принципиально важны два момента: пресинаптический синтез и постсинаптическая инактивация, последняя осуществляется либо путем обратного захвата в пресинаптические везикулы, либо посредством метилирования ферментом COMT [45]. Метилирование ферментом COMT по сути является единственным методом деградации дофамина в префронтальной коре — области мозга, отвечающей за формирование поведенческих реакций и входящей в так называемую мозговую модель «матрицы боли», которая, как было показано, активируется в ответ на колоректальную стимуляцию у больных с СРК [46]. Под влиянием физиологического или психологического стресса концентрация дофамина в синапсах увеличивается, что усиливает активность мозга, и если уровень дофамина оказывается избыточным (при низкой активности COMT), то развивается функциональный сбой в работе ней-ронов, что ведет к формированию боли и связанных с ней психологических расстройств.
Кроме того, в проведенном нами исследовании среди пациентов с тяжелым течением СРК значимо чаще встречались носители гомозиготного по аллели Т генотипа гена DRD2 — 25,9%, по сравнению с 19,1 и 10,9% при среднетяжелом и легком течении соответственно (χ2=30,37, p<0,001). Закономерно, что у гомозиготных носителей генотипа Т/Т отмечались более выраженные симптомы заболевания, в частности абдоминальная боль (χ2=42,84, p<0,001). Скорее всего, это связано с тем, что сниженная плотность DRD2 в головном мозге опосредует нарушение проведения сигналов нисходящей системы торможения боли и процессов эмоциональной обработки боли [47].
Генотип S/S гена SLC6A4 оказался связан с абдоминальной болью (χ2=9,15, p=0,029) и диареей (χ2=39,98, p<0,001), генотип L/L — с запорами (χ2=12,4, p=0,002). Вместе с тем среди лиц с генотипом S/S отмечался более высокий уровень серотонина в сыворотке крови по сравнению с другими генотипами (Н=68,74, р=0,000). У лиц с генотипом S/S среднее содержание серотонина составило 230,32 [209,7; 322,11] нг/мл, у лиц с генотипом S/L — 198,4 [146,85; 241,53] нг/мл, у лиц с генотипом L/L — 157,8 [115,56; 200,16] нг/мл. Ассоциация генотипа S/S с повышенным содержанием серотонина в сыворотке крови, выраженной абдоминальной болью и тревогой, установлена и в ряде других работ [34, 48]. S. Fukudo et al. [49] обнаружили у носителей гомозиготного генотипа по короткой аллели S повышенную висцеральную чувствительность в ответ на колоректальное растяжение. Имеются и другие данные, когда пациенты с СРК, имеющие генотип S/L гена SLC6A4, сообщали о значительно более высоких уровнях абдоминальной боли, чем пациенты с СРК — гомозиготные по аллелям S или L [50, 51], однако механизм этой связи остается неясным. Вместе с тем, как отмечалось ранее, аллель S гена SLC6A4, снижая транскрипционную активность SERT, препятствует обратному захвату серотонина из синапса, в результате чего избыток нейромедиатора способствует повышенной стимуляции ноцицептивных рецепторов и усилению болевых ощущений [52].
Хорошо известно, что для реализации генетической предрасположенности требуется действие факторов эпигенетики, с этой целью мы провели анализ ассоциативных взаимосвязей между генотипами изучаемых генов и характером питания, уровнем тревоги и депрессии, а также наличием острой кишечной инфекции в анамнезе.
Наличие генотипа met/met гена COMT было ассоциировано с признаками депрессии по подшкале HADS-D (χ2=13,12, p=0,001) и показателем индекса висцеральной гиперчувствительности по опроснику VSI (χ2=16,49, p=0,018), наличие генотипа val/val — с более высокими баллами тревоги по подшкале HADS-A (χ2=20,01, p<0,001), в том числе специфической гастроинтестинальной тревоги (χ2=24,82, p<0,001). В проведенных ранее исследованиях генотип val/val был связан с тревожностью у европеоидных женщин [20, 53] и снижением способности испытывать радость в ответ на вознаграждение [54]. Поскольку тревога и отрицательные эмоции усиливают передачу ноцицептивных сигналов из пищеварительного тракта [55, 56], можно сделать предположение о том, что генотип val/val приводит к аномальному восприятию физиологических событий в кишечнике и формированию специфической тревоги по поводу наличия гастроинтестинальных симптомов.
Было высказано предположение, что ген COMT влияет на риск аффективных расстройств в зависимости от вида стрессора окружающей среды и степени его воздействия [44], поскольку обе аллели, met и val, были связаны с депрессией [57–59], в других работах [60, 61] такая связь отсутствовала. Установлено, что ген COMT тесно связан с активацией оси «гипоталамус — гипофиз — надпочечники» и повышенным высвобождением гормона стресса кортизола в ответ на физические и психологические стрессоры, а следовательно, определяет уязвимость к стрессу, а также влияет на риск развития тревоги [62, 63]. В проведенном нами исследовании статистически значимые различия получены среди пациентов с СРК с различными генотипами гена COMT по уровню кортизола в утренней (Н=6,085, р=0,048) и вечерней (Н=18,42, p<0,001) порциях слюны. Так, средний уровень утреннего (базального) кортизола в слюне у пациентов с генотипом met/met составил 32,22 [25,5; 49,05] нг/мл, с генотипом val/val — 50,28 [26,15; 79,62] нг/мл, с генотипом val/met — 39,2 [26,10; 67,6] нг/мл. Средний уровень вечернего кортизола в слюне у пациентов с генотипом met/met составил 16,45 [11,43; 21,34] нг/мл, с генотипом val/val — 20,99 [16,09; 28,18] нг/мл, с генотипом val/met — 17,88 [13,9; 22,01] нг/мл.
При анализе пищевых привычек включенных в наше исследование пациентов с СРК оказалось, что для носителей генотипа met/met гена COMT характерны эпизоды частого переедания (χ2=33,26, p=0,001). В подтверждение этому целесообразно привести результаты исследования S.D. Donofry et al. [64] с участием более 1000 человек, где изучалась ассоциация варианта нуклеотидной последовательности rs4680 гена COMT с вероятностью симптомов компульсивного переедания и были получены данные о том, что лица с аллелью met подвергаются более высокому риску расстройства по сравнению с носителями гомозиготного генотипа val/val.
Генотип S/S гена SLC6A4 оказался связан с тревогой (χ2=7,87, p=0,026). На биологическом уровне изменение функционального полиморфизма в промоторной области гена SLC6A4 рассматривается в качестве предполагаемого модулятора реакции на стресс. В своей работе A. Caspi et al. [65] отметили, что S-аллель SLC6A4 связана с нарушением процессов адаптации и патологической реакцией на стресс, тогда как гомозиготы L/L являются более устойчивыми к стрессовым жизненным событиям, однако позже сообщалось о противоположных результатах [66, 67].
Генотип Т/Т гена DRD2 чаще встречался среди пациентов с СРК, имеющих избыточную массу тела и ожирение (χ2=8,34, p=0,026). Так, из 63 пациентов с СРК, имеющих ИМТ≥25 кг/м2, 15 (23,8%) были гомозиготы Т/Т по сравнению с 12,5% (25 из 200), имеющими ИМТ≤25 кг/м2. Интересно, что в группе пациентов с СРК, имеющих генотип Т/Т, чаще отмечались эпизоды переедания (χ2=29,05, p<0,001), тяга к сладкому (χ2=16,82, p=0,002) и признаки депрессии (χ2=39,63, p<0,001).
Показано, что плотность DRD2 в головном мозге может влиять на риск развития депрессии и определять пищевое поведение [68, 69]. В частности, у подростков, на которых оказывалось психологическое влияние (контроль) со стороны их родителей, потребность в еде повышалась, если они были носителями как минимум одной аллели Т [70]. Другие исследования показывают, что люди, страдающие ожирением, также проявляют больший интерес к еде и сильнее стремятся ее добыть, если в их генотипе присутствует аллель Т [71]. Объясняется это тем, что снижение плотности рецепторов дофамина связано с медленной активацией центра вознаграждения в мозге и приводит к необходимости поиска человеком событий, способных вызвать повышение уровня дофамина для хорошего самочувствия [72]. В настоящее время в целом ряде исследований подтверждена ассоциация аллели Т с повышенным риском аддиктивного поведения на примере курения, игромании и алкоголизма [73–75].
В проведенном нами исследовании между пациентами с СРК и здоровыми лицами не было получено статистически значимых различий по распространенности генотипов гена FTO, ассоциированного с жировой массой и ожирением, что, возможно, связано с неравномерностью выборки, однако установлено, что лица с генотипом А/А гена FTO имеют более высокий ИМТ (χ2=41,33, p<0,001). Так, среди пациентов с СРК, имеющих ИМТ≥25 кг/м2 (n=63), 37 (58,7%) имели генотип A/A, тогда как среди имеющих нормальный показатель ИМТ (n=200) — всего лишь 51 (25,5%).
Ранее обнаружено, что вариант нуклеотидной последовательности rs9939609 гена FTO связан с наличием ожирения в популяциях европейского происхождения [76, 77]. Окружность талии у лиц с генотипом А/А примерно на 7,1 см больше, чем у лиц с генотипом Т/Т (р=0,005). Однако самая сильная ассоциация минорной аллели А была обнаружена с ИМТ (отношение шансов 1,55, 95% ДИ 1,129–2,128, р=0,007), даже после поправки на возраст, пол и статус курения [78].
Кроме того, для пациентов с СРК, включенных в наше исследование и имеющих генотип A/A гена FTO, характерны эпизоды частого переедания (χ2=31,49, p<0,001), избыточное потребление добавленного сахара (χ2=9,25, p=0,010), тяга к сладкой пище (χ2=26,19, p<0,001), мучным и кондитерским изделиям (χ2=7,85, p=0,019), что подтверждает имеющиеся сведения о том, что наличие аллели риска A гена FTO связано с увеличением потребления пищи с высокой энергетической ценностью [79] и снижением чувства сытости [80].
Необходимо отметить, что имеются работы по изучению эффектов варианта нуклеотидной последовательности rs9939609 гена FTO на организм человека при различных условиях окружающей среды, которые подтверждают постулат о важности внешних факторов в реализации генетического риска. Так, в работе Q. Qi et al. [81] показано, что генотип A/A гена FTO был связан с более высоким ИМТ, но этот эффект также модулировался потреблением сладких напитков. Риск дополнительного увеличения ИМТ для тех, кто употреблял >1 порции в день, составил 1,78, по сравнению с 1,0 для тех, кто употреблял <1 порции в месяц, т. е. относительный риск был больше на 78% при избыточном потреблении сладких напитков. Интересными с практической точки зрения представляются также данные о том, что у людей с генотипом A/A снижены риски развития ожирения, если они физически активны [82].
В литературе имеются сведения о том, что ген FTO играет роль в развитии депрессии, а также контролирует дофаминергическую передачу в головном мозге, которая является ключевым механизмом не только для контроля чувства вознаграждения и пищевого поведения, но и для регуляции моторики пищеварительного тракта [83–86]. В нашем исследовании ассоциаций генотипов гена FTO с уровнем депрессии, уровнем дофамина или типом нарушения кишечной моторики обнаружено не было.
Поскольку одним из факторов, способствующих развитию и персистенции симптомов СРК, принято считать пищевую интолерантность [87] и многие пациенты связывают появление своих симптомов с употреблением молока или молочных продуктов, в числе других генов нами изучен вариант нуклеотидной последовательности c.-13910C>T гена LCT, который кодирует синтез фермента лактазы в тонкой кишке. Данный фермент участвует в расщеплении дисахарида лактозы или молочного сахара до глюкозы и галактозы. Аллель С гена LCT связана со снижением синтеза лактазы, а мутантная аллель Т — с сохранением способности расщеплять лактозу во взрослом возрасте. Таким образом, гомозиготные носители аллели С не способны к усвоению лактозы, в то время как гомозиготные носители варианта T хорошо переносят молочные продукты [88].
В проведенном нами исследовании частота выявления генотипа С/С гена LCT среди лиц с СРК, независимо от подтипа заболевания и степени тяжести, оказалась сопоставимой с таковой среди здоровых лиц. Это согласуется с результатами эпидемиологических исследований, где установлено, что распространенность дефицита лактазы у пациентов с СРК не отличается от таковой в общей популяции [89] и что непереносимость лактозы, о которой сообщают сами больные, зачастую не подтверждается результатами объективных методов исследований [90]. Вместе с тем в ряде клинических исследований отмечено уменьшение выраженности симптомов СРК при назначении безлактозной диеты, однако все они не были слепыми и плацебо-контролируемыми, что затрудняет трактовку полученных результатов [91]. Возможно, это объясняется выраженным эффектом ноцебо, когда клинические проявления заболевания возникают при употреблении тех или иных продуктов, которые, по мнению самих пациентов, они не переносят [89].
Ген TLR9 был выбран нами в качестве мишени для исследования как ген, регулирующий иммунный ответ при изменении состава кишечной микробиоты и потенциально участвующий в развитии воспаления низкой степени активности в слизистой оболочке толстой кишки при СРК. Толл-подобные рецепторы (TLR) относятся к семейству рецепторов распознавания образов (PRR) и присутствуют на макрофагах собственной пластинки, дендритных клетках, клетках Панета и эпителиальных клетках кишечника [92]. К настоящему времени у людей выявлено 10 типов TLR, среди них TLR9 специфично связывает цитозин-фосфат-гуанин (CpG) ДНК бактерий и вирусов [93]. Активация TLR9 инициирует передачу сигнала и экспрессию генов, которые контролируют врожденный иммунный ответ и антиген-специфический приобретенный иммунитет [94]. Кроме того, TLR9 участвуют в поддержании функционального состояния эпителиального кишечного барьера [95, 96], способствуют пролиферации эпителиальных клеток, секреции иммуноглобулина A и экспрессии антимикробных пептидов [97]. Нарушение регуляции этих процессов или чрезмерная активация TLR9 может привести к хроническому воспалению и развитию различных заболеваний. Показано, что у носителей минорной аллели C варианта нуклеотидной последовательности rs5743836 (c.-1237T>C) гена TLR9 наблюдается увеличение базовой транскрипции TLR9, индуцированной воздействием провоспалительного интерлейкина-6, примерно в 2,4 раза по сравнению с гомозиготами T/T (p=0,008) [98]. Продемонстрировано, что аллель С предрасполагает к развитию неходжкинской лимфомы [99], лимфомы Ходжкина [100], а также некоторых аутоиммунных и хронических воспалительных заболеваний, включая бронхиальную астму [101] и болезнь Крона [102].
В проведенном нами исследовании различий по частоте встречаемости аллели С между пациентами с СРК и лицами группы контроля обнаружено не было (χ2=0,754, p=0,686). Частота генотипов TLR9 среди пациентов с СРК составила 20,9% для гетеромутантного генотипа (Т/С) и 8,8% — для гомомутантного генотипа (С/С), среди здоровых лиц — 22,5 и 5,0% соответственно.
С учетом имеющихся данных об ассоциации варианта нуклеотидной последовательности rs5743836 (c.-1237T>C) гена TLR9 с развитием постинфекционного СРК, продемонстрированных на большой когорте лиц — 2300 жителях г. Уокертон (провинция Онтарио в центральной части Канады), которые перенесли острый гастроэнтерит из-за загрязнения муниципального водоснабжения [103], мы провели дальнейший анализ среди включенных в наше исследование пациентов в зависимости от наличия эпизода острой кишечной инфекции (ОКИ), перенесенного до появления первых симптомов СРК. Оказалось, что у тех, кто связывал развитие своего заболевания с перенесенной ОКИ (n=68), частота выявления гомозиготного генотипа C/C, связанного с чрезмерной активацией TLR9, была значительно выше — 26,5% против 2,6% среди тех, у кого отсутствовали указания на ОКИ в анамнезе (n=194), и эти различия были статистически значимы (χ2=8,45, p=0,038).
Интересно, что среди пациентов с СРК, кто перенес ОКИ, генотип С/С гена TLR9 ассоциировался с высоким уровнем кортизола в слюне как в утренней порции (χ2=11,37, p=0,016), так и в вечерней (χ2=9,22, p=0,029). Данный феномен подтверждает сформулированные ранее выводы о том, что активация TLRs может быть опосредована действием кортикотропин-рилизинг-фактора и гормона стресса кортизола через путь протеинкиназы А, который стимулирует продукцию провоспалительных цитокинов [104], и что тревога является независимым фактором риска развития постинфекционного СРК [105].
Заключение
Таким образом, несмотря на то, что во многих исследованиях установлены наследственный компонент и ассоциация СРК с вариантами нуклеотидной последовательности отдельных генов-кандидатов, регулирующих основные патогенетические механизмы развития заболевания — висцеральную гиперчувствительность, моторику кишечника, процессы нейротрансмиссии, воспаления, функцию иммунной системы и проницаемость эпителиального барьера, в нашем исследовании статистически значимые различия между пациентами с СРК и здоровыми лицами получены для генов, регулирующих дофаминергическую нейротрансмиссию — COMT и DRD2. Вместе с тем детальный анализ внутри когорты пациентов с СРК показал достоверные различия и для других генов-кандидатов в зависимости от подтипа и степени тяжести заболевания. Кроме того, были установлены ассоциативные взаимодействия, обеспечивающие реализацию генетической предрасположенности под влиянием таких факторов окружающей среды, как характер питания, уровень тревоги и депрессии, наличие ОКИ в анамнезе. Полученные результаты подчеркивают многофакторность и комплексность СРК, а также важность изучения взаимодействия факторов генетики и эпигенетики в развитии и персистенции симптомов заболевания с целью разработки эффективных схем курации пациентов.
Сведения об авторах:
Гаус Ольга Владимировна — к.м.н., доцент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-9370-4768.
Ливзан Мария Анатольевна — д.м.н., профессор, член-корреспондент РАН, заведующая кафедрой факультетской терапии и гастроэнтерологии, ректор ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017.
Контактная информация: Гаус Ольга Владимировна, e-mail: gaus_olga@bk.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 16.02.2023.
Поступила после рецензирования 13.03.2023.
Принята в печать 03.04.2023.
About the authors:
Olga V. Gaus — C. Sc. (Med.), Assistant Professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9370-4768.
Maria A. Livzan — Dr. Sc. (Med.), Professor, Corresponding Member of the Russian Academy of Sciences, Head of the Department of Faculty Therapy and Gastroenterology, rector, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017.
Contact information: Olga V. Gaus, e-mail: gaus_olga@bk.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 16.02.2023.
Revised 13.03.2023.
Accepted 03.04.2023.
Информация с rmj.ru



