Введение
Повышение качества выхаживания хирургических больных с пороками развития желудочно-кишечного тракта (ЖКТ) и осложнениями некротического энтероколита позволяет снизить послеоперационную летальность, что неизбежно приведет к увеличению числа пациентов, перенесших резекцию кишечника [1, 2]. Адекватное питание — один из решающих моментов в комплексе мероприятий по выхаживанию пациентов, прооперированных на кишечнике в первые месяцы жизни. Использование лечебных молочных смесей для энтерального питания у таких детей должно облегчать процессы всасывания и усвоения пищевого химуса благодаря особенностям их химического состава: они содержат все необходимые питательные вещества в виде продуктов ферментативного гидролиза; имеют определенную осмолярность (не более 295 мосмоль/л), предотвращающую развитие осмотической диареи и активную кислотность (рН 6,0–7,0), что создает в ЖКТ благоприятные условия для развития кишечной микробиоты [3]. По мнению исследователей, адсорбция азота из продукта на основе аминокислот несколько ниже, чем из продукта, содержащего пептиды. В связи с этим в качестве стартового продукта в энтеральном питании детей, перенесших резекцию кишечника, рекомендуется использовать смеси на основе гидролизата белка, предпочтительнее — сывороточного. Такие смеси содержат преимущественно пептиды и аминокислоты, при этом имеют низкую осмолярность [4].
Биологически полноценное питание обеспечивает не только нормальное функционирование органов пищеварительной системы, но и положительную динамику микробиологических показателей [5]. Роль микробиоты в физиологии и патологии ЖКТ ребенка чрезвычайно велика. Некоторые метаболиты, продуцируемые пробиотиками, например масляная кислота, являются важной энергетической субстанцией для эпителиоцитов [6]. Короткоцепочечные кислоты, продуцируемые микроорганизмами, оказывают стимулирующее действие на чувствительные рецепторы энтеральной нервной системы, регулирующей состояние микробно-тканевого комплекса слизистой оболочки кишечника. Недостаток короткоцепочечных жирных кислот (КЖК) или нарушение их состава изменяют функциональное состояние кишечной стенки и энтеральной нервной системы [7].
Цель исследования: оценить темпы роста и метаболическую активность микробиоты кишечника у детей, перенесших резекцию кишечника на первом году жизни, находившихся на лечебном питании на основе полностью гидролизованных белков молочной сыворотки со среднецепочечными триглицеридами и нуклеотидами.
Материал и методы
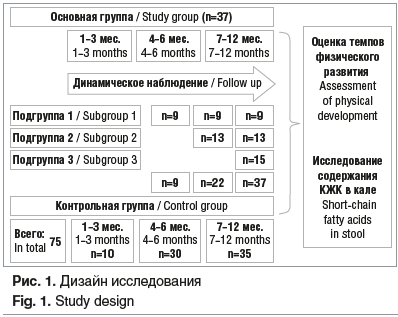
Исследование проведено на 112 детях первого года жизни. Согласно дизайну исследования сформировано две группы. Основную группу (ОГ) составили 37 детей, перенесших резекцию кишечника в первые месяцы жизни. Критерии включения в ОГ: оперативное лечение и резекция части кишечника в первые месяцы жизни, возраст от 1 до 12 мес. жизни, согласие родителей ребенка на участие в исследовании. Резекция части тонкого кишечника была проведена у 22 (59,5%) детей, резекция участка толстой кишки — у 15 (40,5%). Причиной оперативного вмешательства на тонкой кишке у 15 (68,2%) детей были врожденные пороки развития (ВПР) ЖКТ, у 7 (31,8%) — некротизирующий энтероколит. В структуре ВПР имелись следующие пороки: атрезия тощей кишки — 4 (26,7%) ребенка, гастрошизис — 2 (13,3%), заворот участка подвздошной кишки — 3 (20%), эмбриональная грыжа пупочного канатика — 1 (6,7%), атрезия подвздошной кишки — 2 (13,3%), множественные атрезии тонкой кишки — 4 (26,7%) ребенка. В 13 (86,6%) случаях ВПР ЖКТ были выявлены пренатально. Причиной резекции толстой кишки в 100% случаев была болезнь Гиршпрунга. В целом средний срок оперативного лечения у детей ОГ составил 17,7±4,4 дня жизни, у детей, перенесших резекцию тонкой кишки, — 4,0±1,5 дня, резекцию толстой кишки — 31,9±8,8 дня. Однако в исследование их включали на разных сроках: в возрасте 1–3 мес. включено 9 человек, 4–6 мес. — еще 13 детей и во втором полугодии жизни — 15 человек (рис. 1). Таким образом, для проведения анализа было сформировано 3 подгруппы: подгруппу 1 составили дети в возрасте 1–3 мес. (n=9); подгруппу 2 — дети в возрасте 3–6 мес. (n=22), подгруппу 3 — дети в возрасте 6–12 мес. жизни (n=37).
Все дети ОГ получали в качестве питания смесь на основе полностью гидролизованных белков молочной сыворотки со среднецепочечными триглицеридами и нуклеотидами (Нутрилон Пепти Гастро) с момента начала энтерального питания в послеоперационном периоде и на протяжении всего первого года жизни. Прикорм вводили начиная со второго полугодия жизни по индивидуальному графику с удлинением периода формирования толерантности к вводимому прикорму. Вводили злаковые прикормы: безмолочные, безглютеновые каши, овощные (монокомпонентные пюре из кабачка, брокколи, цветной капусты, моркови, тыквы), мясные пюре (кролик, индейка, говядина, курица). Неадаптированные кисломолочные продукты рекомендовали к постепенному введению в рацион ребенка только после 12 мес. жизни. Частота стула в возрасте 1–3 мес. составила 4,4±0,5; 4–6 мес. — 3,5±0,4; 7–12 мес. — 2,4±0,2 раза в сутки, что соответствует нормативным характеристикам стула у детей первого года жизни.
Контрольную группу (КГ) составили 75 детей в возрасте 1–12 мес. жизни, относящихся к I и II группам здоровья (см. рис. 1). Критерии включения: возраст от 1 до 12 мес., отсутствие жалоб со стороны ЖКТ, неприменение антибактериальных и пробиотических препаратов за 3 мес. до начала исследования. На грудном вскармливании находился 31 (41,3%) ребенок, на смешанном — 17 (22,7%) детей, на искусственном — 27 (36%). Дети, находившиеся на искусственном вскармливании, получали базовые адаптированные смеси. Все прикормы у детей КГ вводились согласно «Программе оптимизации вскармливания детей первого года жизни в Российской Федерации» (2019 г.).
У всех детей оценивали антенатальный и перинатальный анамнез, анализировали физическое развитие на протяжении всего первого года жизни и исследовали содержание КЖК в кале.
Сведения об анамнезе и характере вскармливания получали из выписки из родильного дома, истории развития ребенка (форма 112/у). Оценку физического развития проводили в соответствии с рекомендациями ВОЗ (https://www.who.int/childgrowth/standards/ru). Оценивали индексы: длина тела / возраст и масса тела / возраст. При интерпретации результатов руководствовались методическими рекомендациями «Оценка физического развития детей и подростков» [8]. Физическое развитие оценивали в возрастные периоды 1–3, 4–6 и 7–12 мес. жизни.
Исследование КЖК в кале проводили методом газожидкостной хроматографии по методике, предложенной М.Д. Ардатской и соавт. [9]. Определение КЖК с изомерами в фекалиях складывалось из двух этапов: процесса пробоподготовки и газожидкостного хроматографического анализа. Определяли продукты микробного метаболизма (маркеры): С2 — уксусную кислоту; С3 — пропионовую кислоту; iС4 — изомасляную кислоту; С4 — масляную кислоту; iС5 — изовалериановую кислоту; C5 — валериановую кислоту; iC6 — изокапроновую кислоту; C6 — капроновую кислоту. Рассчитывали сумму кислот и анаэробный индекс (АИ). Идентификацию пиков на полученных хроматограммах проводили с использованием программного обеспечения «Хромос» (ЗАО «Химаналитсервис», Россия) [10].
Исследование выполнено в соответствии с этическими принципами и было утверждено локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России.
Статистическую обработку полученных данных проводили с помощью пакета статистических программ Statistica, версия 10.0 (StatSoft Inc, США). Использовали методы описательной статистики для анализа переменных с нормальным распределением (среднее значение (М), стандартное отклонение (σ), минимальное и максимальное значения) и непараметрических переменных (медиана Ме, 25-й и 75-й процентили). Сравнительный анализ для параметрических переменных проводили с использованием критерия Стьюдента, для непараметрических независимых переменных — критерия Манна — Уитни, зависимых переменных — критерия Вилкоксона, для качественных данных — критерия χ2 Пирсона, точного двустороннего критерия Фишера. Различия считали статистически значимыми при р≤0,05.
Результаты и обсуждение
При сравнительной оценке антенатального и перинатального анамнеза детей выявлено, что у матерей ОГ в сравнении с матерями КГ достоверно чаще беременность протекала на фоне гестоза (97,3% против 81,3%, p≤0,02) и хронической фетоплацентарной недостаточности (ХФПН) (37,8% против 17,3%, p≤0,001). Средний срок гестации у детей, перенесших резекцию кишечника, был ниже, чем в КГ, — 35,9±0,6 нед. и 38,4±0,1 нед. соответственно (p≤0,05). Этим объясняется высокая доля (37,8%) недоношенных детей в ОГ. Дети, перенесшие оперативное лечение, значимо чаще были рождены путем кесарева сечения, чем дети КГ (соответственно в 72,9% и 28% наблюдений, р<0,01). Антропометрические показатели при рождении также были достоверно ниже в ОГ, чем в КГ: масса тела при рождении — 2606,59±951,28 г и 3292,3±443,34 г (p≤0,01), длина тела — 47,13±6,42 см и 52,4±2,24 см (p≤0,01) соответственно.
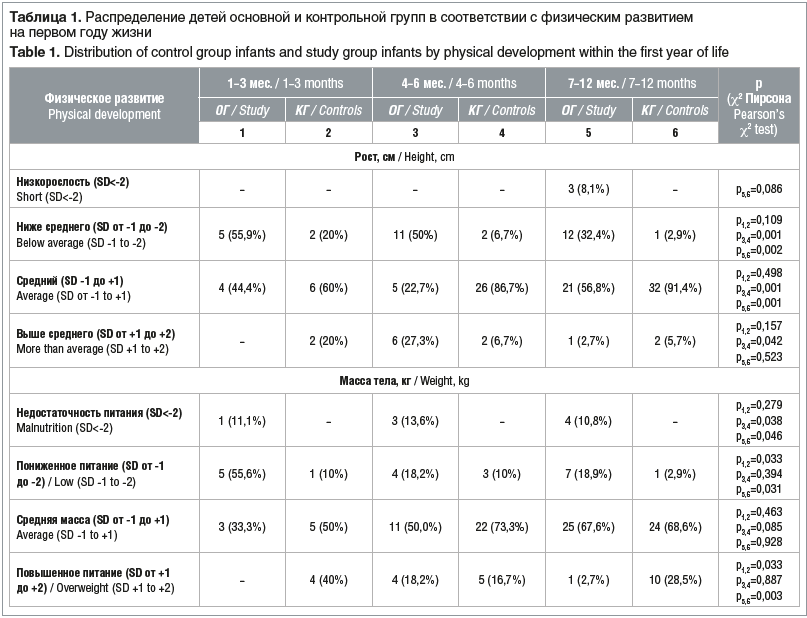
Оценка физического развития в возрасте 1–3 мес. выявила, что по показателю роста дети наблюдаемых групп были сопоставимы (табл. 1). Достоверных различий в числе детей со средним ростом (SD от -1 до +1) в ОГ и КГ не было (соответственно 44,4% и 60%). Более половины (55,9%) детей, перенесших оперативное лечение, имели рост ниже среднего (SD от -1 до -2), в КГ этот показатель составил лишь 20%. Рост выше среднего (SD от +1 до +2) был зафиксирован только в КГ (20%). В возрасте 4–6 мес. отмечалось достоверное преобладание детей среднего роста в КГ по сравнению с ОГ — 86,7% и 22,7% (р≤0,001) соответственно. Заслуживает внимания тот факт, что практически треть (27,3%) детей, перенесших резекцию кишечника, имели рост выше среднего и по этому показателю опережали детей в КГ (р=0,042). Однако при этом в ОГ сохранялось значимое преобладание детей с ростом ниже среднего — соответственно 50% и 6,7% (р≤0,001). К концу года жизни сохранялась та же закономерность: дети со средним ростом преобладали в КГ (р≤0,001), дети с ростом ниже среднего — в ОГ (р=0,002). Количество детей с ростом выше среднего в группах наблюдения было сопоставимо.
Среднюю массу (SD от -1 до +1) в возрасте 1–3 мес. в ОГ имели лишь треть (33,3%) детей против 50% в КГ при отсутствии статистически значимых межгрупповых различий. При этом половина детей ОГ имели пониженное питание (SD от -1 до -2), что было существенно выше, чем в КГ (55,6% и 10% соответственно, р=0,033).
Следует отметить, что 11,1% прооперированных детей имели недостаточность питания (SD≤-2), а дети с повышенным питанием преобладали среди здоровых детей. В возрасте 4–6 мес. группы различались только по количеству детей с недостаточностью питания (SD≤-2), которых статистически значимо больше было среди прооперированных (р=0,038). К концу первого года жизни по показателю средней массы тела ОГ и КГ были сопоставимы (67,6% и 68,6% соответственно). Одновременно с этим в ОГ отмечалось достоверное преобладание детей с недостаточностью питания и с пониженным питанием. Дети с повышенным питанием встречались чаще в КГ (р=0,003). На протяжении всего периода наблюдения высокорослых детей и детей с ожирением в группах наблюдения выявлено не было (см. табл. 1).
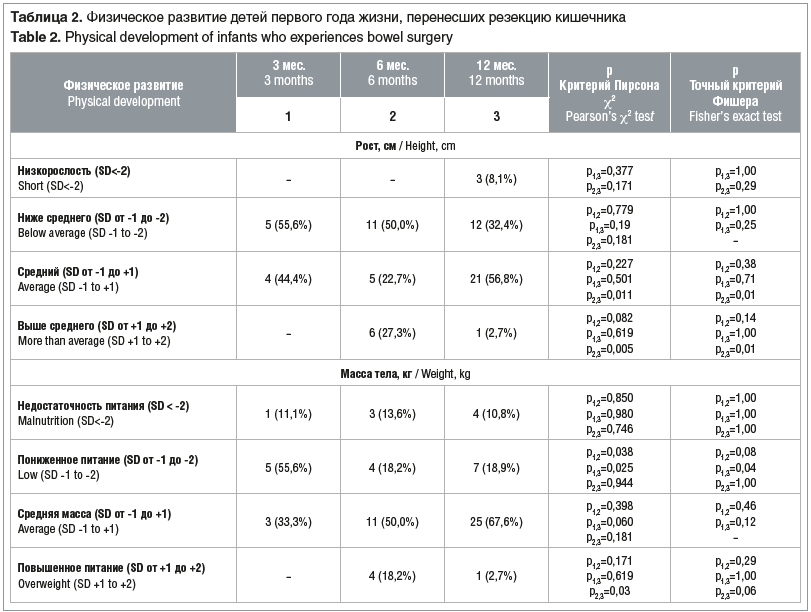
Динамическая оценка физического развития в ОГ на протяжении периода наблюдения (табл. 2) выявила, что количество детей со средним ростом увеличивалось и к концу года достигло 56,8%, что было обусловлено переходом детей из группы с ростом ниже среднего SD: от -1 до -2, которая уменьшилась с 55,6% до 32,4%, и из группы с ростом выше среднего, в которой отмечалось значимое снижение с 27,3% в 6 мес. до 2,7% в 12 мес. (р=0,005). Данная динамика отражает гармонизацию роста у наблюдаемых детей к концу первого года жизни.
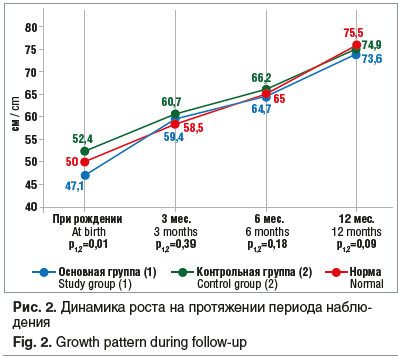
Количество детей со средней массой тела имело тенденцию к увеличению к концу первого года жизни (до 67,6%); количество детей с недостаточностью питания являлось стабильным на протяжении всего периода наблюдения и составляло в 3, 6 и 12 мес. соответственно 11,1, 13,6, 10,8%; доля детей с пониженным питанием в возрасте 3 мес. составила 55,6%, статистически значимо снизившись к 6-му месяцу и сохранившись на этом уровне до конца наблюдения. Интересен факт, что в возрасте 6 мес. 18,2% детей имели повышенное питание и к 12 мес. отмечалась лишь тенденция к уменьшению их числа.
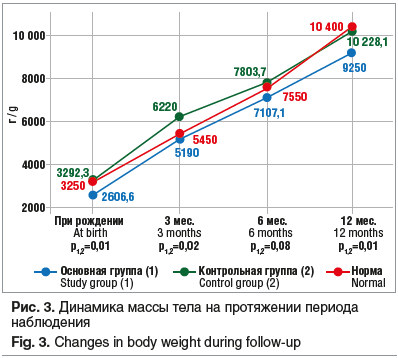
Сопоставление показателей роста (длины) и массы тела в ОГ и КГ в динамике на первом году жизни демонстрировало отсутствие достоверных различий по длине тела: в 3 мес. — 59,4±3,4 см и 60,7±2,8 см, в 6 мес. — 64,7±5,3 см и 66,2±2,5 см, в 12 мес. — 73,6±0,6 см и 74,9±2,7 см соответственно (рис. 2). При этом показатели массы тела обнаруживали достоверно более низкие прибавки в 3 мес. и 12 мес. жизни в ОГ: в 3 мес. масса тела составила 5190±887,4 г и 6220±897,7 г (р=0,02), в 6 мес. — 7107,1±1939,6 г и 7803,7±8050,2 г (р=0,08), в 12 мес. — 9950±1348,3 г и 10228,1±438,32 г (р=0,01) (рис. 3). Таким образом, несмотря на достоверные различия при рождении, дети, перенесшие оперативное лечение, к концу первого года жизни имели сопоставимые со здоровыми детьми показатели длины тела, что может свидетельствовать об адекватном процессе ассимиляции питательных веществ в кишечнике.
Сравнительное исследование содержания КЖК в кале на протяжении первого года жизни у детей ОГ и КГ выявило отсутствие различий в содержании С2, С3 и в АИ. Определено статистически значимое снижение С4 у детей, перенесших резекцию кишечника, в сравнении со здоровыми детьми во втором полугодии жизни. Данный факт можно расценить как маркер сохраняющегося воспалительного процесса в кишечнике после перенесенного оперативного вмешательства [11]. Следует отметить, что суммарное содержание кислот в кале было достоверно выше у детей ОГ в сравнении с детьми КГ в возрасте 1–3 мес. и во втором полугодии жизни, что свидетельствует об активном заселении, размножении и видовом разнообразии микробиоты кишечника
(табл. 3).
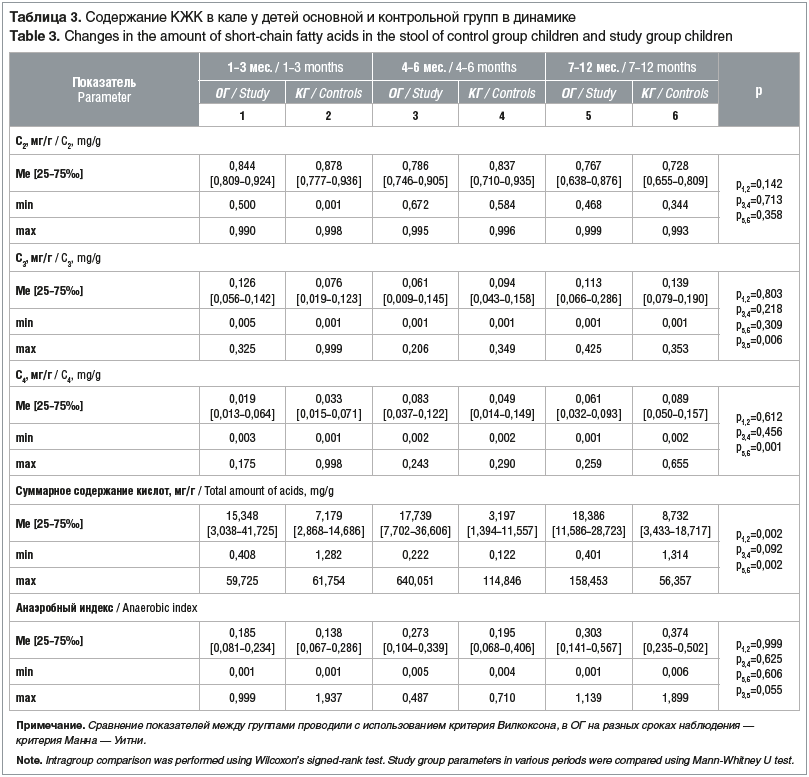
Сравнительное содержание КЖК в кале у детей ОГ в зависимости от возраста на первом году жизни («поперечные срезы») выявило сопоставимость результатов по уровню С2, С4 и суммы кислот, что можно расценить как признак стабильности микробиоты кишечника. Статистически значимые различия были выявлены только по уровню С3, который был выше у детей второго полугодия жизни. Отмечалась тенденция к нарастанию АИ к концу первого года жизни (см. табл. 3). Можно предположить, что данный факт отражает активность анаэробной флоры у детей после длительного курса антибактериальной терапии в послеоперационном периоде.
Выводы
Дети, родившиеся с ВПР ЖКТ, перенесшие некротизирующий энтероколит, имели значимо более неблагоприятное течение антенатального и перинатального периодов (гестоз и ХФПН у матери, недоношенность, оперативное родоразрешение), способное повлиять на темпы роста и развития в последующие периоды онтогенеза.
Дети, перенесшие оперативное лечение и получавшие лечебное питание на основе полностью гидролизованных белков молочной сыворотки со среднецепочечными триглицеридами, к концу первого года жизни имели сопоставимые показатели физического развития с детьми I и II групп здоровья по показателю роста (длины тела). При этом количество детей с пониженным питанием значимо снижалось к концу года, а в возрасте 6 мес. появились дети с повышенным питанием (18,2%). Выявленная динамика физического развития отражает адекватное нутритивное обеспечение на фоне восстановления функциональной способности кишечника к всасыванию и усвоению питательных веществ.
Метаболическая активность микробиоты кишечника у детей, перенесших оперативное лечение и получавших лечебное питание, в целом существенно не отличалась от таковой у здоровых детей на протяжении первого года жизни, характеризовалась стабильным уровнем АИ — интегрального показателя соотношения аэробных и анаэробных процессов в кишечнике.
Благодарность
Редакция благодарит ООО «Нутриция» за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgment
Editorial Board is grateful to LLC Nutricia for the assistance in technical edition of this publication.
Сведения об авторах:
Вахлова Ирина Вениаминовна — д.м.н., профессор, заведующая кафедрой госпитальной педиатрии ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; ORCID iD 0000-0002-5274-4699.
Федотова Галина Викторовна — ассистент кафедры гос-
питальной педиатрии ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; ORCID iD 0000-0001-7886-5491.
Боронина Любовь Григорьевна — д.м.н., профессор кафедры клинической лабораторной диагностики и бактериологии ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; ORCID iD 0000-0003-0152-962X.
Саматова Елена Валерьевна — к.м.н., врач-бактериолог лаборатории клинической микробиологии ГАУЗ СО «ОДКБ»; 620149, Россия, г. Екатеринбург, ул. С. Дерябиной, д. 32; ORCID iD 0000-0003-3154-6201.
Контактная информация: Федотова Галина Викторовна, e-mail: Tichcovagala@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 22.03.2021, поступила после рецензирования 12.04.2021, принята в печать 29.04.2021.
About the authors:
Irina V. Vakhlova — Doct. of Sci. (Med.), Professor, Head of the Department of Hospital Pediatrics, Ural State Medical University; 3, Repina str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-5274-4699.
Galina V. Fedotova — Assistant of the Department of Hospital Pediatrics, Ural State Medical University; 3, Repina str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0001-7886-5491.
Lubov G. Boronina — Doct. of Sci. (Med.), professor of the Department of Clinical Laboratory Diagnostics & Bacteriology, Ural State Medical University; 3, Repina str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0003-0152-962X.
Elena V. Samatova — Cand. of Sci. (Med.), bacteriologist of the Laboratory of Clinical Microbiology, Regional Children’s Clinical Hospital; 32, S. Deryabina str., Yekaterinburg, 620149, Russian Federation; ORCID iD 0000-0003-3154-6201.
Contact information: Galina V. Fedotova, e-mail: Tichcovagala@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 22.03.2021, revised 12.04.2021, accepted 29.04.2021.
.
Информация с rmj.ru






