Введение
Высокотехнологичные хирургические вмешательства при заболеваниях сердечно-сосудистой системы относятся к группе наиболее часто выполняемых как в Российской Федерации, так и во всем мире [1].
В настоящее время, несмотря на рекомендации по снижению риска инфицирования ран в кардиохирургической клинике, сохраняется проблема значительной распространенности нозокомиальных инфекций, усугубляемая ассоциированной летальностью и существенными экономическими затратами [2–9].
После операций на открытом сердце в структуре послеоперационных осложнений особое место занимают инфекции области хирургического вмешательства (ИОХВ), которые встречаются в 4,5–25,0% случаев [5–9]. Значительный уровень послеоперационного инфицирования чистых и условно чистых ран связан с повышенной восприимчивостью пациентов к инфекции из-за факторов риска, таких как сахарный диабет и ожирение, а также необходимости использования внутренних грудных артерий (ВГА) для реваскуляризации [5–8]. На частоту ИОХВ оказывает влияние наличие и распространение резистентных внутрибольничных штаммов микроорганизмов на фоне укрупнения больниц, расширения отделений реанимации, а также нерационального использования антибиотиков [4].
В этих условиях здравоохранение сталкивается с рядом проблем, решение которых не может быть найдено в исключительном использовании рекомендаций, направленных на устранение ИОХВ. Разработка, внедрение и аудит клинических протоколов, направленных на модификацию факторов риска ИОХВ в условиях последовательного наблюдения за патогенами и контроля показателей частоты инфекционных осложнений на уровне лечебно-профилактических учреждений, необходимы для достижения максимальной безопасности хирургического вмешательства [2, 3].
Таким образом, исследование структуры и резистентности внутрибольничной микрофлоры представляет существенный интерес не только в программах эпидемиологического наблюдения, но и при планировании/коррекции превентивных мероприятий ИОХВ [2, 3, 9, 10].
Цель исследования: оценить распространенность ИОХВ, видовой состав и антибиотикорезистентность микроорганизмов ран после операций на открытом сердце за период с 2010 по 2019 г.
Материал и методы
Выполнено ретроспективное исследование, охватывающее период с 2010 по 2019 г., предметом изучения в котором были показатель встречаемости и этиология ИОХВ после операций на открытом сердце. Также проведен анализ структуры и резистентности изолированных микроорганизмов ИОХВ.
Исследование проведено на базе отделения кардиохирургии ГБУЗ СО «Уральский институт кардиологии» (г. Екатеринбург). За анализируемый период последовательно выполнено 4993 кардиохирургических вмешательства на открытом сердце у взрослых пациентов (средний возраст 63,4±8,1 (23–88) года). У 458 (9,2%) больных выполнена изолированная коррекция приобретенных пороков сердца, у 4535 (90,8%) — коронарное шунтирование. В качестве материала для реваскуляризации в 3661 (80,7%) случае была использована левая ВГА, в 874 (19,3%) случаях — обе ВГА, при необходимости дополнительно использовалась большая подкожная вена голени. Средний показатель ожидаемой летальности по алгоритму Euroscore II среди наблюдаемых пациентов составил 1,6%. Основные характеристики пациентов представлены в таблице 1.
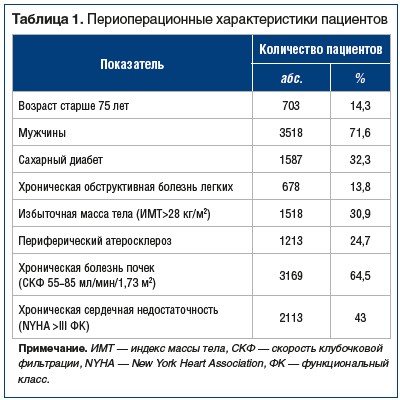
В большинстве (4953 (99,2%)) случаев степень контаминации операционной раны была расценена как чистая, у 40 (0,8%) пациентов — как условно чистая.
Антибиотикопрофилактика выполнялась в соответствии со стандартом у взрослых кардиохирургических пациентов для чистых ран [2, 3]: в качестве базовой схемы использовались цефалоспорины II поколения: цефуроксим 1,5 г в/в за 30 мин до вмешательства, затем каждые 8 ч после операции в течение 48 ч; в качестве альтернативной схемы использовались гликопептиды: ванкомицин в дозе 1,0 г в/в капельно не менее чем за 60 мин до вмешательства, затем каждые 12 ч в течение 48 ч или тейкопланин 400 мг в/в капельно не менее чем за 60 мин до вмешательства, затем каждые 12 ч в течение 48 ч.
Гликопептиды использовались при высоком риске инфицирования резистентными формами стафилококков либо доказанной аллергии на β-лактамные антибиотики.
В структуре ИОХВ выделяли поверхностную (вовлекающую только кожу и подкожную клетчатку) и глубокую (вовлекающую глубокие мягкие ткани в месте разреза) формы, а по локализации — центральную (постстернотомную) и периферическую (доступ для забора аутовенозного трансплантата, голень) [1–4].
Выделение, идентификация и определение чувствительности к антимикробным препаратам были выполнены в лаборатории, сертифицированной для проведения культуральной диагностики с использованием системы BACTEC (BD Biosciences, США). Бактериологическое исследование проводилось с применением жидких питательных сред для культивирования с последующей радиометрической (BACTEC 460), колориметрической (Mb-Bact, Васt-ALERT) и люминесцентной (BACTEC MGIT 960) детекцией роста.
Антибиотикорезистентность оценивалась к следующим группам антимикробных препаратов: пенициллинам (пенициллин, оксациллин, метициллин-клавуланат), аминогликозидам (гентамицин, амикацин, тобрамицин), линкозамидам (клиндамицин), тетрациклинам (тетрациклин), полициклиновым (фузидин), фторхинолонам (ципрофлоксацин, левофлоксацин, моксифлоксацин), макролидам (эритромицин), цефалоспоринам I–IV поколений (цефазолин, цефуроксим, цефтриаксон, цефепим), карбапенемам (меропенем, имепенем, эритропенем), оксазолидонам (линезолид), глицилциклинам (тигециклин), липопептидам (даптомицин), гликопептидам (ванкомицин).
Все данные проанализированы с использованием программы Exel для Microsoft (2018) и онлайн-калькулятора sociostatistic (доступен на https://www.socscistatistics.com). Для описания непрерывных показателей применялись средние значения. Дискретные показатели представлены в абсолютных цифрах, процентах к итогу. Инцидентность ИОХВ представлена в количестве случаев на 100 процедур с использованием 95% доверительного интервала (95% ДИ). При сравнении показателя распространенности между двумя группами использовано отношение шансов (OШ, 95% ДИ, p).
Результаты исследования
Показатель частоты ИОХВ
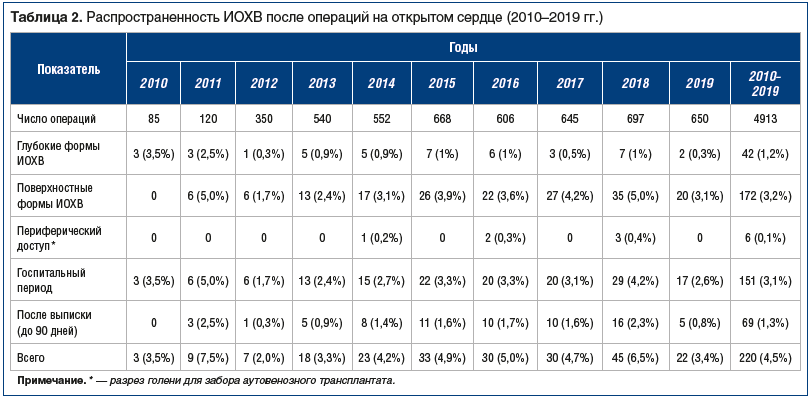
Послеоперационная летальность составила 1,6% (n=80). Инцидентность ИОХВ в популяции 4913 кардиохирургических пациентов за период с 2010 по 2019 г. составила 4,5% [95% ДИ 4,45–4,54]. Согласно полученным данным глубокие формы ИОХВ встречались в 4 раза реже, чем поверхностные, их инцидентность составила 1,2%, или 42 случая. Наибольшая доля (78,2%) всех случаев ИОХВ относилась к поверхностным формам. Инцидентность поверхностных форм составила в среднем 3,2%. Медиана срока от момента операции до выявления ИОХВ составила 6 сут, при этом 65% всех случаев ИОХВ было выявлено в стационаре (табл. 2).
Структура и резистентность микроорганизмов
За анализируемый период положительная бактериологическая культура получена в 62 (28,2%) наблюдениях ИОХВ из 220. Изоляты микроорганизмов (n=62) получены из 266 проб клинического материала (c постстернотомной раны грудины: глубокие ткани (включая переднее средостение) (n=42), поверхностные ткани (n=178); крови (n=40), периферической раны голени после забора аутовены (n=6)), оперативное лечение которых осложнилось развитием ИОХВ.
Вероятность изоляции патогена в случае развития глубоких форм составила: ОШ 12,83 [95% ДИ 5,901–27,930] по сравнению с поверхностными формами. Изоляты из биоматериала, полученного помимо отделяемого из постстернотомной (основной) раны (17 (27,4%)), во всех наблюдениях совпадали с основным источником.
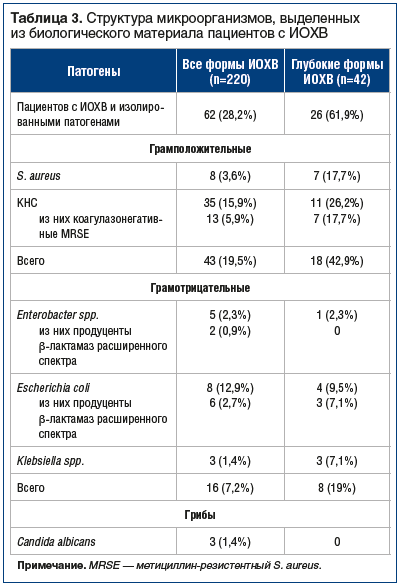
Основные патогены, выявленные при бактериологическом исследовании у пациентов с ИОХВ, представлены стафилококками (43 (69,4%) случая). Среди них коагулазонегативные стафилококки (КНС), все S. epidermidis, были выявлены в 35 (56,5%) случаях, S. aureus — в 8 (12,9%) случаях.
Грамотрицательные микроорганизмы были выявлены в 16 (26%) случаях, все представители семейства Enterobacteriaceae (Escherichia coli — 8 изолятов, Enterobacter spp. — 5 изолятов, Klebsiella pneumoniае — 3 изолята). Грибы рода Candida albicans выявлены в 3 (4,5%) культурах. В 5 (8%) случаях выявлено 2 и более возбудителей (табл. 3).
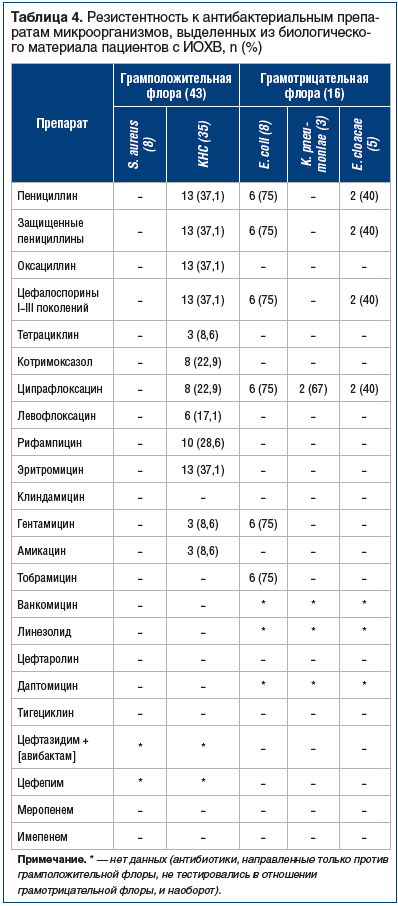
Анализ антибиотикорезистентности выделенных грамположительных культур продемонстрировал, что все стафилококки были чувствительны к тигециклину, цефтаролину, даптомицину, ванкомицину, линезолиду, фузидину. КНС продемонстрировали умеренную резистентность к оксациллину, цефалоспоринам I–III поколений (37,1%), а также макролидам (37,1%). Среди изолированных штаммов КНС также отмечалась резистентность к фторхинолонам (22,9%), тетрациклинам (8,6%) и аминогликозидам (8,6%). Резистентных форм S. aureus выявлено не было (табл. 4).
Резистентные грамотрицательные микроорганизмы, продуценты β-лактамаз расширенного спектра (БЛРС), в 6 случаях представлены E. coli, в 2 — E. cloacae. Все продуценты БЛРС были устойчивы к пенициллинам и цефалоспоринам I–III поколений. Для большинства грамотрицательных микроорганизмов, продуцентов БЛРС, также отмечена сниженная чувствительность к фторхинолонам и аминогликозидам Резистентность к фторхинолонам выявлена также у штаммов K. pneumoniae и E. cloacae, не являющихся продуцентами БЛРС. Вся выделенная грамотрицательная флора была чувствительна к имипенему, тигециклину, цефтазидиму + [авибактам], цефепиму (см. табл. 4).
Обсуждение
Полученные данные о преобладании КНС в этиологической структуре ИОХВ у кардиохирургических пациентов в целом совпадают с результатами других исследований [11–15]. С одной стороны, это связано с широким распространением КНС как вне- и внутрибольничной флоры, часто изолируемой из биоматериала кардиохирургических пациентов с разными формами нозокомиальной инфекции и без них: из раневого отделяемого, из операционной раны средостения, со створок клапанов [11, 12, 14]. С другой стороны, экспрессия факторов адгезии, выделение экзотоксинов и энзимов, противодействующих иммунной системе, а также формирование полисахаридных биопленок обеспечивает способность КНС повреждать ткани и быстро распространяться, вызывая ИОХВ с тяжелыми последствиями [11, 12, 14].
Полученные данные об антибиотикорезистентности КНС подтверждаются другими исследованиями, свидетельствующими об устойчивости внутрибольничных форм не только к β-лактамам, но и к другим классам препаратов: аминогликозидам, макролидам, фторхинолонам. При этом в целом сохраняется чувствительность КНС к ряду антимикробных препаратов, таким как цефтаролин, даптомицин, ванкомицин, линезолид, фузидин [12].
Несмотря на то, что золотистые стафилококки также являются одними из наиболее часто изолируемых микроорганизмов у кардиохирургических пациентов [7, 11–15], на нашем материале они выделялись существенно реже. Возможно, распространенность S. aureus зависит от ряда популяционных факторов, например сахарного диабета 2 типа и ВИЧ-инфекции [7, 15]. С другой стороны, появляется все больше данных об ингибировании токсинообразования у S. aureus за счет выделения аутоиндукторов КНС [12, 16]. Так, по данным B. Söderquist et al. [14], можно выделять кардиохирургические клиники с преобладанием в микробиологическом пейзаже либо S. aureus, либо КНС. На нашем материале резистентных форм S. aureus изолировано не было; при этом следует подчеркнуть существование консенсуса о катастрофических последствиях появления метициллин-резистентных форм стафилококков в структуре внутрибольничных микроорганизмов [4, 13].
По данным преобладающего числа наблюдений, представители семейства Enterobacteriaceae встречаются в существенно меньшем числе изолятов (до 30%) по сравнению со стафилококками, что совпадает с результатами нашего исследования [14, 17, 18]. Высокая встречаемость продуцентов β-лактамаз расширенного спектра, полученная в нашем исследовании, также является общей тенденцией, связанной с нерегулируемым использованием антибиотиков широкого спектра (пенициллинов и цефалоспоринов I–III поколений) в медицинской практике [18]. При этом мы пока не сталкивались с проблемой экспрессии карбапенемаз, продемонстрированной в других работах [19].
Полученные результаты в отношении структуры и резистентности внутрибольничной флоры, на наш взгляд, в целом подтверждают актуальность существующих протоколов антимикробной профилактики, однако выявление факторов риска инфицирования метициллин-резистентными формами стафилококков и уточнение показаний для назначения гликопептидов требуют дальнейшего изучения. Стандартные подходы к антибактериальной терапии при возникновении ИОХВ после операций на открытом сердце с использованием так называемых «антибиотиков резерва», включая имипенемы, и ограничивая использование фторхинолонов, выглядят оправданными. При этом рациональный выбор антимикробной терапии должен быть основан на результатах мониторинга резидентной флоры.
Выводы
-
Распространенность ИОХВ в популяции кардиохирургических пациентов за период с 2010 по 2019 г. составила 4,5%.
-
Основные патогены, выявленные при бактериологическом исследовании у пациентов с ИОХВ, представлены стафилококками (19,5%). КНС были выявлены в 15,9% случаев ИОХВ.
-
Препаратами выбора для рационального лечения ИОХВ, вызванных грамположительной флорой, следует считать ванкомицин, цефтаролин, даптомицин, линезолид, фузидин.
-
Препаратами выбора для рационального лечения ИОХВ, вызванных грамотрицательной флорой, следует считать тигециклин, цефтазидим + [авибактам], цефепим, имипенем.
Информация с rmj.ru





