Эндоскопические технологии в диагностике и лечении ахалазии кардии
О.Э. Карпов, П.С. Ветшев, И.В. Васильев, А.С. Маады, К.И. Алексеев, А.С. Осипов
Национальный медико-хирургический Центр им. Н.И. Пирогова, Москва
Резюме
Ахалазия кардии относится к группе нервно-мышечной патологии, которая занимает четвертое место в структуре хирургических заболеваний пищевода. В основе ахалазии кардии лежит стойкое отсутствие расслабления нижнего пищеводного сфинктера и дискоординация перистальтики пищевода. В статье рассмотрены исторические аспекты, клинические симптомы, диагностика и современные взгляды на лечение больных с этой патологией. Проведен анализ 37 наблюдений ахалазии кардии I–IV стадии. На основании собственного опыта и полученных результатов установлено, что начинать лечение ахалазии кардии необходимо с миниинвазивных методов. Наиболее эффективный способ – эндоскопическая баллонная пневмокардиодилатация, которая выполнена 33 больным и у 31 (93,9%) оказалась успешной. Для получения стойкой ремиссии необходимо выполнение 2–3 курсов, включающих от 1 до 3-х сеансов баллонной дилатации. При II-III стадии болезни и неэффективности эндоскопического метода показана оперативное лечение кардиомиотомия с полноценной фундопликацией, а у больных IV стадией операцией выбора чаще применяется субтотальная резекция пищевода с одномоментной пластикой желудочной трубкой.
Ключевые слова: ахалазия, баллонная дилатация, кардиомиотомия, резекция пищевода.
Введение
Ахалазия кардии1 (АК) – заболевание, причиной которого является воспаление и дегенерация межмышечных сплетений, ведущее к потере постганглионарных тормозящих нейронов, участвующих в процессе расслабления нижнего пищеводного сфинктера (НПС) и приводящее к стойкому нарушению рефлекса раскрытия кардии при глотании с дискоординацией перистальтических сокращений пищевода [13]. АК встречается нечасто, ежегодная заболеваемость составляет 2:100000, а показатель распространенности -10:100000 [18]. Несмотря на длительный период изучения, до сих пор истинная причина АК окончательно не установлена. Среди возможных этиологических факторов отмечают психогенный [3], инфекционный, аутоиммунный, не исключается и генетическая предрасположенность [5]. АК относится к группе нервно-мышечных заболеваний пищевода (НМЗП), включающих в себя такие заболевания как кардиоспазм и диффузный эзофагоспазм (синдром Барсони-Тешендорфа). Следует помнить, что это разные заболевания, отличающиеся по этиологии, поражению нервных структур и виду мышечной дисфункции [11, 12].
1 Ахалазия кардиальной части пищевода (МКБ – 10, К 22.0).
Исторические аспекты НМЗП
История изучения спастических заболеваний пищевода насчитывает более 300 лет. Еще в 1679 году английский врач Томас Уиллис (Т. Willis) (рис. 1) в своем трактате «Pharmaceutice rationales sive diatribe de medicamentorum operationibus in humono corpora, London» привел описание больного, которого он наблюдал и лечил по поводу дисфагии в течение 15 лет. T. Willis не только описал ранее не известное заболевание, но и впервые разработал методику лечения пациента, которая явилась прообразом современной дилатации – спазмированную часть пищевода пробужировал китовым усом, обернутым губкой [21].

Рис. 1. Английский врач Томас Уиллис (Т. Willis)
С внедрением в клиническую практику эзофагоскопии, Иоганн Микулич (Johann Mikulicz) в 1881 году ввел термин – «кардиоспазм» (cardiospasmоs, от греч. kardia — кардиальное отверстие желудка, spasmos — непроизвольное сокращение, судорога). По мнению Микулича, вследствие дефектов иннервации развивается спазм кардии, приводящий к дисфагии с постепенным расширением, искривлением и удлинением пищевода. Долгое время все НМЗП расценивались как «кардиоспазм». Способы распознавания и лечения кардиоспазма описал С.П. Боткин в 1884 году, в своих «Клинических лекциях». Уже тогда С.П. Боткин детально описывал клинику «функциональных структур» кардии и выделял «спазмодическую» и «паралитическую» формы заболевания, возникавшие, по его мнению, на почве невроза.
Сам термин «ахалазия» (а – отсутствие, отрицательная приставка; chalasis – расслабление, от греч.) предложил С. Perry, а впервые применил в медицинской литературе A. Hurst в 1914 году.
Клинические симптомы
Основным клиническим симптомом, наиболее типичным для АК является дисфагия, которая в большинстве случаев прогрессирует постепенно, нарастает при поспешной еде, особенно холодной, плохом пережевывании крупного куска пищи, психоэмоциональном напряжении, даже при непривычной обстановке за столом и разговорами во время еды. Дисфагия начинается с приема твердой, плотной и сухой пищи у 99% пациентов со временем приводит к затруднению прохождения и жидкой пищи у 90–95% [17].
Второй по частоте симптом АК – регургитация. Регургитация обусловлена сильными спастическими сокращениями стенок пищевода, возникающими при его переполнении. Регургитация возникает через несколько часов после еды, при наклоне туловища вперед («симптом завязывания шнурка») или в горизонтальном положении в виде вытекания содержимого пищевода (слюна, слизь, пищевые остатки) на подушку – «симптом мокрой подушки». Регургитация иногда сопровождается поперхиванием, пароксизмами мучительного кашля вследствие аспирации пищевых масс. В связи с этим, у 40% больных с АК ежедневно проявляется, по крайней мере, один из дыхательный симптомов – ночной кашель (37%), охриплость голоса (21%), одышка (10%) и боли в горле (12%), который маскирует основное заболевание [20].
Поэтому, иногда, в клинической картине АК доминирует не триада главных симптомов, а проявления отдельных осложнений.
Следует обратить внимание, что «ночной кашель», наряду с симптомом «мокрой подушки», указывает на декомпенсацию АК и служит показанием к проведению эндоскопической баллонной пневмокардиодилатации (ЭБПКД) [9].
Еще один симптомом у пациентов с АК является загрудинная боль, которая встречается у 59% больных, чаще в молодом возрасте. Боль может носить распирающий характер, иногда иррадиирует в шею, челюсть, межлопаточную область [23] и связана с растяжением пищевода и его нервных сплетений застойным содержимым.
Потеря массы тела наблюдается у 30–90% больных, как правило, на 5–10 кг, однако кахексия развивается довольно редко [1].
Классификация АК
В литературе известно около 25 классификаций АК и большинство из них определяют стадийность. Одна из первых классификаций датируется 1921 годом и принадлежит Н. Thieding. Практически в основе всех классификаций лежат клинические изменения, данные инструментальных методов обследования, длительность заболевания, осложнения. В НМХЦ им. Н.И. Пирогова используется классификация, разработанная Б.В. Петровским и О.Д. Федоровой (1958, 1962 г.) [8, 10].
I стадия – рефлекс раскрытия кардии сохранен, кардия не сужена, непроходимость кардии носит спастический характер; диаметр пищевода не увеличен; кратковременная задержка пищи, иногда срыгивание; моторика усилена; эвакуация пищи замедленна, но полная; общее состояние не страдает; II стадия – рефлекс раскрытия кардии отсутствует; пищевод несколько расширен до 3–4 см; эвакуация пищи замедленна; прогрессирует дисфагия; больные вынуждены запивать твердую пищу, искать удобную позу; состояние больных улучшается после опорожнения пищевода; III стадия – стойкое отсутствие расслабления кардии; наряду с функциональными нарушениями наблюдаются органические изменения пищевода – иногда присоединяются рубцовые изменениями мышечных слоев кардии вследствие чего кардиальный его отдел суживается; происходит дальнейшее расширение выше расположенных сегментов пищевода, пищевод супрастенотически расширен до 6–8 см, при рентгеноскопии симптом отсутствия газового пузыря желудка; задержка пищи и жидкости; пропульсивная моторика отсутствует; страдает общее состояние больного, наступает потеря массы тела и снижается трудоспособность; IV стадия – резко выраженный стеноз кардии; максимальное расширение пищевода более 8 см, удлинение и S-образное искривление пищевода с атонией стенок, он приобретает мешковидную форму; перистальтика отсутствует; стенки пищевода истончены; пищевые массы и жидкость задерживаются в пищеводе многие часы и даже сутки, в следствии их разложения присоединяются явлениями застойного эзофагита с участками некроза и изъязвлениями; может развиваться периэзофагит и фиброзный медиастинит; наступает истощение больных.
Диагностические инструментальные методы обследования
Основными методами диагностики АК является рентгенологическое исследование, эзофагогастродуоденоскопия и эзофагоманометрия.
Рентгенологическое исследование. Рентгеносемиотика АК достаточно характерна и не вызывает особых трудностей. Начинать рентгенологическое обследование пациентов целесообразно с обзорного снимка органов грудной клетки. Важным признаком АК является отсутствие газового пузыря желудка – при других заболеваниях этот симптом фактически не встречается, его можно наблюдать только при массивных опухолях фундального отдела желудка, а также после гастрэктомии [1]. Конечно, более ценную информацию удается получить в результате контрастирования пищевода бариевой взвесью. При этом отмечаются три основных признака: задержка бариевой взвеси над кардией, расширение пищевода и изменение его формы.
Сужение дистального отдела пищевода и НПС воронкообразное, нередко расположено эксцентрично, напоминающее по внешнему виду «кончик моркови» или «мышиный хвост» или «птичий клюв» [26] (рис. 2). В желудок бариевая взвесь поступает порционно лишь при достаточном заполнении ею пищевода. Примерно у 10% больных АК супрастенотическое расширение пищевода принимает мешковидную форму и расширяется до 16–18 см и более. Для АК характерна положительная проба Хурста (А. Hurst), когда начало опорожнения пищевода происходит вне акта глотания и зависит от высоты столба бариевой взвеси, то есть наступает при повышении показателя гидростатического давления: кардия раскрывается, и столб контрастного вещества как бы проваливается в желудок широкой струёй. На присоединение застойного эзофагита указывают изменения рельефа слизистой оболочки – зернистость, утолщение и извитость складок.
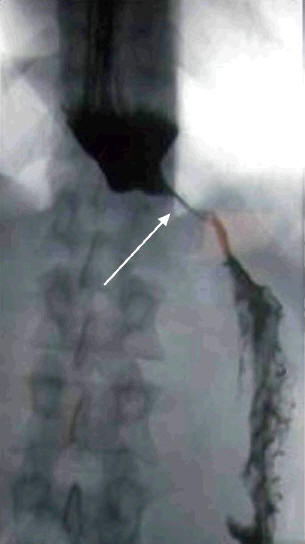
Рис. 2. Рентгенограмма. Ахалазия кардии II стадии
Пищевод расширен, кардиальный сегмент пищевода сомкнут (указан стрелкой) (внешний вид – «мышиный хвост» или «кончик моркови»), бариевая взвесь из пищевода в желудок поступает небольшими порциями. Газовый пузырь желудка отсутствует.
Эзофагогастродуоденоскопия (ЭГДС). Всем пациентам с признаками дисфагии и подозрением на ахалазию необходимо выполнение эндоскопии. ЭГДС является незаменимым методом для исключения вторичной ахалазии вследствие опухолевой или рубцовой стриктуры [15]. Если эндоскопические находки характерны для АК, то, как правило, взятие биопсии не требуется [22]. При подозрении же на злокачественное образование, прицельная биопсия с последующим морфологическим исследованием сомнительного участка обязательна [6]. В отделении эндоскопии НМХЦ им. Н.И. Пирогова принято описание эндоскопической картины АК, предложенной Ю.И. Галлингером и Э.А. Годжелло [2], основанной на классификации Б.В. Петровского [8]. Накануне ЭГДС рекомендовали промывание пищевода через желудочный зонд – это позволяло детально осмотреть пищевод и помогало проведению эндоскопического лечения, особенно у пациентов с III–IV стадией АК.
При эзофагоскопии у пациентов с АК грудной отдел пищевода может быть нормальным или дилатированным, часто извитым, атоничным, в просвете, как правило, наличие пищевых масс, жидкости и слизи (рис. 3).
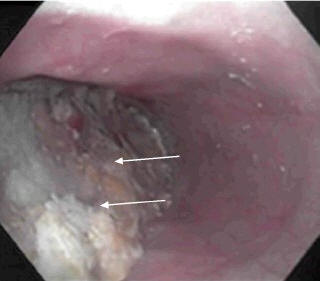
Рис. 3. ЭГДС. Ахалазия кардии III стадии. Пищевод расширен в грудном отделе, в просвете пищевода большое количество застойного содержимого, слизь (указаны стрелками)
Слизистая иногда с признаками застойного эзофагита, рыхлая, гиперемированная, с эрозиями или изъязвлениями. Характерно, что НПС закрыт, даже при инсуфляции воздухом, однако эндоскоп с легким нажимом может легко пройти эту область.
Эзофагоманометрия. Большую ценность при заболеваниях пищевода, в частности АК, имеет эзофагоманометрия. Главным признаком ахалазии при манометрии является отсутствие рефлекса глотательного раскрытия кардии (регистрируется прямая линия с наложением на нее дыхательных колебаний вместо характерной волны, направленной вниз), повышение в той или иной степени тонуса НПС, а также нарушения перистальтики грудной части пищевода.
До последнего времени исследование двигательной функции пищевода возможно было с использованием открытых катетеров (водно – перфузионная манометрия), которая проводится при помощи отечественного прибора «Гастроскан–Д». Для диагностики АК этот метод вполне достаточен, однако в настоящее время внедряется в практику метод манометрии высокой разрешающей способности с формированием объемного 3D-изображения [4].
Лечение
Современные методы лечения АК направлены на улучшение прохождения пищи через пищеводно-желудочный переход посредством расширения кардии или снижения ее тонуса [11]. Фармакологическая терапия является наименее эффективным вариантом лечения АК и редко дает долгосрочные положительные результаты. Интрамуральное введение ботулинового токсина носит кратковременный лечебный эффект, неоднократные процедуры приводят к воспалительной реакции на уровне кардии, могут вызывать подслизистый фиброз, что значительно затруднит неизбежное последующее хирургическое лечение [18].
В мировой практике существует два основных общепринятых метода лечения АК – хирургический и эндоскопический. Однако вопрос о предпочтении одного из этих двух методов, по данным литературы, до сих пор не решен и дискуссия по этому вопросу продолжается. Одни ученые считают, что ЭБПКД является методом первой линии лечения ахалазии, другие, что дилатация является «методом спасения» для больных, отказавшихся от операции или имеющих к ней противопоказания [19, 13, 22, 23 и др.].
ЭБПКД применяется в среднем у 75% больных с АК, при условии начала лечения на ранних стадиях заболевания [20]. Баллоны имеют три размера – 30, 35 и 40мм, они расположены на гибком катетере, который устанавливается в пищевод по струне-проводнику, проведенному через эндоскоп.
С особой осторожностью баллонная дилатация выполняется у пациентов с наличием эпифренального дивертикула, крупные размеры которого могут быть относительными противопоказаниями к данной методике. Баллонная дилатация противопоказана у пациентов с подозрением на злокачественные процесс в области абдоминального отдела пищевода и кардии [7].
Наиболее грозным осложнением ЭБПКД является перфорация стенки пищевода (1–2%) и кровотечение (2–5%) [23]. Большинство перфораций , как правило, происходит после первого сеанса дилатации, связаны с неверным позиционированием и выбором баллона сразу максимального диаметра.
Мета-анализ 29 исследований, проведенный D.A. Katzka и D.O. Castell [16], по оценке пневматической дилатации при АК, выявил у 88% больных эффективность одного курса в течение 1-го года, которая постепенно уменьшалась с течением времени до 70 и 29% через 5 и 10 лет, соответственно. За больными наблюдали через 1, 2, 3, 5 и 10 лет. Хотя полученные результаты указывают на снижение эффективности и проявления рецидива АК со временем, периодические повторные сеансы дилатации позволяют получить хороший ответ у 81–93% пациентов даже через 6–10 лет.
В группе из 21 исследования эффективность однократной дилатации через один год составила 66%. Эффективность уменьшается через 2, 3 и 5 лет наблюдения до 60, 53 и 50%, соответственно. В тех немногих исследованиях, в которых были представлены 10-летние данные (497 пациентов), эффективность однократного сеанса дилатации составила 25%. В отличие от этого, в четырех исследованиях показано, что у пациентов, у которых при первом курсе было два или более сеансов дилатаций, ремиссия наблюдалась у 92, 84, 78 и 64% в течение наблюдения за 1, 2, 3 и 5 лет [15].
По литературным данным, неблагоприятными прогностическими факторами баллонной дилатации являются – возраст менее 40 лет, мужской пол, дилатация только 30-мм баллоном, наличие осложнений со стороны органов дыхания, возникновение быстрого рецидива после трех курсов ЭБПКД [13].
Дискутабельным и малоизученным остается вопрос о возникновении желудочно-пищеводного рефлюкса после ЭБПКД. Этот вопрос на данный момент мало изучен, например, в одном исследовании у 13(30%) пациентов из 42 наблюдалась повышение кислотности в пищеводе при рН-метрии, в другом у 19 (27,5%) из 69 больных, что потребовало постоянного приема ингибиторов протонной помпы. У 5 из них (7%) при эндоскопии отмечали появление эзофагита [14, 18].
Литературный материал показывает, что ЭБПКД у больных с АК эффективна и достаточно безопасна у пациентов с I–II cтадией, как первый метод применяется и у больных с III стадией, а при неэффективности ЭБПКД у больных с II–III оптимальным методом лечения является эзофагокардиомиотомия с фундопликацией. У пациентов с IV стадией АК ввиду высокой частоты рецидивов заболевания, связанных с возникновением полной атонии и резкого расширения пищевода, органосохраняющие операции оказываются малоэффективными. Предпочтение в лечении этой группы больных отдается субтотальной резекции пищевода с одномоментной пластикой желудочной трубкой [12, 13, 14].
Материалы и методы
В НМХЦ им. Н.И. Пирогова в 2010–2014 гг. с АК находились на лечении 37 пациентов (20 мужчин и 17 женщин) в возрасте от 24 до 83 лет (средний возраст 50,5).
Диагноз АК был поставлен на основании клинической картины, данных эндоскопического и рентгенологического методов обследования.
Распределение больных по стадиям: I – 6 (16,2%), II – 12 (32,4%), III – 13 (35,2%), IV стадия – 6 (16,2%).
31 пациенту с АК I-III стадии произведена ЭБПКД, двум больным с АК III стадии потребовалась кардиомиотомия по Хеллеру c фундопликацией (в одном случае с применением РХК «Da Vinci») так как после 3-х курсов ЭБПКД у них возник рецидив, у пациентов с IV стадией двум пациентам сделана баллонная дилатация (из-за противопоказаний к операции), а 4-м – субтотальная резекция пищевода с одновременной пластикой желудочным трансплантантом.
Всем пациентам оформляли информированное добровольное письменное согласие на процедуру. ЭБПКД выполняли под внутривенной седацией. Перед проведением ЭБПКД пневматический механизм проверяли на герметичность. Под контролем видеоэндоскопа баллонный дилататор Wilson-Cook 30 мм, длиной 10 см проводили по струненаправителю в пищевод (рис. 4).

Рис. 4. Баллонный дилататор – 1, манометр – 2, струна-проводник – 3
Баллонный дилататор устанавливали таким образом, чтобы его средняя часть оказывалась точно в области пищеводно-желудочного перехода (рис. 5). Экспозиция баллона – 10–15 мин., давление в баллоне – до 1 атм. Сеансы дилатации проводили от 2 (у 10 пациентов) до 4 раз (у 6 пациентов) с интервалом в 2–3 дня. Первый сеанс выполняли в условиях рентгеноперационной, воздух нагнетали постепенно, до исчезновения «талии» баллона. Последующие сеансы осуществляли в условиях эндоскопического кабинета и процесс расширения баллона контролировали визуально, так как иногда пневматический расширитель мог полностью проскальзывать в пищевод или желудок (рис. 6). После извлечения баллона, при контрольной эзофагогастроскопии, проводили тщательную ревизию зоны дилатации на предмет дефектов слизистой оболочки пищевода, кардиального отдела желудка и кровотечения из них (рис. 7).
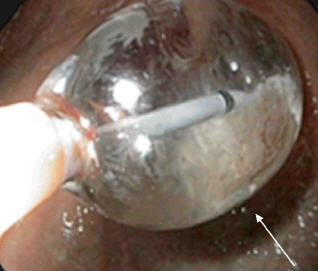
Рис. 5. ЭГДС. Баллонный дилататор в пищеводе (указан стрелкой)
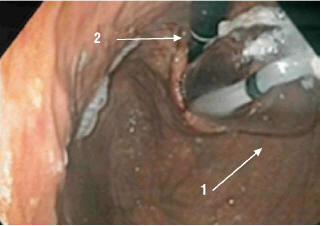
Рис. 6. ЭГДС. Ретропозиция из желудка – баллонный дилататор (1) и эндоскоп (2), проведенный через кардиоэзофагеальный переход (указаны стрелками)
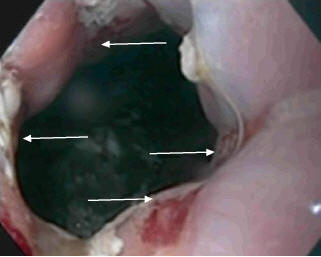
Рис. 7. ЭГДС. Продольные дефекты слизистой нижнего пищеводного сфинктера пищевода после сеанса ЭБПКД (указаны стрелками)
С целью профилактики развития рефлюкс-эзофагита всем пациентам, перенесшим ЭБПКД, назначали механически и термически щадящую диету, медикаментозное лечение. Рекомендовали питание без кислых фруктовых соков, продуктов, усиливающих газообразование, а также жиров, шоколада, кофе, чеснока, лука, перца. Пациентам следовало исключить употребление острой, горячей или холодной пищи, сильно газированных напитков и алкоголя.
Для защиты слизистой кардиального отдела пищевода от агрессивного влияния желудочного сока создавали, так называемую, «биологическую повязку» в области вмешательства с помощью антацидных средств – назначали магния гидроксид 4,0 г 3 раза в день в течение 10 дней. В целях предотвращения заброса кислого содержимого в пищевод, для снятия избыточного давления в желудке и уменьшения объема секреции назначали курс антисекреторных препаратов – ингибиторов протонной помпы (ИПП) 40 мг 1 раз в день в течение 8 недель, затем 20 мг 1 раз в день в течение 6 недель.
Полученные результаты
Успех ЭБПКД оценивали клинически по снижению выраженности симптомов заболевания и рентгенологически по скорости эвакуации контрастного вещества из пищевода. Для этого каждому пациенту после курса ЭБПК выполняли контрольную рентгеноскопию пищевода с барием (рис. 8).
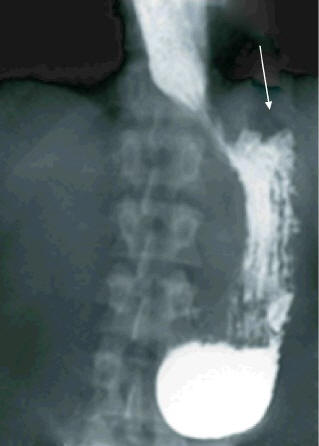
Рис. 8. Рентгенограмма. После 3-х сеансов ЭБПКД. Нет задержки контрастного вещества в пищеводе, бариевая взвесь свободно проходит в желудок. Виден газовый пузырь желудка (указан стрелкой)
Положительный эффект кардиодилатации отмечен у 31 из 33 (93,9%) больных, отсутствие эффекта у 2 (6,1%) пациентов. Осложнение возникло в 1-м (3,0%) случае – активное кровотечение из линейных разрывов слизистой пищевода, которое остановили с применением местного эндоскопического гемостаза. Поверхностные линейные дефекты слизистой с просачиванием крови, остановившемся самостоятельно, могут быть критериями успешно проведенной дилатации. Других осложнений не было. Три пациента чувствовали тянущую боль за грудиной средней интенсивности, которая купировалась самостоятельно через 2–3 дня, без дополнительного назначения анальгетиков.
Повторные курсы проводили от 2-х до 3-х раз, через 8–12 месяцев, ориентируясь на клиническую картину. Рецидивов через 6 месяцев у больных не отмечено, при контрольном осмотре через 1 год лишь 3-м пациентам (9,0%) потребовался повторный курс ЭБПКД.
Заключение
Таким образом, результаты проведенного исследования показали, что лечение больных с АК следует начинать с миниинвазивных методов. Использование техники эндоскопической баллонной пневмокардиодилатации позволяет достигать хороших результатов в лечении больных с АК 1–3 стадии в 90% наблюдений. ЭБПКД, по нашему мнению, останавливает прогресс ахалазии, курсы дилатации, при необходимости, можно повторять, после нее редко развивается рефлюкс-эзофагит, при условии назначения антирефлюксной терапии. По нашему опыту, в большинстве наблюдений, необходимо выполнение от 1-го до 3-х курсов, включающих 2–3 сеанса ЭБПКД.
Однако, если рецидив возникает после трех курсов ЭБПКД, то это является показанием к выполнению оперативного лечения – кардиомиотомии с полноценной фундопликацией. При неэффективности эндоскопических методов лечения у больных с АК IV стадии показана субтотальная резекция пищевода с одномоментной пластикой желудочной трубкой.
Литература
- Василенко В.Х. Ахалазия кардии / Суворова Т.А., Гребенев А.Л. – М.: Медицина, 1976. – 280 с.
- Галлингер Ю.И. Результаты эндоскопических вмешательств у больных с кардиоспазмом и ахалазией кардии: тез. докл. 5–го Всероссийского съезда по эндоскопической хирургии / Галлингер Ю.И., Годжелло Э.А. // Эндоскопическая хирургия. – 2002. – Т. 2. – С. 26–27.
- Гребнев А.Л. Двадцатилетний опыт лечения ахалазии кардии / Гребнев А.Л., Нечаев В.М. // Клиническая медицина. – 1987. – № 6. – С. 44–50.
- Евсютина Ю.В. Ахалазия кардии: современные представления об этиологии, патогенезе, клинической картине и диагностике / Евсютина Ю.В., Сторонова О.А., Трухманов А.С., Ивашкин В.Т. // РЖГГК. – 2014. – № 6. – С. 4–12.
- Ивашкин В.Т. Болезни пищевода / Ивашкин В.Т., Трухманов А.С. -М.: Триада-Х, 2000. – 178 с.
- Ивашкин В.Т. Гастроэнтерология: Национальное руководство / Ивашкин В.Т., Лапина Т.Л. -М.: ГЭОТАР, 2011. – 480 с.
- Муравьев М.В. Эндоскопическое лечение ахалазии кардии / Муравьев М.В., Бурмистров А.И., Иванов А.И. // Эндоскопия. – 2013. – № 2. – С. 30.
- Петровский Б.В. Кардиоспазм и его хирургическое начение / Труды 27-го Всесоюзного съезда хирургов М. – 1962. – С.162–173.
- Трухманов А.С. Тактика комплексного лечения ахалазии кардии: автореф. дис. канд. мед. наук. – 1995. – С. 24.
- Федорова О.Д. Кардиоспазм. -М.: Медицина, 1973. – 184 с.
- Черноусов А.Ф. Хирургия пищевода: Руководство для врачей / Черноусов А.Ф., Богопольский П.М., Курбанов Ф.С. -М.: Медицина, – 2000. – 352 с.
- Черноусов А.Ф. Ахалазия кардии и кардиоспазм – современные принципы лечения / Черноусов А.Ф., Хоробрых Т.В., Ветшев Ф.П. // Анналы хирургии. – 2012. – № 3. – С. 5–10.
- Ates F. The pathogenesis and management of achalasia: Current Status and Future Directions / Ates F., Vaezi M.F. // Gut and Liver. – 2015. Т. 9. № 4. С. 449–463.
- Bravi I. A pneumatic dilation strategy in achalasia: prospective outcome and effects on oesophageal motor function in the long term/ Bravi I., Nicita M.T., Duca P. // Alimentary Pharmacology & Therapeutics. – 2010. – Т. 31, № 6. – P. 658–665.
- Hallal C.K. Diagnosis, misdiagnosis, and associated diseases of achalasia in children and adolescents: a twelve-year single center experience / Hallal C.K., Carlos O.N. // Pediatric Surgery International. – 2012. – Т. 28, № 12. – P. 1211–1217.
- Katzka D.A. Review article: an analysis of the efficacy, perforation rates and methods used in pneumatic dilation for achalasia / Katzka D.A., Castell D.O. // Alimentary Pharmacology & Therapeutics. – 2011. – Т. 34, № 8. – P. 832–839.
- Park W. Etiology and pathogenesis of achalasia: the current understanding / Park W., Vaezi M.F. // The American journal of gastroenterology. – 2005. – Т. 100, № 6. – P. 1404–14.
- Patel D.A. Idiopathic (primary) achalasia: a review rare gastrointestinal diseases/ Patel D. A., Kim H. P., Zifodya J. S., Vaezi M. F. // Orphanet Journal of Rare Diseases. – 2015. – Т. 10, № 1. – P. 1–14.
- Richter J.E. Management of achalasia: surgery or pneumatic dilation / Richter J.E., Boeckxstaens G.E. // Gut. – 2011. – Т. 60, № 6. – P. 869–876.
- Sinan H. Prevalence of respiratory symptoms in patients with achalasia / Sinan H., Tatum R. P., Soares R. V.// Diseases of the Esophagus. – 2011. – Т. 24, № 4. – P. 224–228.
- Williams T. Pharmaceutice ratioalis sive diatribe de medicamentarum operationibus in humano corpore. -London: Hagia Comi, 1674.
- Vaezi M.F. ACG clinical Guideline: diagnosis and management of achalasia / Vaezi M.F., Pandolfino J.E., Vela M.F. // The American Journal of Gastroenterology. – 2013. – Т. 108, № 8. – P. 1238–1249.
- Vela M.F. The long-term efficacy of pneumatic dilatation and Heller myotomy for the treatment of achalasia / Vela M.F. et. al. // Clinical gastroenterology and hepatology. – 2006. – Т. 4, № 5. – P. 580–7.
Статья опубликована на сайте http://www.gastroscan.ru
материал с сайта MedLinks.ru