Введение
Каждый ребенок в России и мире, особенно в первые 5 лет жизни, в течение года переносит несколько эпизодов острых лихорадочных заболеваний [1–3]. Острые респираторные вирусные инфекции и острые кишечные инфекции (ОКИ) занимают основное место в структуре заболеваемости у детей [1–5]. Заболеваемость инфекционными диареями в 2022 г. практически достигла показателей, характерных для допандемического (COVID-19) периода, и составила 403,38 случая на 100 тыс. населения (сумма всех ОКИ установленной и неустановленной природы). Следует отметить, что инфекционные диареи причиняют огромный экономический ущерб, при этом в официальную статистику включаются большей частью данные о пациентах из очагов и вспышек диарейных заболеваний и сведения о госпитализированных пациентах с кишечными инфекциями. Заболеваемость острыми гастроэнтеритами у детей значительно выше, чем у взрослых, а большинство зарегистрированных случаев приходится на детей до 7 лет. 49% случаев ОКИ расшифрованной этиологии в 2022 г. приходится на ротавирусную инфекцию, при этом заболеваемость (61,7 на 100 тыс. населения) остается ниже среднего многолетнего уровня (75,60) за период 2010–2019 гг., а удельный вес случаев норовирусной инфекции среди инфекционных диарей установленной этиологии составил 23,9% и продолжает расти из года в год1.
В педиатрической практике при различных инфекционных заболеваниях, в особенности при кишечных инфекциях, тяжесть состояния пациента определяется степенью выраженности следующих симптомов и синдромов:
-
общеинфекционный синдром (лихорадка, интоксикация, вялость, адинамия);
-
синдром дегидратации (эксикоз), включая метаболический ацидоз и электролитные расстройства;
-
синдром местных изменений (характер и кратность диареи, рвоты, метеоризма, болевого абдоминального синдрома, пареза кишечника) [6, 7].
При острых гастроэнтеритах жизнеугрожающие состояния в первую очередь связаны с обезвоживанием из-за быстро нарастающих потерь воды и электролитов со рвотой и жидким стулом. Вследствие обезвоживания нарушаются центральная и периферическая гемодинамика и все виды обмена веществ, в клетках и межклеточном пространстве накапливаются токсические метаболиты, которые оказывают воздействие на органы и ткани больных.
Считается, что частое возникновение эксикоза (синдром дегидратации) у детей обусловлено анатомо-физиологическими особенностями макроорганизма ребенка: относительно высокое содержание воды в организме, незрелость регуляторных механизмов, частый отказ от еды и питья при нарушении самочувствия, особенно у детей раннего возраста [6, 7]. В условиях инфекционных заболеваний, сопровождающихся лихорадкой, а также потерей жидкости со рвотой, диареей перечисленные факторы ведут к быстрому срыву адаптационных механизмов и декомпенсации функций органов и систем. Исход болезни будет определяться своевременностью лечебных мероприятий, направленных на устранение возникших расстройств метаболизма [8, 9].
При неправильном возмещении патологических потерь при ОКИ (неверный выбор раствора для регидратации, чрезмерно высокая скорость компенсации потерь), помимо гипонатриемии, может развиться отек легких, отек головного мозга, синдром диссеминированного внутрисосудистого свертывания, острая почечная недостаточность.
Согласно международным консенсусам по лечению острых гастроэнтеритов, в странах с уровнем экономики выше среднего инфекционные диареи заканчиваются выздоровлением за 1–3 дня у большинства пациентов. Диареи представляют опасность исключительно для детей раннего возраста и лиц с отягощенным преморбидным фоном. В международных консенсусах единственным эффективным лечебным мероприятием считается восстановление водно-электролитного баланса с помощью оральной регидратации, тогда как парентеральное введение жидкости рекомендовано исключительно в случае тяжелой дегидратации [4, 6, 7]. Отечественные руководства, в том числе действующие клинические рекомендации по оказанию медицинской помощи детям, основополагающим принципом декларируют патогенетический подход к лечению ОКИ, включающий: регидратацию (оральную, при необходимости в сочетании с инфузионной терапией), диетическую коррекцию и нутритивную поддержку, цитомукопротективные средства или энтеросорбенты и назначение пробиотиков (препаратов с доказанной клинической эффективностью) с первого дня терапии [8, 9]. Однако, несмотря на все прилагаемые усилия по лечению и профилактике ОКИ, 50-летний успех применения растворов для пероральной регидратации, инфекционные диареи, к сожалению, остаются второй по значимости причиной смертности среди детей в возрасте до 5 лет в мире [1, 10, 11].
Кроме этого, известно, что лечение детей с инфекционной диареей, особенно в странах с уровнем экономического развития ниже среднего, включает не только оральные регидратирующие растворы (ОРР), но и высокие дозы цинка как важнейшего дополнения к ОРР, цинк служит для дальнейшего уменьшения продолжительности и тяжести диареи, предупреждает ее повторные случаи в ближайшее время [12, 13].
Хотя широкое внедрение оральной регидратации стало неоценимым достижением в снижении детской смертности, его внедрение во всем мире отстает по сравнению с другими доказательными методами лечения. Так, в то время как глобальный охват вакцинацией достиг 85%, охват ОРР существенно отстает и составляет 42% [12, 14, 15].
Оральная регидратация и дотация цинка экономически эффективны, доступны и просты в реализации. Однако число детей в возрасте до 5 лет с диареей, которые получают рекомендованное лечение ОРР, слишком невелико во всех регионах. В странах Африки к югу от Сахары прогресс в этом важном вмешательстве в течение последнего десятилетия был медленным: охват составил 34% в 2012 г. и 40% в 2022 г. [14, 16].
Несмотря на то, что назначение ОРР в нашей стране включено в критерии качества оказания медицинской помощи и в действующие клинические рекомендации, в практическом здравоохранении до настоящего времени отмечаются ошибки в назначении ОРР (отказ от низкоосмолярных ОРР и проведение регидратации бессолевыми растворами, использование нормоосмолярных растворов, неверное разведение глюкозо-солевых растворов), необоснованная инфузионная терапия. Все вышеперечисленные недостатки обосновывают необходимость проведения исследований по эффективности низкоосмолярных ОРР у детей различного возраста. В доступных источниках достаточно работ по сравнительной эффективности низкоосмолярных и нормоосмолярных ОРР, и мы провели другой вариант сравнительного исследования [9, 17, 18].
Цель исследования: сравнить эффективность оральной регидратации низкоосмолярным раствором с цинком и инфузионной терапии солевыми и глюкозо-солевыми растворами у детей, переносящих вирусные гастроэнтериты (ВГЭ), осложненные синдромом дегидратации 1–2-й степени и 2-й степени.
Содержание статьи
Материал и методы
Оценка эффективности инновационных подходов к оральной регидратации с использованием растворов со сниженной осмолярностью проводилась в ходе проспективного открытого сравнительного рандомизированного клинического исследования, выполненного в отделении кишечных инфекций ФГБУ ДНКЦИБ ФМБА России. Исследование направлено на установление оптимальной тактики лечения с целью снижения необходимости проведения парентеральной инфузионной терапии как инвазивной и психотравмирующей процедуры и было одобрено локальным этическим комитетом при ФГБУ ДНКЦИБ ФМБА России (протокол № 6 от 23.06.2019).
Критериями включения в исследование являлись:
-
детский возраст c 6 месяцев до 6 лет;
-
установленный на основании клинических данных (лихорадка, интоксикация, рвота, водянистая диарея, возникновение болезни в характерный сезон (холодное время года), отсутствие поражения толстого кишечника клинически и лабораторно) и верифицированный лабораторными методами диагноз ОКИ вирусной этиологии;
-
ранние сроки госпитализации в стационар (не более 2 сут от начала заболевания);
-
отсутствие указаний в анамнезе на аллергические реакции на препараты;
-
отсутствие тяжелой соматической патологии;
-
подписание родителями пациента добровольного информированного согласия на участие в исследовании.
Рандомизация осуществлялась случайным образом путем чередования распределения пациентов, отвечающих критериям включения, по группам в порядке поступления больных в стационар. Базисная терапия в сравниваемых группах была сопоставима и включала в себя энтеросорбенты (лигнин гидролизный или диосмектит), пробиотики и симптоматическую терапию (противорвотные средства, спазмолитические и жаропонижающие препараты).
В клиническом исследовании приняли участие 79 пациентов в возрасте от 6 месяцев до 6 лет, больных ОКИ и госпитализированных в отделение кишечных инфекций в 1–2-е сутки болезни в состоянии средней степени тяжести.
Все дети были распределены в 2 группы: основную (n=45) — с использованием в терапии низкоосмолярных растворов (Адиарин® Регидрокомплекс®, в 1 саше: углеводы 2,84 г, глюкоза 2,82 г, хлориды 0,453 г, цинк 0,003 г, осмолярность: 245 мОсмоль/л, схема дозирования приведена в таблице 1) и группу сравнения (n=34) — с использованием инфузионной терапии глюкозо-солевыми растворами.
Тяжесть острого гастроэнтерита оценивалась по модифицированной шкале Везикари, где легкая степень тяжести заболевания — 0–8 баллов, средняя степень тяжести — 9–11 баллов, более 11 баллов — тяжелая степень тяжести. Использование данный шкалы помогает объективизировать тяжесть состояния больного ВГЭ [5, 6].
Лабораторная диагностика включала клинический анализ крови, общий анализ мочи, копрологическое исследование, биохимическое исследование крови (определение уровня мочевины, креатинина, трансаминаз, амилазы, глюкозы, основных электролитов в сыворотке крови). Нормы гематологических показателей определялись в соответствии с рекомендованными нормативами Руководства по амбулаторно-поликлинической педиатрии под ред. А.А. Баранова [19].
Этиологическая верификация ОКИ осуществлялась путем забора биологического материала у пациента (фекалии, мазок из прямой кишки) при поступлении в стационар, использовалась молекулярно-генетическая диагностика. Сбор фекалий для исследования осуществляли в первые сутки госпитализации. Образцы собирали согласно методическим указаниям МУ 1.3. 1794–03 «Организация работы при исследованиях методом полимеразной цепной реакции материала, инфицированного микроорганизмами I–II групп патогенности». Тестирование собранных образцов фекалий выполняли с использованием реагентов АмплиСенс® Rotavirus/Norovirus/Astrovirus-FL или АмплиСенс® ОКИ скрин-FL методом ПЦР с гибридизационно-флуоресцентной детекцией производства «Интерлабсервис» (Москва) в лаборатории ФГБУ ДНКЦИБ ФМБА России.
Всем пациентам с целью восполнения сформировавшегося дефицита жидкости и электролитов, а также купирования продолжающихся патологических потерь, после осмотра и заполнения первичной документации, рассчитывался объем и скорость проведения инфузионной терапии солевыми и глюкозо-солевыми растворами. Назначение инфузионной терапии ребенку в обеих группах проводилось в соответствии с расчетом суточной потребности в жидкости на основании данных о массе тела, возрасте, сформировавшемся дефиците жидкости и патологических потерях (лихорадка, рвота, жидкий стул).
Критериями отбора детей в основную группу стали выявившаяся в процессе проведения лечения техническая невозможность катетеризации периферической вены (n=19, 42,2±7,3%), отказ законного представителя ребенка от проведения инфузионной терапии (n=11, 24,4%±6,4) и осложнения проведения инфузионной терапии, такие как экстравазальное попадание периферического катетера (n=6, 3,33%±2,6), аллергическая реакция на внутривенные растворы (n=3, 6,66%±3,7) и самопроизвольное удаление периферического катетера ребенком (n=6, 13,33%±5,0). После проведения подробной беседы с законным представителем и оценки комплаентности возможной оральной регидратации осуществлялось пероральное введение ОРР в течение 6 ч по схеме в соответствии с массой тела пациента с мониторингом состояния и оценкой эффективности проводимой терапии.

Статистическая обработка материала проведена с помощью программы Statistica for Windows, v. 10 (StatSoft, США) с использованием параметрических и непараметрических критериев. Для каждой группы вычислены: частота встречаемости признака (для дискретных признаков), среднее значение показателя (M), стандартное отклонение (σ), ошибка среднего (m). Для определения достоверности различий в двух сравниваемых выборках использовали t-критерий Стьюдента, ранговый U-критерий Вилкоксона — Манна — Уитни. Сравнение частоты встречаемости признаков в группах выполняли с помощью χ2-критерия Пирсона и точного метода Фишера.
Результаты и обсуждение
Характеристика пациентов из обеих групп (пол, возраст, тяжесть и этиология ВГЭ, а также степень дегидратации и этиология ОКИ) представлены в таблице 2.
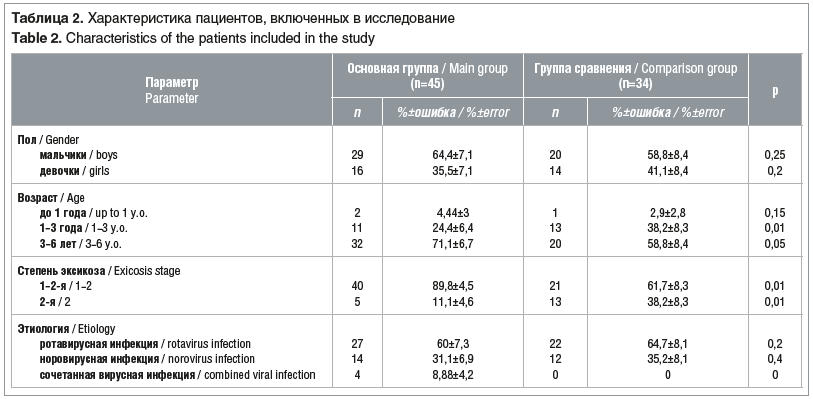
Все пациенты поступали в стационар с явлениями дегидратации 1–2-й степени и 2-й степени в 1–2-е сутки болезни. Средний показатель тяжести состояния пациентов по интегральной шкале Везикари составил для ВГЭ 13,26±0,7 балла, что соответствует средней степени тяжести. Патологические потери в обеих группах были представлены рвотой, жидким стулом, лихорадкой, которые и послужили причиной госпитализации в стационар. Распределение основных общих и местных симптомов ВГЭ в сравниваемых группах пациентов описано в таблице 3.
Общеинфекционные симптомы статистически значимо чаще встречались в группе сравнения: вялость 91,1±4,8% и лихорадка 85,2±6,0%. Рвота статистически значимо чаще наблюдалась в основной группе, тогда как потери с жидким стулом были более характерны для группы сравнения (см. табл. 3).
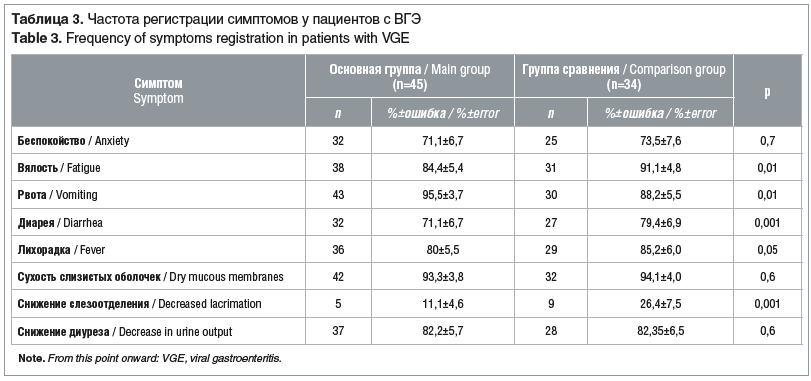
Существенных различий в частоте наличия у пациентов сухости слизистых оболочек и снижения диуреза выявлено не было (см. табл. 3). Время расправления кожной складки на животе также было сопоставимо в сравниваемых группах: 2,1±0,07 с против 1,9±0,08 с. То есть по степени тяжести синдрома дегидратации достоверных различий между группами не имелось.
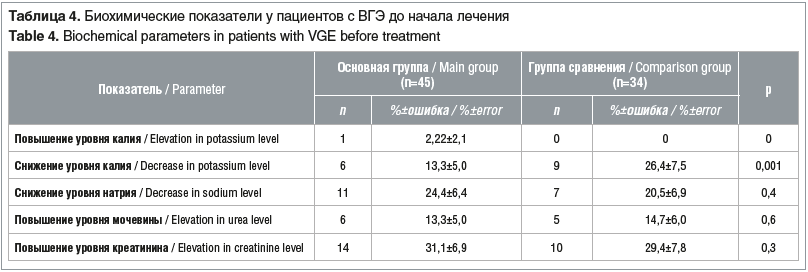
В биохимическом анализе крови исходно у детей из основной группы статистически значимо реже выявлялась гипокалиемия — 13,3±5,0% против 26,4±7,5% в группе сравнения. В обеих группах с одинаковой частотой регистрировалась гипонатриемия, повышение уровня мочевины и креатинина, характерные для дегидратации 1–2-й степени (табл. 4).
У 42 (93,3±4,5%) пациентов основной группы в течение первых 6 ч удалось достигнуть стабилизации состояния и уменьшения объема патологических потерь, в связи с чем ребенку была продолжена оральная регидратация. Активное применение орального регидратационного раствора в таком случае проводили в течение 24–48 ч с оценкой динамики общих и местных симптомов, а также лабораторных показателей водно-электролитного баланса и азотовыделительной функции почек.
В связи с отсутствием должного эффекта от проводимой оральной регидратации, связанным с возобновлением рвоты и невозможностью дальнейших терапевтических манипуляций, из исследования были исключены 3 человека (6,66±3,7%), потребовавших дальнейшего парентерального введения жидкости.
На фоне проведения оральной регидратации в основной группе длительность сохранения лихорадочной реакции была сопоставима по продолжительности с группой сравнения. Нормализация общего самочувствия в виде исчезновения вялости отмечалась в сравниваемых группах в одинаковые сроки (табл. 5).
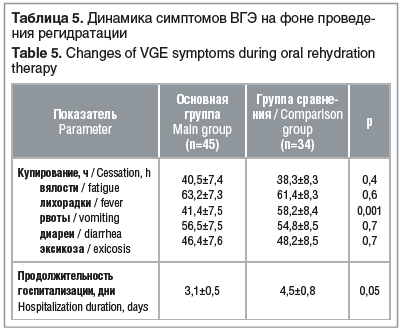
Прекращение рвоты в статистически значимо более короткие сроки было зафиксировано в основной группе. Эксикоз и диарею удалось купировать в основной группе и группе сравнения практически за сопоставимое время.
Для объективизации оценки эффективности проводимой терапии всем пациентам через сутки от начала регидратационной терапии проводился контроль биохимических показателей крови. В основной группе в 90,9±6,4% случаев произошла нормализация уровня натрия, в 83,3±5,0% — нормализация показателей мочевины, в 100% — уровня креатинина. В основной группе длительность госпитализации в стационаре сократилась до 3,1±0,5 дня, в группе сравнения составила 4,5±0,8 дня.
Известно, что уже на протяжении более чем 20 лет Всемирная организация здравоохранения и другие профессиональные ассоциации настаивают на применении в качестве средств оральной регидратации у детей с инфекционной диареей регидратирующих растворов со сниженной осмолярностью (225–245 мОсмоль/л). Однако в повседневной жизни как родители, так и медицинские работники часто используют у детей раннего возраста нормоосмолярные ОРР. Именно осмолярность в диапазоне 225–245 мОсмоль/л улучшает всасываемость жидкости, предотвращает осмотическую диарею, снижает нагрузку на почки, способствует более быстрому купированию диареи и дегидратации. Кроме того, гипотонические ОРР имеют более приятный вкус, что облегчает применение в детской практике.
Одним из низкоосмолярных регидратационных растворов является Адиарин® Регидрокомплекс®, в который входит микроэлемент цинк в дозе 3 мг в одном саше. Цинк обеспечивает дополнительное противовоспалительное, иммуномодулирующее, антисептическое и регенерирующее действие, что способствует купированию диареи и предотвращает повторное инфицирование возбудителями кишечных инфекций в ближайшее время [12, 15]. Помимо этого, препарат содержит дополнительные компоненты — мальтодекстрин, снижающий осмотическую нагрузку на кишечник и обладающий пребиотическим действием, а также диоксид кремния, оказывающий сорбирующее и регенерирующее действие [12, 13, 15].
Таким образом, применение низкоосмолярных растворов с цинком для оральной регидратации у детей с ВГЭ характеризовалось высокой клинико-лабораторной эффективностью и хорошей переносимостью, снизило потребность в парентеральной регидратации на 55,8%, показало высокий профиль безопасности и может быть рекомендовано в стартовой терапии вирусных ОКИ у детей, госпитализированных в стационар.
Заключение
Общеинфекционные (лихорадка, вялость) и местные (рвота и диарея) симптомы ВГЭ, а также синдром дегидратации 1–2-й степени и 2-й степени у детей в возрасте от 6 месяцев до 6 лет купируются при проведении оральной регидратации низкоосмолярным раствором с добавлением цинка так же быстро и эффективно, как и при парентеральном введении солевых и глюкозо-солевых растворов. Применение ОРР помогает избежать возможных осложнений парентерального введения жидкости и психотравмирующей ситуации для маленького пациента. Широкое внедрение в практическое здравоохранение современных ОРР со сниженной осмолярностью будет способствовать снижению частоты госпитализации детей с ВГЭ и другими водянистыми диареями и рациональному использованию ресурсов здравоохранения. Ѓ
1О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2022 году: Государственный доклад. (Электронный ресурс.) URL: https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=25076 (дата обращения: 01.02.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Бехтерева Мария Константиновна — к.м.н., старший научный сотрудник научно-исследовательского отдела кишечных инфекций ФГБУ ДНКЦИБ ФМБА России; 197022, Россия, г. Санкт-Петербург, ул. Профессора Попова, д. 9, литера А; доцент кафедры инфекционных заболеваний у детей ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0003-2923-1630
Комарова Анна Михайловна — младший научный сотрудник научно-исследовательского отдела кишечных инфекций ФГБУ ДНКЦИБ ФМБА России; 197022, Россия, г. Санкт-Петербург, ул. Профессора Попова, д. 9, литера А; ORCID iD 0000-0001-7047-8307.
Контактная информация: Бехтерева Мария Константиновна, e-mail: mkbechtereva@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 18.02.2024.
Поступила после рецензирования 15.03.2024.
Принята в печать 09.04.2024.
ABOUT THE AUTHORS:
Maria K. Bekhtereva — C. Sc. (Med.), Senior Researcher at the Research Department of Intestinal Infections, Children’s Scientific Clinical Center of Infectious Diseases of the Federal Medical Bio-logical Agency of Russia; 9A, Professor Popov str., St. Petersburg, 197022, Russian Federation; Associate Professor of the Department of Infectious Diseases in Children, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0003-2923-1630.
Anna M. Komarova — Junior Researcher at the Research Department of Intestinal Infections, Children’s Scientific Clinical Center of Infectious Diseases of the Federal Medical Biological Agency of Russia; 9A, Professor Popov str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-7047-8307.
Contact information: Maria K. Bekhtereva, e-mail: mkbechtereva@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 18.02.2024.
Revised 15.03.2024.
Accepted 09.04.2024.
Информация с rmj.ru
