Введение
VII фактор свертывания крови (проконвертин) является витамин-К-зависимым, синтезируется преимущественно в печени и циркулирует в плазме крови в концентрации примерно 0,5 мкг/мл (10 нмоль/л). В физиологических условиях внешний путь свертывания крови инициируется взаимодействием между тканевым фактором, воздействующим на просвет сосудов при травме, и VIIa фактором. В комплексе эти два фактора способны активировать IX и X факторы, которые в конечном итоге индуцируют образование стабильного фибринового сгустка. Таким образом, проконвертин является ключевым, начальным звеном в активации каскада «быстродействующего» внешнего пути коагуляционного гемостаза[1] [1].
Дефицит VII фактора свертывания крови — редкое аутосомно-рецессивное геморрагическое заболевание с различной степенью пенетрантности, возникающее вследствие генетически обусловленного снижения активности проконвертина в плазме. Считается, что дефицит VII фактора является наиболее распространенным из редких наследственных нарушений, встречаясь с частотой 1 на 500 000 человек [2, 3].
Впервые дефицит VII фактора описан в 1951 г. у 4-летней девочки с геморрагическим синдромом, присутствующим с рождения. Этническая предрасположенность к заболеванию отмечена у жителей Ирана (93 пациента), имеющих один из самых высоких показателей дефицита проконвертина в мире наряду с самым высоким уровнем заболеваемости, связанной с недостатком XIII фактора [4–6]. Ген VII фактора (F7) расположен на хромосоме 13 (13q34) и состоит из 9 экзонов. На сегодняшний день описано более 220 мутаций в данном гене, бóльшая часть которых является миссенс-мутациями [7]. Несмотря на то, что мутации гена F7 крайне неоднородны, было зарегистрировано несколько наиболее частых, например Ala294Val, 11125del C [8]. Приводятся сообщения о выявлении новых вариантов мутаций, которые могут рассматриваться как патологические, например p.Ala65Gly в экзоне 2 гена F7, c.681+1 G>T и c.C1286T (p.Ala429Val) [9, 10]. Обследование 50 неродственных китайских пациентов с дефицитом VII фактора выявило в гене F7 в общей сложности 25 мутаций, в том числе 18 миссенс-мутаций и 5 мутаций сплайсинга [11, 12]. Изучение спектра мутаций гена F7 методом прямого секвенирования у 54 неродственных пациентов с дефицитом VII фактора в России позволило идентифицировать 24 различные мутации, 5 из которых ранее никогда не диагностировались [13].
Общее число пациентов с дефицитом VII фактора точно не известно. Существуют отдельные публикации, отражающие частоту встречаемости гипопроконвертинемии в различных странах. Национальная база данных Турецкого общества гематологов содержит сведения о 197 пациентах с гипопроконвертинемией [14], в Китае зарегистрировано 193 пациента [15], в Ираке и Пакистане — 24 и 10 пациентов соответственно [16, 17], в Корее — 14 [18]. В России также существует регистр пациентов, регламентированный постановлением Правительства РФ от 26,11.2018 № 1416 (ред. от 15,02.2023), в котором утверждены правила ведения Федерального регистра лиц с различными заболеваниями, включая дефицит VII фактора. По данным ФНКЦ им. Д. Рогачева, в 2019–2022 гг. выявлено 39 детей с дефицитом проконвертина [19, 20].
Заболеванию подвержены как мужчины, так и женщины. Женщины с данной коагулопатией в период беременности и родов должны наблюдаться в специализированных центрах из-за высокого риска развития послеродовых кровотечений [21, 22].
Клиническая симптоматика
Наследственный дефицит VII фактора характеризуется широким спектром клинических фенотипов, варьирующих от бессимптомного состояния (даже у гомозиготных пациентов) до тяжелых, опасных для жизни кровотечений, включая желудочно-кишечные и кровоизлияния в головной мозг, на долю которых приходится 10–15% от всех кровотечений [1]. Тяжелый геморрагический синдром чаще возникает у пациентов с содержанием в плазме VII фактора менее 2%. Полное отсутствие активности VII фактора обычно несовместимо с жизнью, и пациенты умирают вскоре после рождения из-за сильной кровопотери. В то же время имеются данные о том, что четкой зависимости между активностью VII фактора и выраженностью геморрагического синдрома может и не наблюдаться [23]. Так, до трети пациентов с дефицитом проконвертина не имеют клинической симптоматики, и заболевание диагностируется в рамках семейных исследований или скрининговых методов. При манифестных формах гипопроконвертинемии наиболее частыми проявлениями геморрагического синдрома являются носовые кровотечения (60%), кровоточивость десен (34%), кожный геморрагический синдром (36%), меноррагии и овуляторные кровотечения у женщин (69%) [8, 22].
Для новорожденных характерны кровотечения из культи пуповины или внутричерепные кровоизлияния, после обрезания или укола в пятку в неонатальном периоде, в более старшем возрасте — при удалении зубов или травмах в виде гемартрозов [24]. Минимальные уровни VII фактора, способные защитить от кровотечения, колеблются от 8 до 20% [25, 26], при этом нередки случаи бессимптомного течения у пациентов с уровнем VII фактора ниже 1%, а при уровне выше 5% отмечались тяжелые кровоизлияния в анамнезе [23]. Учитывая отсутствие корреляции между уровнем активности VII фактора и тяжестью состояния, врачи-гематологи при выборе тактики ведения пациентов с гипопроконвертинемией рекомендуют ориентироваться в первую очередь на клинические проявления и их выраженность.
Содержание статьи
Диагностика и лечение
Лабораторное тестирование на активность VII фактора является методом первой линии в диагностике его дефицита, включая проведение коагулологического скрининга (увеличение протромбинового времени), определение активности факторов свертывания (изолированное снижение активности VII фактора) [27]. По степени активности фактора выделяют легкую (>10%), среднетяжелую (≤10%) и тяжелую (VII фактор не определяется) формы заболевания[2].
По данным ряда авторов [25, 28], долгосрочная профилактика при дефиците VII фактора не может рассматриваться широко, в отличие от гемофилии, в связи с коротким периодом полураспада VII и VIIa факторов. Длительное введение препарата проводится в случаях повторных эпизодов тяжелых кровотечений из желудочно-кишечного тракта (ЖКТ), кровоизлияний в головной мозг или пациентам с рецидивирующим гемартрозом. Согласно отечественным клиническим рекомендациям2 для купирования или профилактики кровотечений при гипопроконвертинемии проводится специфическая заместительная терапия рекомбинантными препаратами, содержащими VII фактор, или препаратами протромбинового комплекса. Доза VII фактора при развитии кровотечения/кровоизлияния составляет 20–30 МЕ/кг массы тела пациента каждые 4–6 ч вплоть до купирования геморрагического синдрома. С профилактической целью возможно проведение заместительной терапии VII фактором в дозе 10–30 МЕ/кг массы тела пациента 3 р/нед. Частота и длительность профилактического введения препаратов определяются частотой возникающих кровотечений/кровоизлияний в суставы и другие органы, а при значительных нарушениях качества жизни предполагается длительное (до нескольких лет) введение препаратов 3 р/нед. Так, у новорожденных с низким уровнем VII фактора возможно плановое профилактическое введение препаратов в течение года. Свежезамороженная плазма должна использоваться только в исключительных случаях, например при отсутствии препаратов VII фактора.
Представляем собственное клиническое наблюдение пациента с гипопроконвертинемией с ранним дебютом, находившегося на лечении в ГБУ РО «ОДКБ им. Н.В. Дмитриевой».
Клиническое наблюдение
Пациент Г., 15 лет. Из анамнеза: ребенок от первой беременности, протекавшей с токсикозом, обострением хронического пиелонефрита и фетоплацентарной недостаточностью, первых срочных родов. Этническая принадлежность — азербайджанец, наследственность не отягощена. Масса при рождении 3200 г, рост 51 см. С рождения получал искусственное вскармливание. На 4-е сутки жизни в связи с массивным носовым кровотечением поступил в отделение патологии новорожденных. В стационаре верифицировано внутрижелудочковое кровоизлияние, кефалогематома правой теменной кости, анемия. Отмечалось снижение уровня гемоглобина до 65 г/л, показатель сывороточного железа составил 6,3 мкмоль/л, сывороточного эритропоэтина — 1 МЕ/л, ферритина — 1000 нг/мл. В коагулограмме выявлено удлинение активированного частичного тромбопластинового времени (АЧТВ) до 43,2 с и протромбинового времени до 51 с, протромбиновый индекс был снижен до 15,8%. Уровни фибриногена, активность протеина С, антитромбина III в пределах референтных значений. Содержание фактора Виллебранда vWF составило 160% (норма 47,8–173,2%), уровни VIII и IX факторов в пределах нормы.
На первом году жизни у ребенка отмечались эпизоды гематомезиса, мелены, длительные кровотечения из мест забора капиллярной крови и при прорезывании зубов, носовые кровотечения, в связи с чем пациент периодически госпитализировался. При повторных исследованиях гемостаза обнаруживался стабильно низкий уровень протромбинового индекса, удлинение АЧТВ при нормальных уровнях активности VIII и IX факторов. Проводилась терапия раствором менадиона натрия бисульфита тригидрата, аминокапроновой кислотой с положительным эффектом.
В возрасте 3 лет пациенту был установлен диагноз «наследственный дефицит VII фактора (гипопроконвертинемия)». Остаточная активность VII фактора составила 3,4%. Начата терапия «по требованию» при кровотечениях/гем-артрозах препаратом эптаког α (активированный) — рекомбинантный фактор VIIа.
Однако в последующем режим лечения не соблюдался, в связи с чем отмечались неоднократные эпизоды гем-артрозов (голеностопных, коленных, правого локтевого) без связи с травмой. В большинстве случаев за медицинской помощью родители не обращались, лечили самостоятельно мазями и бинтованием. К возрасту 8 лет у пациента сформировались отчетливые контрактуры коленных и голеностопных суставов. На фоне повторных гемартрозов, рецидивирующих носовых кровотечений в анализах крови постоянно отмечалась сидеропения со снижением сывороточного железа до 5–8 мкмоль/л, ферритина до 17–21 мкг/л, гемоглобина до 76–88 г/л. В коагулограмме, при нормальных показателях фибриногена и АЧТВ, оставался стабильно низкий протромбиновый индекс и высокий показатель международного нормализованного отношения.
В возрасте 11 лет у пациента развился самопроизвольный гемартроз правого локтевого сустава, потребовавший госпитализации (см. рисунок). Ультразвуковое исследование и магнитно-резонансная томография выявили схожие деструктивные изменения суставных поверхностей, явления синовита, в правом локтевом суставе скопление негомогенной жидкости с мелкодисперсными включениями.
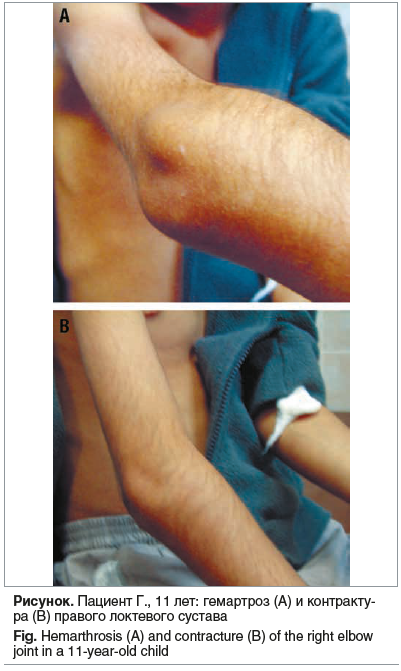
Терапия препаратом эптаког α активированным рекомбинантным в течение 3 нед. позволила купировать клинические проявления, однако через 10 дней после окончания лечения вновь возникла клиника гемартроза правого локтевого сустава. По рекомендации специалистов ФГБУ НМИЦ ДГОИ им. Д. Рогачева был проведен 5-дневный курс концентратом плазменного VII фактора в дозе 50 МЕ/кг с последующим переходом на терапию в режиме «по требованию».
Приверженность проводимому лечению у пациента оставалась недостаточной, препарат вводился нерегулярно, и в возрасте 12 лет подросток вновь был госпитализирован с явлениями гемартроза правого локтевого сустава, потребовавшего длительной гемостатической терапии препаратом эптаког α активированный рекомбинантный в течение 29 дней с положительной динамикой. Было рекомендовано продолжение терапии «по требованию».
Очередное значимое ухудшение состояния возникло в возрасте 15 лет, когда у пациента появились и в течение месяца сохранялись боли в эпигастральной области, нарастающая слабость, снизилась переносимость физических нагрузок. Последние 10 дней до госпитализации отмечался ежедневный стул черного цвета, и с подозрением на желудочно-кишечное кровотечение подросток был доставлен в экстренном порядке в стационар.
При поступлении состояние ребенка расценено как средней тяжести: в сознании, бледный, АД 120/60 мм рт. ст., сатурация 96%, ЧСС 100 в 1 мин, ЧДД 20 в 1 мин. В общем анализе крови: эритроциты 3,83×1012/л, гемоглобин 58 г/л, гематокрит 18,8%, сывороточное железо 1,76 ммоль/л, ферритин 20,6 мкг/мл, анализ кала на скрытую кровь положительный. При проведении фиброгастродуоденоскопии обнаружена рубцующаяся язва двенадцатиперстной кишки — место предположительного состоявшегося желудочно-кишечного кровотечения. В связи с тяжелой постгеморрагической анемией пациенту дважды проводилась гемотрансфузия эритроцитарной массы с последующим назначением внутривенной инфузии железа III сахарозного комплекса. В динамике уровень гемоглобина повысился до 88 г/л, гематокрит — до 27%. Гемостатическая терапия назначена в постоянном режиме препаратом эптаког α активированный рекомбинантный в дозе 4,8 мг 3 р/нед. внутривенно струйно, что позволило купировать острый геморрагический процесс. Дальнейшая длительность приема препарата будет определяться степенью выраженности геморрагического синдрома.
Обсуждение
Гипопроконвертинемия — редкая форма коагулопатии, проявляющаяся схожей с гемофилией клиникой. Своевременная диагностика, уровень VII фактора, адекватность терапии рекомбинантными препаратами определяют течение и прогноз заболевания. У данного пациента с гипопроконвертинемией диагноз был установлен достаточно поздно, в возрасте 3 лет. В периоде новорожденности ребенок перенес массивный геморрагический синдром с кровоизлиянием в головной мозг, кефалогематому. В последующем отмечались спонтанные кровотечения и гемартрозы. Низкая комплаентность, гемостатическая терапия в режиме «по требованию» не позволили достигнуть адекватного гемостаза, в связи с чем у пациента достаточно рано сформировались артропатии и контрактуры нескольких суставов.
Большое значение имеет выбор терапии при интеркуррентных заболеваниях, особенно у пациентов подросткового возраста, с частыми язвенно-воспалительными изменениями ЖКТ. Отсутствие постоянной адекватной гемостатической терапии, несомненно, было весомым фактором развития тяжелого желудочно-кишечного кровотечения на фоне язвенной болезни, что потребовало перевода на длительную заместительную терапию рекомбинантным VII фактором свертывания.
Заключение
Несмотря на то, что дефицит VII фактора свертывания крови встречается редко, серьезность прогноза геморрагического синдрома у детей, особенно в раннем возрасте, определяет важность максимально быстрой верификации причин данного патологического состояния. Особо следует подчеркнуть, что гипопроконвертинемия, как и другие коагулопатии, при отсутствии корректной гемостатической терапии может привести к ранней инвалидизации вследствие формирования артропатий и контрактур, а также к развитию тяжелого жизнеугрожающего кровотечения.
Приведенное нами клиническое наблюдение подтверждает необходимость своевременного назначения адекватного лечения. Без должного соблюдения врачебных назначений болезнь прогрессирует вплоть до тяжелых желудочно-кишечных кровотечений и инвалидизации.
СВЕДЕНИЯ ОБ АВТОРАХ:
Дмитриев Андрей Владимирович — д.м.н., профессор, заведующий кафедрой детских болезней с курсом госпитальной педиатрии ФГБОУ ВО РязГМУ Минздрава России; 390023, Россия, г. Рязань, ул. Высоковольтная, д. 9; профессор кафедры неонатологии им. проф. В.В. Гаврюшова ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-8202-3876.
Федина Наталья Васильевна — к.м.н., доцент кафедры детских болезней с курсом госпитальной педиатрии ФГБОУ ВО РязГМУ Минздрава России; 390023, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORCID iD 0000-0001-6307-7249.
Юдакова Марина Сергеевна — врач-гематолог отделения химиотерапии онкологических и гематологических больных ГБУ РО «ОДКБ им. Н.В. Дмитриевой»; 390023, Россия, г. Рязань, ул. Интернациональная, д. 1 «з»; ORCID iD 0009-0009-7040-2690.
Дронова Светлана Николаевна — врач-онколог отделения химиотерапии онкологических и гематологических боль-
ных ГБУ РО «ОДКБ им. Н.В. Дмитриевой»; 390023, Россия, г. Рязань, ул. Интернациональная, д. 1 «з»; ORCID iD 0009-0008-0007-7426.
Слабачков Кирилл Олегович — студент лечебного факультета ФГБОУ ВО РязГМУ Минздрава России; 390023, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORCID iD 0000-0003-4638-9560.
Заплатников Андрей Леонидович — д.м.н., профессор, проректор по учебной работе, заведующий кафедрой неонатологии им. проф. В.В. Гаврюшова, профессор кафедры педиатрии им. акад. Г.Н. Сперанского ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0003-1303-8318.
Контактная информация: Федина Наталья Васильевна, e-mail: k2ataka@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.03.2024.
Поступила после рецензирования 03.04.2024.
Принята в печать 26.04.2024.
ABOUT THE AUTHORS:
Andrey V. Dmitriev — Dr. Sc. (Med.), Professor, Head of the Department of Children Diseases with the Course of Hospital Pediatrics, Ryazan State Medical University; 9, Vysokovol’tnaya str., Ryazan, 390026, Russian Federation; professor of the Prof. N.N. Gavryushov Department of Neonatology, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-8202-3876.
Natalya V. Fedina — C. Sc. (Med.), associate professor of the Department of Children Diseases with the Course of Hospital Pediatrics, Ryazan State Medical University; 9, Vysokovol’tnaya str., Ryazan, 390026, Russian Federation; ORCID iD 0000-0001-6307-7249.
Marina S. Yudakova — hematologist of the Department of Chemotherapy of Cancer and Hematologic Patients, N.V. Dmitrieva Regional Children’s Clinical Hospital; 1Z, Internatsional’naya str., Ryazan, 390039, Russian Federation; ORCID iD 0009-0009-7040-2690.
Svetlana N. Dronova — hematologist of the Department of Chemotherapy of Cancer and Hematologic Patients, N.V. Dmitrieva Regional Children’s Clinical Hospital; 1Z, Inter-natsional’naya str., Ryazan, 390039, Russian Federation; ORCID iD 0009-0008-0007-7426.
Kirill O. Slabachkov — student of the Medical Faculty, Ryazan State Medical University; 9, Vysokovol’tnaya str., Ryazan, 390026, Russian Federation; ORCID iD 0000-0003-4638-9560.
Andrey L. Zaplatnikov — Dr. Sc. (Med.), Professor, Vice-chancellor for Instructional Work, Head of the Prof. N.N. Gavryushov Department of Neonatology, professor of the Acad. G.N. Speranskiy Department of Pediatrics, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0003-1303-8318.
Contact information: Natalya V. Fedina, e-mail: k2ataka@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.03.2024.
Revised 03.04.2024.
Accepted 26.04.2024.
Информация с rmj.ru






