Содержание статьи
Эбастин обладает не только антигистаминным эффектом
A. Campbell*
F.-B. Michel*
C. Bremard-Oury**
L. Crampette***
J. Bousquet*
* Service des Maladies Respiratoires & INSERM U454 Hopital Arnaud de Villeneuve, Монпелье, Франция
** Rhone-Poulenc Rorer, SPECIA, Париж, Франция
*** Service d’ORL, Hopital Saint Charles, Монпелье, Франция
Антагонисты Н1-гистаминового рецептора, также как и стероиды для местного применения, остаются препаратами выбора при аллергическом рините. Не считая сильного антигистаминного эффекта, механизм действия антагонистов H1-гистаминового рецептора требует дальнейшего изучения, поскольку эти препараты обладают свойствами, которые не связаны с блокировкой гистамина на уровне его рецептора [1].
Для оценки противоаллергических свойств антагонистов Н1-гистаминового рецептора могут быть использованы тесты как in vitro, так и in vivo. Клетки, изолированные из носовых полипов, представляют интересную модель для изучения фармакологии противоаллергических и противоастматических лекарственных препаратов, поскольку они происходят из воспаленной ткани и являются сенсибилизированными, подобно клеткам при воспалении, обусловленном ринитом [2–5].
Носовые полипы, которые могут быть различной этиологии, характеризируются наличием гиперплазированной отекшей слизистой оболочки и произрастают из этмоидальных пазух [6]. Из клеток носового полипа высвобождаются многочисленные разнообразные медиаторы, принимающие участие в аллергической реакции, среди которых эйкозаноиды, гистамин и цитокины. После пассивной сенсибилизации клетки носового полипа могут быть активированы зависимым от антител к иммуноглобулину Е механизмом высвобождения многих из этих медиаторов.
Мы провели исследование с использованием изолированных клеток, полученных из удаленных хирургическим путем носовых полипов, с целью изучения влияния эбастина и каребастина in vitro на высвобождение эйкозаноидов (лейкотриенов C4/D4 (LTC4/D4) и простагландина D2 (PGD2)) после стимуляции антителами к иммуноглобулину Е и спонтанное высвобождение цитокинов (гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), фактора некроза опухолей-альфа (ФНО-альфа) и интерлейкина-8 (ИЛ-8)).
Назальная провокационная проба с аллергенами широко применялась для изучения противоаллергической активности антагонистов H1-гистаминового рецептора in vivo. Лаваж слизистой носа после воздействия аллергенов дает возможность получить и измерить концентрацию воспалительных медиаторов и цитокинов [1, 7, 8], высвобождение которых может быть блокировано антагонистами H1-гистаминового рецептора. С целью измерения влияния эбастина на высвобождение медиаторов аллергии in vivo, мы сравнивали действие эбастина в дозировке 10 мг и 20 мг один раз в сутки на высвобождение медиаторов воспаления, с действием плацебо, в двойном слепом перекрестном исследовании с участием 12 пациентов с сезонным аллергическим ринитом.
Материалы и методы исследования
Исследование носового полипа in vitro
Клетки носового полипа были получены от 10 пациентов (6 мужчин, 4 женщины в возрасте от 18 до 61 года) с полипозом носа. Клетки были изолированы согласно методике, раннее применявшейся для получения клеток паренхимы легких, поскольку было обнаружено, что клетки, полученные путем ферментации, могут быть использованы для фармакологических исследований [9].
Полип сперва рассекался ножницами на кусочки размером приблизительно 1 мм3, а разъединение клеток проводилось путем ферментативного расщепления модифицированным методом Holgate и соавт. [10, 11]. Рассеченная ткань полипа в течение 2 ч находилась в четырех объемах среды для культивирования RPMI (среда Института имени Розуэелла Парка) линии 1640 (фирма «Гибко» (Gibco), Пейсли, Шотландия), которая содержит гиалуронидазу в концентрации 0,75 г/л, коллагеназу в концентрации 1,5 г/л и протеазу типа XIV в концентрации 2 г/л (все получено из компании «Сигма» (Sigma Co.), Сент-Луис, Миссури). Изоляция клеток проводилась при 37 °C в качающейся водяной бане. В конце периода ферментативного расщепления клетки последовательно отфильтровывались, с целью отделения от нерасщепленной ткани. Затем они повторно растворялись в среде RPMI и троекратно отмывались для удаления ферментов. Клетки были сенсибилизированы путем инкубации с 10% атопической сывороткой при 37 °C в течение 1 ч, а затем снова трижды отмыты.
Жизнеспособность клеток оценивалась до стимуляции и в конце периода инкубации путем измерения вытеснения красителя трипанового синего. Клетки описывались на стеклах, приготовленных путем центрифугирования и окрашиванных по Маю–Грюнвальду–Гимзе (May–Grunwald–Giemsa).
С целью измерения влияния эбастина и его метаболита каребастина на высвобождение медиаторов воспаления, подготовленные клетки носового полипа были повторно растворены в среде RPMI с концентрацией 1 × 106 клеток/мл и в течение 20 минут преинкубированы с эбастином или каребастином (в концентрации 0,1, 1, и 10 мкмоль/л) или с растворителем, который использовался для растворения веществ (диметилсульфоксид (ДМСО) в конечной концентрации 0,1%). Затем, с целью измерения эйкозаноидов, они подвергались воздействию специфических ε-цепей антител к иммуноглобулину Е (компания «Иммунотех» (Immunotech), Люмини, Франция) в концентрации 10 мг/л в течение 45 минут при 37 °C. Для измерения цитокинов клетки инкубировались в течение 24 ч без каких-либо стимуляторов секреции.
Для измерения высвобождения медиаторов лейкотриенов C4/D4 (LTC4/D4) и простагландина D2 (PGD2) использовался имеющийся в продаже набор для иммуноферментного анализа (ИФА) (компания «Сталлержен» (Stallergenes), Френ, Франция), а цитокины (ГМ-КСФ, ФНО-альфа и ИЛ-8) измерялись твердофазным иммуноферментным анализом (ELISA) (компания «Гензим» (Genzyme), Кембридж, Массачусетс, США).
Исследование активности эбастина in vivo
Исследование носовой провокационной пробы было проведено с участием 12 пациентов в возрасте от 20 до 38 лет после получения их информированного согласия. Исследование было разрешено Этическим комитетом университета Монпелье (Montpellier University), Франция. У пациентов наблюдались симптомы сезонного аллергического ринита и положительные кожные пробы с 1/100 (вес/объем) стандартизированного экстракта пыльцы ежи сборной (Dactylis glomerata) (компания «Лаборатории Сталлержес» (Laboratories des Stallergenes), Френ, Франция). У всех пациентов наблюдалось повышение титров иммуноглобулина Е к пыльце ежи сборной в плазме крови (радиоаллергосорбентный тест «Фадебаст» (Phadebast RAST); компания «Фармация Диагностикс» (Pharmacia Diagnostics), Упсала, Швеция). Никто из пациентов не получал лечения антигистаминными препаратами, кортикостероидами или кетотифеном в течение 2 недель до начала исследования, а также астемизолом или имипрамином в течение предыдущего месяца.
Назальная провокационная проба проводилась в то время, когда никакой специфической пыльцы в атмосфере не обнаруживалось. Капсулы, содержащие лактозу или зерна пыльцы ежи сборной в количестве, увеличивающемся от 50 до 156 250 зерен (5,5-кратное увеличение) (компания «Лаборатории Сталлержен» (Laboratoires des Stallergenes), Френ, Франция), инсуфлировались в ноздри носовым аэрозолем Spinhaler (компания «Лаборатории Фисонс» (Fisons Laboratories), Лафборо, Англия); пациенты задерживали дыхание при инсуфляции. Для каждого количества пыльцы носовой аэрозоль Spinhaler применяли 5 раз. Каждая капсула раскрывалась после инсуфляции, с целью убедиться, что она полностью пуста.
Сначала инсуфлировалась лактоза, и последующие симптомы регистрировались в течение 15 минут. Затем каждые 15 минут в ноздри инсуфлировались зерна пыльцы в порядке увеличения количества до тех пор, пока по шкале симптомов не получали 5 баллов: 5 последовательных чиханий (3 балла), ринорея (от 1 до 3 баллов), заложенность носа (от 1 до 3 баллов) или зуд в носу (1 балл). Назальная провокационная проба проводилась путем инсуфляции зерен пыльцы ежи сборной в количестве, увеличивающемся от 50 до 781 250 до тех пор, пока суммарный балл по шкале симптомов не достигнет исходного уровня [12].
Выделения из носа получали путем назального лаважа до реакции и в течение ранней и поздней фаз реакции. До каждой провокационной пробы проводился лаваж каждой ноздри 5 мл физиологического раствора троекратно с целью уменьшения уровня медиаторов. Назальный лаваж также проводился через 15 минут после вдувания лактозы или аллергена и повторялся через 6 часов после немедленной реакции (поздняя фаза реакции).
Выделения из носа хранились на льду до конца эксперимента. Затем они центрифугировались при +4 °C в течение 15 минут при 15 000 g. Твердая фаза отделялась от гелеобразной фазы пипеткой и хранилась при –20 °C до момента проведения анализа.
Для измерения высвобождения медиаторов лейкотриенов C4/D4 (LTC4/D4) и простагландина D2 (PGD2) использовался имеющийся в продаже набор для иммуноферментного анализа (EIA) (компания «Сталлержен» (Stallergenes), Френ, Франция), а цитокины (ГМ-КСФ, ФНО-альфа и ИЛ-8) измерялись твердофазным иммуноферментным анализом (ELISA) (компания «Гензим» (Genzyme), Кембридж, Массачусетс, США).
Первая назальная провокационная проба проводилась до какого-либо лечения для определения исходной реактивности пациентов по отношению к аллергенам. С целью измерения влияния эбастина на аллергическую реакцию, пациенты получали лечение плацебо или эбастин в дозировке 10 мг или 20 мг один раз в сутки в течение 7 дней, согласно плану перекрестного исследования. Интервал между последним приемом лекарственного препарата и аллергической пробой составлял 1 час. Назальные провокационные пробы проводились в конце каждого периода лечения с 7-дневным периодом «отмывки» между периодами лечения.
Результаты
Исследование носового полипа in vitro
Популяция клеток, полученных из носовых полипов, включала эпителиальные клетки, мононуклеарные клетки, эозинофилы и нейтрофилы. Однако наблюдалась высокая степень гетерогенности полипов по клеточному составу. Ни эбастин, ни каребастин не оказывали никакого влияния на жизнеспособность клеток, определенную по захвату красителя трипанового синего.
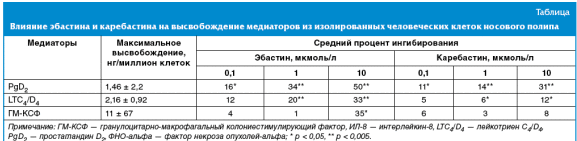
Антитела к иммуноглобулину Е вызывали значительное усиление высвобождения LTC4/D4 и PgD2 из клеток носового полипа in vitro: спонтанное высвобождение (среднее ± стандартное отклонение (SD)) по сравнению с индуцированным антителами к иммуноглобулину Е высвобождением было 0,11 ± 0,11 против 1,46 ± 2,2 нг/106 клеток для PgD2 и 0,13 ± 0,04 против 2,16 ± 0,92 нг/106 клеток для LTC4/D4.
Эбастин в диапазоне концентраций от 0,1 до 10 мкмоль/л значительно ингибировал это высвобождение PgD2 и LTC4/D с дозозависимым эффектом (табл.). Концентрации эбастина, необходимые для ингибирования высвобождения этих двух медиаторов на 30% (IC30), были рассчитаны как 2,57 и 9,6 мкмоль/л соответственно. Каребастин также проявил способность ингибировать высвобождение PgD2 из клеток носового полипа, но был менее активным, чем эбастин: значение 30% ингибирующей концентрации (IC30) — 8,14 мкмоль/л. Эбастин и каребастин также ингибировали высвобождение цитокинов, хотя каребастин оказывал, в целом, меньшее влияние на эти медиаторы (табл.).
Исследование активности эбастина in vivo
Среднее количество зерен пыльцы, необходимое для индукции аллергической реакции, было достоверно ниже у принимавших плацебо, по сравнению с теми, кто принимал эбастин в дозировке 10 и 20 мг (рис. 1). Эбастин в дозировке 20 мг вызывал достоверное повышение среднего порогового количества зерен пыльцы, необходимого для индукции положительного ответа, по сравнению с плацебо (р < 0,003) и эбастином в дозировке 10 мг (р < 0,02).
Эбастин уменьшал высвобождение ГМ-КСФ с дозозависимым эффектом (рис. 2). Высвобождение лейкотриена LTC4/D4 и PgD2, обнаруженное у большинства пациентов при назальной провокационной пробе, достоверно не нарушалось под влиянием эбастина. Кроме того, эбастин не влиял на высвобождение цитокинов.
Клинически поздняя фаза реакции (заложенность носа, в итоге сопровождавшаяся ринореей) наблюдалась у крайне небольшого количества пациентов, недостаточного для исследования.

Обсуждение
Как было уже показано ранее с применением назальной провокационной пробы с аллергеном, азатидин, лоратидин и терфенадин ингибируют высвобождение гистамина, PgD2 и кининов [1, 13–15]. Кроме того, азеластин и цетиризин ингибируют высвобождение лейкотриенов [15, 16]. Мы показали, что эбастин блокирует высвобождение индуцированных антителами к иммуноглобулину Е простагландина D2 (PgD2) и лейкотриенов C4/D4 (LTC4/D4) из человеческих клеток носового полипа in vitro и ингибирует высвобождение цитокинов. Ни в каких других исследованиях не применялась данная модель с целью исследования влияния других антигистаминных препаратов на высвобождение медиаторов in vitro; таким образом, не представляется возможным сравнить эти препараты с эбастином. Механизмы, с помощью которых антигистаминные препараты нарушают высвобождение медиатора, остаются неописанными.
Заключение
Таким образом, эбастин, антагонист H1-гистаминового рецептора, имеет способность ингибировать высвобождение лейкотриена C4/D4 (LTC4/D4), простагландина D2 (PgD2) и цитокинов из клеток полипа носа in vitro. Каребастин угнетает высвобождение простагландина D2 (PgD2), но в целом имеет меньшее, чем эбастин, влияние на этот и другие медиаторы. У пациентов с сезонным аллергическим ринитом эбастин в дозировке 10 и 20 мг один раз в сутки в течение 7 дней достоверно повышал количество зерен пыльцы, необходимых для индукции аллергического ответа, по сравнению с плацебо, а также уменьшал высвобождение ГМ-КСФ.
Литература
- Bousquet J., Lebel B., Chanal I. et al. Antiallergic activity of H1-receptor antagonists assessed by nasal challenge // J. Allergy Clin. Immunol. 1988; 82: 881–887.
- Stoop A. E., van der Heijden H. A., Biewenga J. et al. Eosiniphils in nasal polyps and nasal mucosa: an immunohistochemical study // J. Allergy Clin. Immunol. 1993; 91: 616–622.
- Linder A., Karlsson-Parra A., Hirvela C. et al. Immunocompetent cells in human nasal polyps and normal mucosa // Rhinology. 1993; 31: 125–129.
- Ohno I., Lea R. G., Flanders K. C. et al. Eosinophils in chronically inflamed human upper airway tissues express transforming growth factor beta 1 gene (TGF beta 1) // J. Clin. Invest. 1992; 89: 1662–1668.
- Hamilos D. L., Leung D. Y., Wood R. et al. Chronic hyperplastic sinusitis: association of tissue eosinophilia with mRNA expression of granulocyte-macrophage colony-stimulating factor and interleukin-3 // J. Allergy Clin. Immunol. 1993; 92: 39–48.
- Tos M., Sasaki Y., Ohnishi M. et al. Fireside conference 2. Pathogenesis of nasal polyps // Rhinology. 1992; 14 Suppl. 181–185.
- Naclerio R. M., Meier H. L., Kagey-Sobotka A. et al. In vivo model for the evaluation of topical antiallergic medications // Arch. Otolaryngol. 1984; 110: 25–27.
- Sim T. C., Grant J. A., Hilmeister K. A. et al. Proinflammatory cytokines in nasal secretions of allergic subjects after antigen challenge // Am. J. Respir. Crit. Care Med. 1994; 149: 339–344.
- Campbell A. M., Chanez P., Mary-Ane C. et al. Modulation of eicosanoid and histamine release from human dispersed lung cells by terfenadine // Allergy. 1993; 48: 125–129.
- Holgate S., Burns G.., Robinson C. et al. Anaphylactic and calcium-dependent generation of prostaglandin D2 (PGD2), thromboxane B2 and other cyclo-oxygenase products of arachidonic acid by dispersed lung cells and relationship to histamine release // J. Immunol. 1984; 133: 2138–2144.
- Campbell A. M., Bousquet J. Anti-allergic activity of H1-blockers // Int. Arch. Allergy Immunol. 1993; 101: 308–310.
- Lebel B., Bousquet J., Morel A. et al. Correlation between symptoms and the threshold for release of mediators in nasal secretions during nasal challenge with grass-pollen grains // J. Allergy Clin. Immunol. 1988; 82: 869–877.
- Anderson M., Nolte H., Buamgarten C. et al. Suppressive effect of loratadine on allergen-induced histamine release in the nose // Allergy. 1991; 46: 540–546.
- Naclerio R. M., Kagey-Sobotka A., Lichtenstein L. M. et al. Terfenadine, an H1 antihistamine inhibits histamine release in vivo in the human // Am. Rev. Respir. Dis. 1990; 142: 167–171.
- Togias A. G., Proud D., Kagey-Sobotka A. et al. In vivo and in vitro effects of antihistamines on mast cell mediator release: a potentially important property in the treatment of allergic disease // Ann. Allergy. 1989; 63: 465–469.
- Shin M. H., Baroody F., Proud D. et al. The effect of azelastine on the early allergic response // Clin Exp. Allergy. 1992; 22: 189–195.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






