Диагностическая тактика и рекомендации по лечению больных
хроническим гепатитом С, инфицированных генотипом 2 ВГС
О. О. Знойко*, доктор медицинских наук, профессор
К. Р. Дудина*, доктор медицинских наук
А. Н. Козина*
С. А. Шутько*, кандидат медицинских наук
В. В. Огарев*
О. В. Калинина**
Н. Д. Ющук*, доктор медицинских наук, профессор, академик РАН
* ГБОУ ВПО МГМУ им. А. И. Евдокимова МЗ РФ, Москва
** ФБУН СПбНИИЭМ им. Пастера, Санкт-Петербург
Главной целью лечения хронического гепатита С (ХГС) является полное излечение
от заболевания, что возможно только при условии эрадикации вируса из организма.
Инфекция вирусом гепатита С (ВГС) излечивается у 99% пациентов после завершения
курса противовирусной терапии (ПВТ) при наличии устойчивого вирусологического
ответа (УВО) [1], который считается достигнутым, если РНК ВГС в организме
пациента отсутствует через 12 (УВО12) или 24 (УВО24) недели после завершения
курса лечения (Европейская ассоциация по изучению болезней печени, European
Association for the Study of the Liver, EASL, 2015) [2].
В течение последних 20 лет тактика обследования и лечения больных ХГС
существенно усовершенствовалась благодаря раскрытию многих аспектов патогенеза
заболевания, повышению качества диагностических процедур (возможности
определения генотипов и субтипов ВГС, определения стадий фиброза печени
неинвазивными методами, определения вариантов полиморфизма генов человека,
влияющих на успех терапии) и, наконец, вследствие значительного «прорыва» в
создании противовирусных препаратов, мишенями для которых являются вирусные
белки. Это новое поколение препаратов прямого противовирусного действия (ПППД) в
буквальном смысле произвело революцию в лечении ХГС и позволило излечивать даже
такую трудную категорию пациентов, как больные с циррозом печени, и больных,
перенесших трансплантацию печени.
До 2011 г. в Европе, США и России для лечения ХГС была утверждена комбинация
пегилированного интерферона (ПЕГ ИФН) и рибавирина (РИБ) с продолжительностью
курса 24 или 48 недель в зависимости от генотипа ВГС. У пациентов,
инфицированных генотипом 1 ВГС, частота достижения УВО в результате лечения
данной комбинацией в течение 48 недель достигала приблизительно 50% у
пациентов-европеоидов (не афроамериканцев и не азиатов). Более высокая частота
УВО регистрировалась у пациентов, инфицированных генотипами 2 и 3 ВГС (до 80%, и
в большей степени это относилось к пациентам с генотипом 2 ВГС) [3].
С внедрением в клиническую практику ПППД для лечения ХГС, вызванного ВГС 2-го
генотипа, в Европе начиная с 2014 г. широкое применение получили схемы лечения,
не содержащие ИФН. Для лечения пациентов, инфицированных генотипом 2 ВГС,
одобрены для применения следующие ПППД: Софосбувир (SOF) — пангенотипный
нуклеотидный аналог, ингибитор РНК-зависимой РНК-полимеразы NS5B ВГС (одобрен в
январе 2014 г.), Даклатасвир (DAC) — пангенотипный ингибитор белка NS5A ВГС —
(одобрен в августе 2014 г.). Применение комбинации SOF и РИБ рекомендовано
больным ХГС при наличии инфицирования генотипом 2 ВГС (12 недель) или генотипом
3 ВГС (24 недели). Данная комбинация обеспечивает частоту УВО порядка 80–95%
даже в случае предшествующей неудачи лечения ПЕГ ИФН + РИБ.
В то же время в рекомендациях EASL 2015 г. [2] указано, что, несмотря на то,
что эта комбинация является оптимальным вариантом для пациентов, инфицированных
генотипом 2 ВГС, можно использовать и другие схемы терапии (SOF + DAC ± РИБ),
особенно для пациентов, не достигших УВО в результате лечения сочетанием
препаратов SOF + РИБ. Например, для пациентов, не ответивших в прошлом на
двойную терапию ПЕГ ИФН + РИБ, применять 12-недельный курс терапии комбинацией
препаратов ПЕГ ИФН + РИБ + SOF, которая рекомендована для всех генотипов ВГС. А
если нет возможности применения SOF и DAC, можно назначать сочетание ПЕГ ИФН +
РИБ в соответствии с предыдущими рекомендациями Европейской ассоциации по
изучению болезней печени [3] и Всемирной организации здравоохранения 2015 г.
[4]. В табл. 1 представлены рекомендации Европейской ассоциации по изучению
болезней печени 2015 г. по лечению больных ХГС, инфицированных генотипами 1, 2 и
3 ВГС.
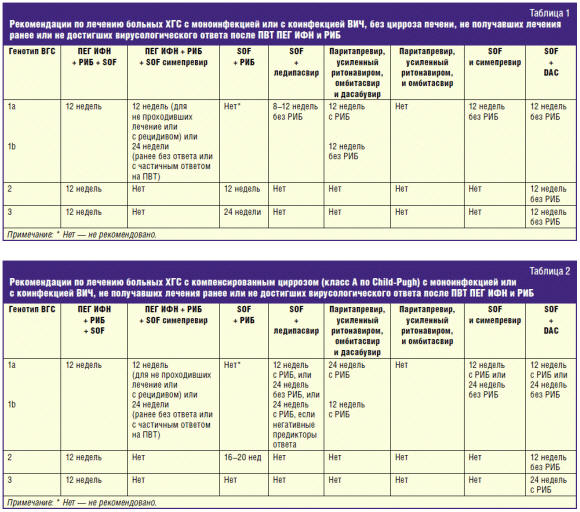
Для пациентов с циррозом печени изменения в рекомендуемых Европейской
ассоциации по изучению болезней печени (2015 г.) схемах лечения касаются в
основном длительности курса и наличия/отсутствия в применяемой схеме рибавирина
(табл. 2).
Для российских пациентов с ХГС, инфицированных генотипом 2 ВГС, в
соответствии с российскими рекомендациями по лечению взрослых больных гепатитом
С 2014 г. [5] и в связи с тем, что SOF начинает применяться в России в 2016 г.,
пока в основном доступно лечение ПЕГ ИФН + РИБ. Необходимо отметить, что
эффективность лечения данной группы пациентов двойной терапией ПЕГ ИФН + РИБ в
течение 24 недель превышает 80%, как показали регистрационные исследования этой
терапии у больных ХГС, инфицированных данным генотипом [6, 7]. По данным
исследований последних лет, эффективность остается очень высокой (87–97%) и при
сокращении курса терапии до 12–16 недель по данным исследований NORDynamIC, CLEO
и других исследований, опубликованных в период с 2007 г. по 2016 г., особенно
при условии достижения быстрого вирусологического ответа (БВО) к 4-й неделе
лечения [8–13]. Кроме того, на фоне высокой стоимости безинтерфероновых схем
лечения (более миллиона рублей) двойная терапия ПЕГ ИФН + РИБ в течение 24
недель у пациентов без цирроза печени имеет значительное преимущество с
фармакоэкономической точки зрения, поскольку затраты на ее проведение могут
составлять не более 200 тысяч рублей, а эффективность лечения сопоставима с
таковой при лечении безинтерфероновыми схемами (SOF + РИБ по данным исследований
FISSION, POSITRON и VALENCE (97%, 93% и 97% соответственно)) [14–16]. Однако,
принимая во внимание существенно меньшую эффективность лечения пациентов с
циррозом печени (независимый от генотипа предиктор ответа на ПВТ), безусловно,
безинтерфероновые схемы лечения являются предпочтительными для данной категории
пациентов (по данным исследования VALENCE 92% достижения УВО после 24 недель
лечения у пациентов с циррозом, не получавших ранее лечение).
По данным метаанализа исследований, посвященных оценке
стоимость/эффективность ПВТ (C. Bickerstaff, 2015), наиболее оптимальным
затратоэффективным вариантом для пациентов без цирроза печени, инфицированных
генотипом 2 ВГС, является двойная терапия ПЕГ ИФН + РИБ даже с учетом наличия на
рынке ПППД, а для пациентов с циррозом печени — 24-недельный курс лечения SOF +
РИБ. Однако в данном исследовании анализировались не все безинтерфероновые
режимы [17]. Таким образом, лечение пациентов, инфицированных генотипом 2 ВГС, в
большинстве случаев не является сложной задачей и дорогостоящей опцией, если
генотип ВГС идентифицирован правильно и отсутствуют данные за микст-инфекцию
разными генотипами ВГС или инфицирование «необычным» вариантом вируса.
Исследования последних лет в области молекулярной генетики вирусов показали,
что значительная гетерогенность популяции ВГС (6 генотипов, подразделенных на 88
субтипов) связана не только с высокой скоростью мутаций вирусного генома, но
также с рекомбинациями, происходящими между «родительскими» геномами некоторых
геновариантов вируса. Это может приводить к появлению вирусов с рекомбинантным
геномом и новыми фенотипическими свойствами. Особенностью определенной группы
природных межгенотипных рекомбинантов ВГС является принадлежность части их
генома (область, кодирующая структурные белки ВГС) к генотипу 2 до
рекомбинационного сайта, расположенного всегда в NS2/NS3 регионе. После
рекомбинационного сайта область генома большинства рекомбинантных вариантов
принадлежит к эпидемическим субтипам 1a или 1b. Достаточно широкое
распространение получил только рекомбинант RF2k/1b, впервые обнаруженный в 2002
г. в Санкт-Петербурге [18] и который начиная с 2005 г. официально внесен в
классификацию ВГС. Отличительной особенностью варианта RF2k/1b является
принадлежность всех его структурных генов к субтипу 2k генотипа 2, а
неструктурных генов — к наиболее трудно поддающемуся лечению интерфероном
субтипу 1b. Изоляты природного рекомбинанта RF2k/1b идентифицированы на пяти
территориях России (Санкт-Петербург, Москва, Московская область, Тамбовская
область, Сибирь), а также в Эстонии, Узбекистане, Азербайджане, Швеции,
Ирландии, Голландии, Франции, Кипре, США. При этом в Швеции, Ирландии,
Голландии, Франции и Кипре изоляты RF2k/1b обнаружены только у эмигрантов из
Грузии, Армении, Азербайджана или России (единичные случаи). Такая география
выявления межгенотипного рекомбинанта RF2k/1b обусловлена его уникальными
фенотипическими характеристиками, которые позволяют ему быстро распространяться
в человеческой популяции, а филогенетический анализ в сочетании с доступными
эпидемиологическими данными свидетельствует о том, что данный вариант ВГС
успешно распространяется, а также происходит постоянный вброс изолятов RF2k/1b
как в основную популяцию населения различных стран, так и в группы риска (лица,
употребляющие внутривенно психоактивные вещества) [19–22].
К 2015 г. опубликованы данные по эффективности лечения ПЕГ ИФН + РИБ в целом
только у 23 пациентов, инфицированных рекомбинантным вариантом RF2k/1b ВГС.
Эффективность лечения в небольших группах пациентов описана в работах как
российских авторов, так и исследователями из Грузии, где рекомбинатный вариант
составляет 76% в структуре популяции генотипа 2 ВГС, а также исследователями из
США, которые представили данные об эффективности лечения этого варианта не
только ПЕГ ИФН + РИБ, но и SOF + РИБ. Эффективность лечения ПЕГ ИФН + РИБ
варьировала от 20% до 48%, и только в 30% случаев достигнут успех в результате
лечения SOF + РИБ по схеме лечения для генотипа 2–12 недель [23–25].
В исследовании, посвященном клиническому значению предикторов успеха терапии,
в том числе генетически детерминированных (как со стороны ВГС, так и человека),
выполняемом авторами статьи в течение двух лет, получены данные о том, что из 19
обследованных больных московской популяции больных ХГС, инфицированных генотипом
2 ВГС по данным коммерческих тест-систем, у 7 (37%) пациентов выявлен
межгенотипный рекомбинант RF2k/1b по результатам генотипирования на основе
анализа фрагментов NS5B области генома ВГС. При этом у пяти из них был опыт
терапии ПЕГ ИФН + РИБ в течение 24–32 недель, и у всех (100%) не был достигнут
УВО.
Проведенное нами в 2015 г. сравнительное исследование результатов типирования
вариантов ВГС с использованием различных коммерческих тест-систем российского
производства и результатов генотипирования на основе анализа фрагментов NS5B и
core областей генома подтвердило невозможность идентификации в клинической
лабораторной практике рекомбинантного варианта RF2k/1b ВГС, который при
использовании коммерческих тест-систем типируется как генотип 2 в связи с
особенностями организации его генома. Для идентификации этого варианта вируса
необходимо проводить генотипирование, основанное на полимеразной цепной реакции
с применением типоспецифических праймеров, соответствующих двум областям, вторая
из которых должна находиться в области неструктурных генов, в частности, в гене,
кодирующем РНК-зависимую РНК-полимеразу. К сожалению, пока такой подход не
реализован ни в одной российской зарегистрированной коммерческой тест-системе,
но в принципе реализуем в лабораторной практике.
Принимая во внимание, что генотип ВГС определяет схемы назначаемой терапии, а
имеющиеся данные результатов ПВТ указывают на то, что комбинации противовирусных
препаратов, используемых для генотипа 2 ВГС, не позволяют достичь УВО
большинству пациентов, инфицированных рекомбинантным вариантом RF2k/1b,
существует потребность включения в клиническую лабораторную практику
субтипирования всех изолятов генотипа 2 на основе анализа фрагмента NS5B области
генома. Такие мероприятия позволят успешно выявлять рекомбинантные формы ВГС и
повысят эффективность ПВТ.

На рисунке приведен предлагаемый нами алгоритм по диагностике и лечению
больных ХГС, у которых по данным коммерческих тест-систем выявлен генотип 2 ВГС.
Работа выполнена при поддержке Российского
Научного Фонда (приоритетное направление деятельности РНФ «Проведение
фундаментальных научных исследований и поисковых научных исследований отдельными
научными группами», соглашение № 14-15-00546).
Литература
-
Swain M. G., Lai M. Y., Shiftman M. L., Cooksley W. G. et al. A
sustained virologic respoеnse is durable in patients with chronic hepatitis С
treated with peginterferon alfa-2 a and ribavirin // Gastroenterology. 2010;
139: 1593–1601. - EASL Recommendations on Treatment of Hepatitis C 2015. European
Association for Study of Liver // J Hepatol. 2015; 63 (1): 199–236. DOI:
10.1016/j.jhep.2015.03.025. - European Association for the Study of the Liver. EASL Clinical Practice
Guidelines: management of hepatitis С virus infection // J Hepatol. 2011; 55:
245–264. - World Health Organization. Guidelines for the screening, care and
treatment of persons with hepatitis C infection. Available
at: http://www.who.int/hiv/pub/hepatitis/hepatitis-c-guidelines/en/Accessed
November, 2015. - http://arvt.ru/sites/default/files/rf-recom-gep-C-2014.pdf.
-
Manns M. P., McHutchison J. G., Gordon S. C. et al. Peginterferon
alfa-2 b plus ribavirin compared with interferon alfa-2b plus ribavirin for
initialtreatment of chronic hepatitis C: a randomised trial // Lancet. 2001
Sep 22; 358 (9286): 958–65. DOI: 10.1016/s0140–6736 (01)06102–5. -
Hadziyannis S. J., Sette H. Jr., Morgan T. R. et al.
Peginterferon-alpha2 a and ribavirin combination therapy in chronic hepatitis
C: a randomized study of treatment duration and ribavirin dose // Ann Intern
Med. 2004 Mar 2; 140 (5): 346–355. DOI:
10.7326/0003–4819–140–5-200403020–00010. -
Berg T., Carosi G. Optimizing outcomes in patients with hepatitis
C virus genotype 2 or 3 // Antivir Ther. 2008; 13 Suppl 1: 17–22. -
Waldenström J., Färkkilä M., Rembeck K. et al. Short interferon
and ribavirin treatment for HCV genotype 2 or 3 infection: NORDynamIC trial
and real-life experience // Scand J Gastroenterol. 2016 Mar; 51 (3): 337–343.
DOI: 10.3109/00365521.2015.1087588. -
Mecenate F., Pellicelli A. M., Barbaro G. et al. Short versus
standard treatment with pegylated interferon alfa-2 A plus ribavirin in
patients with hepatitis C virus genotype 2 or 3: the cleo trial // BMC
Gastroenterol. 2010 Feb 19; 10: 21. DOI: 10.1186/1471–230 X-10–21. -
Dalgard O., Bjøro K., Ring-Larsen H. et al. Pegylated interferon
alfa and ribavirin for 14 versus 24 weeks in patients with hepatitis C virus
genotype 2 or 3 and rapid virological response // Hepatology 2008; 47: 35–42 [PMID:
17975791 DOI: 10.1002/hep.21975. -
Shiffman M. L., Suter F., Bacon B. R. et al. Peginterferon alfa-2
a and ribavirin for 16 or 24 weeks in HCV genotype 2 or 3 // N Engl J Med.
2007; 357: 124–134. [PMID17625124 DOI: 10.1056/NEJMoa066403. -
Yu M. L., Dai C. Y., Huang J. F. et al. A randomised study of
peginterferon and ribavirin for 16 versus 24 weeks in patients with genotype 2
chronic hepatitis C // Gut. 2007; 56: 553–559. [PMID: 16956917 DOI:
10.1136/gut.2006.102558. -
Lawitz E., Mangia A., Wyles D. et al. Sofosbuvir for previously
untreated chronic hepatitis С infection // N Engl J Med. 2013; 368: 1878–1887. -
Jacobson I. M., Gordon S. C., Kowdley K. V. et al. Sofosbuvir for
hepatitis С genotype 2 or 3 in patients without treatment options // N Engl J
Med. 2013; 368: 1867–1877. -
Zeuzem S., Dusheiko G. M., Salupere R. et al. Sofosbuvir and
ribavirin in HCV genotypes 2 and 3 // N Engl J Med. 2014; 370: 1993–2001. -
Bickerstaff C. The cost-effectiveness of novel direct acting
antiviral agent therapies for the treatment of chronic hepatitis C // Expert
Rev Pharmacoecon Outcomes Res. 2015 Oct; 15 (5): 787–800. DOI:
10.1586/14737167.2015.1076337. -
Kalinina O., Norder H., Mukomolov S., Magnius L. O. A natural
intergenotypic recombinant of hepatitis C virus identified in St. Petersburg
// J Virol. 2002 Apr; 76 (8): 4034–4043. DOI: 10.1128/jvi.76.8.4034–4043.2002. -
Калинина О. В. Организация генома и география природного
межгенотипного рекомбинанта вируса гепатита С RF1_2k/1b // Инфекция и
иммунитет. 2012; 2 (4): 677–686. -
Raghwani J., Thomas X. V., Koekkoek S. M. et al. Origin and
evolution of the unique hepatitis C virus circulating recombinant form 2 k/1 b
// J Virol. 2012; 86 (4): 2212–2220. DOI: 10.1128/JVI.06184–11. -
Калинина О. В., Жебрун А. Б. Филодинамика популяций вируса
гепатита С // Вестник РАМН. 2015; 70 (5): 573–578. -
Ramière C., Tremeaux P., Caporossi A. et al Recent evidence of
underestimated circulation of hepatitis C virus intergenotypic recombinant
strain RF2k/1b in the Rhône-Alpes region, France, January to August 2014:
implications for antiviral treatment // Euro Surveill. 2014; 19 (43): 20944.
DOI: 10.2807/1560–7917.es2014.19.43.20944. -
Karchava M., Waldenström J., Parker M. et al. High incidence of
the hepatitis C virus recombinant 2k/1b in Georgia: Recommendations for
testing and treatment // Hepatol Res. 2015: 1–7. DOI: 10.1111/hepr.12505. -
Николаева Л. И., Сапронов Г. В., Колотвин А. В. с соавт. Гепатит
С при инфицировании рекомбинантной формой вируса RF2k/1b: течение и терапия //
Эпидемиология и инфекционные болезни. 2014; 3: 9–15. -
Hedskog C., Doehle B., Chodavarapu K. et al. Characterization of
hepatitis C virus intergenotypic recombinant strains and associated
virological response to sofosbuvir/ribavirin // Hepatology. 2015; 61 (2):
471–480. DOI: 10.1002/hep.27361.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru



