Содержание статьи
Боль в спине: базисная и дифференцированная терапия
Е. Е. Васенина, кандидат медицинских наук
О. С. Левин, доктор медицинских наук, профессор
ГБОУ ДПО РМАПО МЗ РФ, Москва
Боль в спине — одна из наиболее актуальных проблем здравоохранения. В течение жизни она возникает у 60–90% населения и ежегодно отмечается у 25–40% населения. В большинстве случаев эпизод боли в спине оказывается кратковременным, однако примерно у 4% трудоспособного населения боль в спине служит причиной длительной временной утраты трудоспособности, а у 1% — стойкой утраты трудоспособности. Это вторая по частоте причина временной нетрудоспособности и пятая по частоте причина госпитализации [3, 4, 15].
На протяжении десятилетий в отечественной клинической практике остеохондроз позвоночника рассматривался как универсальная причина боли в спине. Между тем выявляемые с помощью спондилографии, компьютерной (КТ) или магнитно-резонансной томографии (МРТ) дегенеративно-дистрофические изменения позвоночника, считавшиеся маркерами остеохондроза, плохо коррелируют с клинической картиной и нередко встречаются у лиц, не страдающих болью в спине [2, 13]. Таким образом, остеохондроз позвоночника может считаться лишь одной из предпосылок развития боли в спине, но не ее непосредственной причиной.
Классификация боли в спине
С прагматической точки зрения боль в спине, независимо от ее происхождения, полезно подразделять по течению и локализации (табл. 1) [2, 3].

Остеохондроз позвоночника в структуре причин боли в спине
Длительное время остеохондроз считался четким коррелятом боли в спине. Однако причины боли в спине далеко не ограничиваются остеохондрозом и патологией позвоночника в целом. В общей структуре причин боли в спине весьма заметную роль играют так называемые невертеброгенные причины, которые могут быть связаны с патологией мышц и связок спины, поражением внутренних органов, забрюшинного пространства, психическими расстройствами и т. д. (табл. 2) [1].
Остеохондроз действительно является одной из самых частых причин болей в спине. Однако необходимо понимать, что остеохондроз представляет собой дегенеративно-дистрофический каскад и на разных его этапах ведущую роль в развитии болевого синдрома могут играть различные факторы — грыжа межпозвонкового диска, нестабильность или блокада позвоночно-двигательных сегментов, артроз фасеточных суставов, стеноз позвоночного канала и др. [4]. В зависимости от преимущественного поражения проявления болевого синдрома имеют определенное клиническое своеобразие, однако необходимо отметить, что «каскадность» дегенеративного процесса, взаимное отрицательное влияние предыдущих и последующих звеньев друг на друга формируют некий порочный круг, в котором «клиническая гетерогенность» боли несколько стирается (табл. 3).

Все представленные варианты относятся к аксиальным болевым синдромам, когда боль преимущественно локализована именно в спине. Однако при смещении образовавшейся грыжи в сторону позвоночного канала или межпозвонкового отверстия может происходить компрессия прилегающего спинномозгового корешка и соответствующего спинномозгового ганглия, что ведет к возникновению уже корешкового синдрома (радикулопатии). Причем механическое сдавление является не единственной причиной повреждения — в этой зоне формируется асептическое воспаление (аутоиммунное), что подтверждается рядом исследований с обнаружением в зоне повреждения интерлейкинов и факторов некроза опухоли — ключевых медиаторов воспаления, с последующим отеком и демиелинизацией корешка [2]. Болевой синдром при радикулопатии характеризуется невропатическим компонентом (интенсивная, жгучая, стреляющая, напоминающая удар током), дистальным распространением по соответствующему спинномозговому корешку дерматому, а также симптомами «выпадения» — гиперстезией в проекции соответствующего корешка, слабостью мышц в зоне иннервации, а также в некоторых случаях выпадением/угасанием сухожильных рефлексов (коленного — L4, ахиллова — S1). Боль может усиливаться при движении, натуживании, подъеме тяжести, длительном пребывании в одной позе, кашле и чихании и ослабевать в покое, особенно в положении на здоровом боку с согнутой больной ногой [2, 3]. Достаточно часто иррадиация боли в нижнюю конечность ошибочно воспринимается врачами как следствие поражения спинномозгового корешка и, соответственно, грыжи диска. Радикулопатию необходимо дифференцировать с рефлекторной люмбоишалгией, при которой боль носит ноцицептивный характер (тянущая, ноющая, глубинная), как правило, редко иррадиирует ниже колена с преимущественной локализацией в бедре и ягодице. При рефлекторной люмбоишалгии не отмечается нарушений чувствительности, парезов или снижения сухожильных рефлексов. Необходимость подобного разделения продиктована различными терапевтическими стратегиями, направленными на купирование боли, — рефлекторная люмбоишалгия лечится теми же алгоритмами, что и аксиальная боль, а гипердиагностика «радикулопатия» часто приводит к неоправданным хирургическим вмешательствам и назначению необязательных групп препаратов.
Параклинические методы дигностики
Порядка 5% случаев боли в спине могут быть вызваны специфическими причинами. Наибольшую настороженность требуют пациенты до 15 и после 50 лет, наличие немеханического характера боли (сохранение боли в ночное время и в покое), наличие лихорадки, боль, сопровождающаяся слабостью или онемением ниже уровня колен, тазовая дисфункция, нарастание неврологического дефицита, травма, длительный прием стероидов, симптомы онкологического заболевания и т. д. Подобные больные нуждаются в экстренном обследовании, включая рентгенографию и методы нейровизуализации [1].
При отсутствии «настораживающих» моментов, механическом характере болевого синдрома, положительной динамике на фоне адекватной (!) консервативной терапии необходимости в проведении нейровизуализационной диагностики нет. По данным современных исследований примерно у 2/3 лиц, никогда не испытывавших боли в спине, эти методы исследования выявляют дегенеративные изменения в пояснично-крестцовом отделе позвоночника, нередко на нескольких уровнях. Выявляемые методами нейровизуализации грыжи диска часто бывают асимптомными и не имеют прямой корреляции с интенсивностью болевого синдрома, причем как корешкового, так и аксиальной боли [12, 13]. Рутинное проведение МРТ не только неоправданно увеличивает расходы, но и в определенной степени «стигматизирует» больного, способствуя хронизации болевых синдромов, и часто приводит к неоправданным инвазивным вмешательствам. С радикулопатией четко коррелирует лишь экструзия диска, под которой понимают крайнюю степень его выпячивания, когда длина выпячивания превышает ширину его основания либо отсутствует связь между выпячиванием и основным веществом диска [3]. Таким образом, обнаружение грыжи диска, проявлений спондилеза и стеноза позвоночного канала еще не означает, что именно они ответственны за имеющиеся у больного неврологические расстройства. Необходимо помнить, что параклинические методы обследования имеют свое значение только при их соответствии клиническим данным!
Лечение острой боли в спине
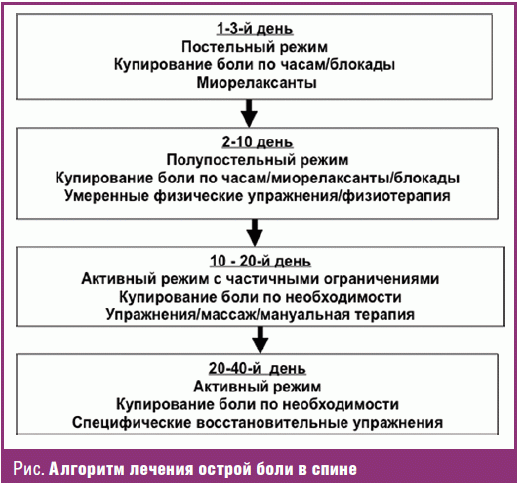
Алгоритм лечения острой боли в спине представлен на рис.
При неосложненной острой люмбалгии и некорешковой люмбоишиалгии следует ожидать значительного уменьшения боли в течение 2–4 недель. В ряде контролируемых исследований показано, что постельный режим не только не ускоряет восстановление, но и, наоборот, может способствовать хронизации болевого синдрома. Поэтому при умеренной боли необходимости в постельном режиме нет, а при интенсивной боли его следует максимально ограничить (до 1–3 дней). По мере того, как боль становится переносимой, режим расширяют, но рекомендуют на определенное время несколько ограничить физическую активность (в частности, избегать поднятия тяжести и длительного сидения). Больного следует научить, как правильно совершать движения, не увеличивая нагрузку на позвоночник. Раннее возвращение к привычному для больного уровню двигательной активности способствует более быстрому купированию боли и предупреждает ее хронизацию [1–3].
Адекватное медикаментозное купирование боли не только облегчает состояние в данный момент, но также позволяет ему быстрее вернуться к привычному для него уровню повседневной активности, что в большинстве случаев имеет критическое значение для разрешения обострения [9]. Анальгезирующие средства обычно достаточно назначить коротким курсом. В первые дни лечения предпочтительнее принимать профилактически — по часам, не дожидаясь усиления боли. Для облегчения боли применяют анальгетики (от парацетамола до трамадола и других наркотических средств) и/или НПВС внутрь, в виде ректальных свечей или внутримышечно (табл. 4).
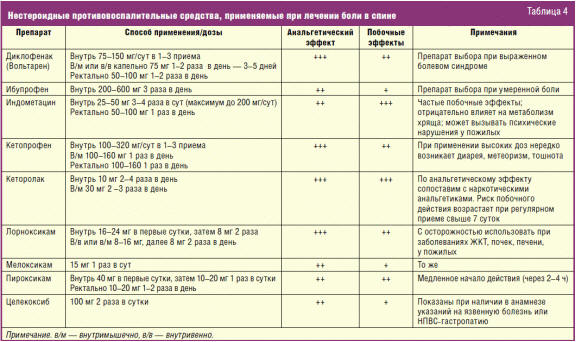
Выбор НПВС при лечении острой боли основан на необходимости максимально быстрого купирования болевого синдрома, поэтому предпочтение отдается препаратам с максимально выраженным анальгетическим и противовоспалительным действием, например, таким как диклофенак (Вольтарен), причем кратность приема на начальном этапе диктуется интенсивностью боли [8].
По возможности следует избегать длительного приема НПВС, особенно у пожилых лиц, в связи с риском побочных эффектов со стороны ЖКТ, почек, печени, сердечно-сосудистой системы. У больных с высоким риском эрозивно-язвенных поражений желудка и двенадцатиперстной кишки (лиц пожилого возраста, имеющих в анамнезе язвенную болезнь, страдающих заболеваниями сердечно-сосудистой системы, принимающих кортикостероиды и антикоагулянты) в комбинации с НПВС для защиты ЖКТ назначают блокаторы Н2-гистаминовых рецепторов (ранитидин), ингибиторы протонного насоса (омепразол) или синтетический аналог простагландинов мизопростол [10].
Селективные ингибиторы циклооксигеназы (ЦОГ) 2-го типа (коксибы) оказывают меньше побочных эффектов (прежде всего связанных с отрицательным действием на ЖКТ), чем традиционные НПВС, однако их эффективность при вертеброгенных болевых синдромах недостаточно изучена [3, 7]. В связи с этим их рекомендуют назначать лишь при плохой переносимости традиционных НПВС или наличии в анамнезе язвенной болезни желудка и двенадцатиперстной кишки. Следует отметить индивидуальную чувствительность больных к НПВС, в связи с этим при неэффективности оптимальных терапевтических доз одного из препаратов в течение 1–2 недель может быть испробован другой препарат.
Еще одним способом уменьшить риск развития системных побочных эффектов (в том числе и со стороны ЖКТ), связанных с приемом неселективных НПВС, является использование этих препаратов в формах для местного применения. Преимуществом таких форм является их низкая системная биодоступность, наряду с возможностью обеспечить достаточно высокую концентрацию действующего вещества в очаге воспаления.
Интересно заметить, что на сегодняшний день местные НПВС — это, пожалуй, одни из самых противоречивых средств. Несмотря на то, что местные формы НПВС уже давно и успешно используются в странах Западной Европы, часть клиницистов до сих пор рассматривают их как препараты, эффективность которых лишь немногим выше, нежели плацебо. Необоснованность подобного суждения подтверждается рядом контролируемых исследований, так, например, при использовании местных форм диклофенака (Вольтарена) его концентрация в плазме крови в 50 раз ниже, чем в случае перорального приема, тогда как концентрация в очаге воспаления сопоставима с таковой при пероральном приеме [6]. Таким образом, при сопоставимой эффективности местных НПВС с аналогичными пероральными препаратами, более низкая концентрация в общем кровеносном русле позволяет избежать ряда побочных эффектов. Наиболее широко представлены различные лекарственные формы у препарата Вольтарен (диклофенак): гель, спрей, трансдермальный пластырь. Различная концентрация действующего вещества в этих формах позволяет обеспечить более индивидуализированный подход к пациенту, с более легким подбором дозы, а также необходимой кратностью приема. Так, например, трансдермальный пластырь с содержанием диклофенака 15 и 30 мг удобен тем, что он действует в течение суток и может применяться один раз в день, а также позволяет варьировать необходимую дозу в зависимости от выраженности болевого синдрома. Вольтарен эмульгель также представлен в двух дозировках — 1% и 2% (следует отметить, что наличие 2% эмульгеля обеспечивает не только больший клинический эффект, но и возможность нанесения препарата всего два раза в сутки); наконец, третьей лекарственной формой является 4% спрей Вольтарен, который может использоваться в качестве «скорой помощи» за счет большей концентрации. Начиная с 2007 года в США (согласно рекомендации Управления по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drugs Administration of the United States, FDA)) и с 2008 года в Англии (согласно рекомендации Национального института здоровья и клинической квалификации (National Institute for Health and Clinical Excellence, NICE) они являются препаратами первой линии в лечении остеоартрита [11].
Облегчению боли могут также способствовать холод или легкое сухое тепло, тогда как глубокое или сильное прогревание чаще ее усиливает. Воздействие на мышечно-тонический компонент боли предполагает постизометрическую релаксацию, массаж и лечебную гимнастику, включающую упражнения на укрепление мышечного корсета или растяжение спазмированных мышц, применение миорелаксантов (тизанидина, баклофена), обычно не дольше 2 недель [8].
При фасеточном синдроме паравертебрально проводят двустороннюю блокаду фасеточных суставов (иногда на нескольких смежных уровнях). Эти методы можно сочетать с рефлексотерапией, другими физиотерапевтическими процедурами (диадинамические токи, синусоидально-модулированные токи, электрофорез с местными анестетиками, фонофорез с гидрокортизоном и т. д.).
При корешковом синдроме сроки восстановления удлиняются до 6–8 недель. Принципы лечения остаются теми же — постельный режим в течение нескольких дней, анальгетики и НПВС, лечебная гимнастика. Особенность лечения состоит в более широком применении лечебных блокад и средств, воздействующих на невропатическую боль, в том числе антидепрессантов (например, амитриптилина) и антиконвульсантов (например, карбамазепина). Если больной лечится в стационаре, то в остром периоде целесообразны эпидуральные блокады [2, 3].
Мануальная терапия при острой и подострой боли в спине может способствовать более быстрому восстановлению, однако в остром периоде грыжи диска, особенно при наличии признаков компрессии корешка, она противопоказана. Хотя на практике широко применяют различные варианты вытяжения, убедительных данных в пользу его эффективности нет. В резистентных случаях при грыже диска иногда прибегают к ферментативному лизису диска с помощью внутридискового введения химопапаина [1–3].
Оперативное вмешательство показано: 1) при остром сдавлении конского хвоста, сопровождающемся нарастанием нижнего парапареза и тазовых нарушений; 2) при сдавлении корешка, вызывающего нарастающий парез; 3) при тяжелом инвалидизирующем болевом синдроме, не поддающемся консервативному лечению (в этом случае решающее слово принадлежит самому больному).
Литература
- Левин О. С. Диагностика и лечение неврологических проявлений остеохондроза позвоночника // Consilium Medicum. 2004. Т. 6. № 8.
- Левин О. С., Штульман Д. Р. Неврология: справочник практ. врача. 9-е изд., доп. и перераб. М.: Медпресс-информ, 2013. С. 183–200.
- Ляшенко Е. А., Жезлов М. А., Левин О. С. Острая боль в спине: алгоритмы диагностики и терапии // Фарматека. 2013. № 13. С. 87–94.
- Попелянский Я. Ю. Ортопедическая неврология (вертеброневрология). М.: Медпресс-информ, 2003.
- Bogduk N., McGuirk B. Medical management of acute and chronic low back pain. Amsterdam: Elsevier, 2002.
- Brunner M., Dehghanyar P., Seigfried B., Martin W., Menke G., Müller M. Favourable dermal penetration of diclofenac after administration to the skin using a novel spray gel formulation // Br J Clin Pharmacol. 2005; 60: 573–577.
- Feldman M., McMhon A. T. Do COX-2 inhibitors provide benefits similar to those of traditional nonsteroidal anti–inflammatory drugs with less gastrointestinal toxicity? // Ann. Intern. Med. 2000. V. 132. P.134–143.
- Gerster J. C. Medical treatment of low back pain according to evidence-based medicine // Praxis. 2000, Apr 6; 89 (15): 619–623.
- Hall H. Back pain. J. H. Noseworthy (eds). Neurological therapeutics: principles and practice. London: Martin Dunitz, 2003.
- Henry D., Lim L. L., Garcia Rodriguez L. A. et al. Variability in risk of gastrointestinal complications with individual non-steroidal anti-inflammatory drugs: a results of a collaborative meta-analysis // BMJ. 1996. V. 312. P. 1563–1566.
- Massey T., Derry S., Moore R. A., McQuay H. J. Topical NSAIDs for acute pain in adults (Review) Copyright © 2012 The Cochrane Collaboration. Published by JohnWiley & Sons, Ltd.
- McCulloch J. A., Transfeldt E. E. Macnab’s Backache. Baltimore. Williams & Wilkins, 1997.
- Quintero S., Manusov E. G. The disability evaluation and low back pain // Prim Care. 2012; 39 (3): 553–559. doi: 10.1016/j.pop.2012.06.011.
- Strong J. A., Xie W., Bataille F. J., Zhang J. M. Preclinical studies of low back pain // Mol Pain. 2013, Mar 28; 9: 17. doi: 10.1186/1744–8069–9-17.
- Waddel G. The back pain revolution. Edinburg. Churchill Livingstone, 1998.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru