Введение
Распространенность острых респираторных вирусных инфекций (ОРВИ) не вызывает сомнений. Тем не менее, как показала практика, этиология и годовая динамика респираторных заболеваний претерпели значительные изменения при сравнении с периодом до пандемии COVID-19 и с периодом пандемии, когда практически не диагностировались некоторые из ОРВИ, в частности грипп. После пандемии вновь мы видим появление гриппа А и В в сочетании с другими вирусными инфекциями. Безусловно, помимо своевременной диагностики, следует отметить важность раннего назначения противовирусных препаратов. В этой связи изучение эффективности и безопасности противовирусных препаратов широкого действия, к которым относится инозин пранобекc, является важным направлением для оптимизации терапии ОРВИ в Российской Федерации (РФ).
Инозин пранобекс — результаты исследований
Инозин пранобекс был зарегистрирован в 1971 г., почти 55 лет назад, более чем в 70 странах мира, под разными торговыми названиями. Препарат разрешен к применению у детей с 3 лет в РФ. Инозин пранобекс представляет собой комплекс, содержащий инозин и N,N-диметиламино-2-пропанол в молярном соотношении 1:3, который обладает противовирусным и иммуномодулирующим действием[1]
[1, 2]. Лекарственная форма в виде сиропа удобна для приема у детей, суточная доза составляет 50 мг/кг массы тела (1 мл/1 кг), разделяется на 3–4 приема. Продолжительность лечения варьирует от 5 до 10–14 дней в зависимости от тяжести, этиологии, сочетанных инфекций.
За столь длительный срок применения инозина пранобекса в мире и 17-летний в РФ накоплен огромный опыт применения данного препарата в качестве противовирусного средства при различных вирусных инфекциях гриппозной и негриппозной этиологии, герпесвирусов 1–6-го типа у детей, вариантов сочетанных инфекций (вирусно-вирусных и вирусно-бактериальных), а также COVID-19.
В систематическом обзоре И.В. Бабаченко [2] были подробно представлены и описаны исследования, анализирующие проблемы лечения и профилактики ОРВИ инозином пранобексом, в частности препаратом Гроприносин®, детей разного возраста с различным анамнезом, соматическими заболеваниями, часто болеющих детей, пациентов с аллергозами, хроническими заболеваниями.
Отдельно следует остановиться на проведении плацебо-контролируемых исследований в медицинской практике, и особенно — в педиатрии, поскольку нередко от респондентов поступает вопрос о «доказательности» исследований в отношении того или иного лекарства. Чтобы ответить на этот вопрос, обратимся к фактам. В 2002 г. Всемирная медицинская ассоциация (ВМА) опубликовала разъяснительное сообщение с пояснениями параграфа 29 Хельсинкской декларации о проведении плацебо-контролируемых исследований. Эта организация представляет собой крупнейшее глобальное собрание врачей, и, следовательно, ВМА является авторитетной структурой для издания заявлений от имени всего медицинского сообщества [3], однако споров по многим положениям достаточно. Настоящим сообщением ВМА подтверждает свою позицию, согласно которой при использовании плацебо-контролируемого исследования следует проявлять особую осторожность и в целом применять эту методологию только при отсутствии существующей доказанной терапии. Однако плацебо-контролируемое исследование может быть приемлемым с этической точки зрения при следующих обстоятельствах:
если по убедительным и научно обоснованным методологическим причинам его использование необходимо для определения эффективности или безопасности профилактического, диагностического или терапевтического метода;
если профилактический, диагностический или терапевтический метод исследуется для лечения легкого заболевания и пациенты, получающие плацебо, не будут подвергаться какому-либо дополнительному риску серьезного или необратимого вреда.
Помимо требования об информированном согласии всех участников испытания препарата, стандартной практикой является также информирование всех испытуемых о том, что они могут получать исследуемый препарат или плацебо [3].
Таким образом, плацебо-контролируемые двойные слепые исследования по каким-либо препаратам обычно проводятся среди пациентов старше 18 лет, которым объясняется суть и цели исследования, и они подписывают соответствующее информированное согласие. По сути, в сравниваемой группе «плацебо» находятся пациенты без лечения или получают симптоматическое лечение. В педиатрической практике двойные плацебо-контролируемые исследования проводятся после тщательного мониторинга участников, исключения пациентов с повышенным риском причинения вреда здоровью, более строго осуществляется контроль за исследованием. Во взрослой практике такие исследования проводятся в разных областях (кардиологической, хирургической, при оценке новых антибиотиков и т. д.).
Для исследования эффективности инозина пранобекса было проведено плацебо-контролируемое исследование J. Beran et al. [4]. В исследование было включено 463 пациента (в возрасте от 18 до 50 лет), из которых 231 получал инозин пранобекс в дозе 500 мг и 232 — «плацебо» в течение 7 дней. Было статистически доказано, что у пациентов моложе 50 лет без коморбидности (ожирения), получавших инозин пранобекс, происходило более быстрое купирование всех клинических симптомов по сравнению с пациентами группы «плацебо». Результаты подтвердили безопасность и эффективность инозина пранобекса у пациентов (без ожирения) с гриппоподобными инфекциями в возрасте до 50 лет. Общее число нежелательных явлений (НЯ) — 17% (против 20,4% в группе «плацебо»). Большинство НЯ были легкой или умеренной степени и, по мнению исследователей, не были связаны с применением исследуемого препарата.
За последние годы (2019–2024 гг.) в РФ была проведена серия многоцентровых программ, целью и задачами которых являлся анализ течения ОРВИ у детей различных возрастных групп, включая оценку динамики клинических симптомов, частоты и причин развития осложнений. Изучались эффективность и безопасность терапевтических подходов, в частности, применения инозина пранобекса (например, Гроприносина) в амбулаторно-поликлинической практике. Данные исследования, перечисленные в таблице, были проведены в периоды эпидподъема ОРВИ. Следует также отметить, что этот временной период (2019–2025) объединил три периода («доковидный», «ковидный» и «постковидный»).
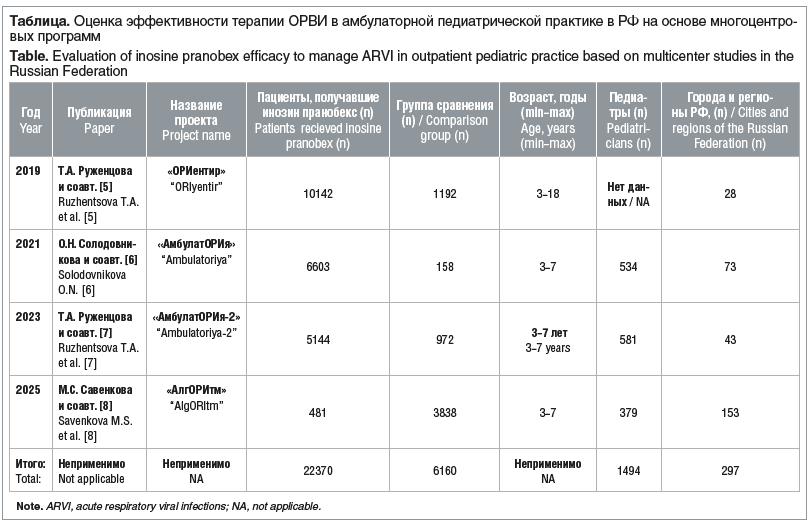
В 2019 г. (до пандемии COVID-19) была проведена программа «ОРИентир», посвященная анализу эффективности и безопасности противовирусной терапии ОРВИ, в рамках которого изучалось применение инозина пранобекса [5]. В программе приняли участие дети в возрасте от 3 до 18 лет, в основной группе общее количество составило 10 142, во второй группе контроля 1192 ребенка получали другие препараты. Согласно полученным результатам, в группе пациентов, получавших терапию с включением инозина пранобекса, продолжительность симптомов ОРВИ была короче более чем на сутки по сравнению с контрольной группой, в 4 раза реже развивались осложнения. Анализ профиля безопасности показал хорошую переносимость терапии [5].
В 2021 г. (ковидный период) была инициирована программа под названием «АмбулатОРИя». Ее целью являлся анализ продолжительности клинических симптомов ОРВИ на фоне применения различных схем противовирусной терапии в амбулаторной педиатрической практике.
В рамках исследования когорта из 6603 пациентов получала инозин пранобекс в форме сиропа Гроприносин®-Рихтер. В группе сравнения (158 детей) терапия проводилась с использованием других противовирусных средств. В основной группе нормализация температуры тела наблюдалась на 3–5-е сутки, а купирование катаральных симптомов — на 5–7-е сутки от начала лечения. В данном исследовании было отмечено, что выбор препарата для назначения у 82% врачей базировался на данных ранее проведенных клинических исследований [6].
В 2023 г. была проведена программа «Амбулатория-2» [7]. Цель заключалась в оценке результатов противовирусной терапии у детей. Оценивали клинические проявления ОРВИ, их продолжительность, проводимую терапию ОРВИ в условиях поликлиники, развитие осложнений. Оценивались 3 группы: 1-я группа получала инозин пранобекс в форме сиропа (5144 ребенка), 1-я группа сравнения — другие противовирусные препараты (654 ребенка), 2-я группа сравнения не получала противовирусных и иммуномодулирующих препаратов (318 детей). У пациентов, получавших инозин пранобекс, продолжительность заболевания была статистически значимо меньше (5,97±1,57 сут), чем в группах сравнения. В основной группе у 5,6% детей в периоде реконвалесценции сохранялись жалобы на кашель, заложенность носа, выделения из носа, першение в горле. В группах сравнения (1-й и 2-й) таких жалоб было больше (в 4,2 и 3,4 раза соответственно). Применение инозина пранобекса позволило сократить частоту развития осложнений в 3 раза, в группах сравнения их было в 5 и 3,3 раза больше. Было замечено, что в настоящее время имеет место схожесть клинических проявлений сезонных вирусных инфекций, гриппа, COVID-19, а также персистирующих герпесвирусных инфекций. Авторы делают соответствующий вывод о преимуществе применения препарата инозин пранобекс с широким комбинированным противовирусным и иммуномодулирующим спектром действия [7].
В 2024 г., в постковидный период, была проведена крупномасштабная программа «АлгОРИтм», охватившая 115 городов и 38 областей РФ [8]. В ней приняли участие 379 врачей-педиатров, которые сами назначали препараты. В исследовании проведено наблюдение за 4319 детьми с установленным диагнозом ОРВИ/ОРИ в возрасте от 3 лет до 7 лет 11 мес. В зависимости от назначаемых врачами препаратов дети были разделены на 3 группы: 1-я группа (481 ребенок) получала терапию препаратом Гроприносин®, 2-я группа (419 детей) — терапию другими препаратами противовирусного и интерферонсодержащего действия, 3-я группа (3419 детей) — только симптоматическую терапию. В 1-й группе было достоверно меньше клинических симптомов (ринит, заложенность носа, кашель, наличие мокроты), а также отмечена более быстрая и плавная динамика регресса клинических симптомов (на 2 дня раньше, чем в 3-й группе, — без противовирусных препаратов). Максимум всех симптомов в 1-й группе пришелся на 3-й день болезни, тогда как во 2-й и 3-й — на 5-й день болезни, а нередко продолжительность ОРВИ достигала 10 дней. Было выявлено, что заболеваемость ОРВИ у детей 4–5 лет была наиболее высокая, причем в 7 раз больше у тех, кто не получал противовирусные препараты (3-я группа).
В работе отмечено, что, к сожалению, почти 80% (79,2%) педиатров не назначали противовирусных препаратов при развитии ОРВИ. К чему это привело? Общее количество осложнений выявлено у 792 детей, что составило 18,3% от всех детей. В целом осложнений в 3-й группе было в 5,5 и 5,8 раза больше, чем в 1-й и 2-й группах (р<0,0001). Антибиотики были применены у 12,3% от общего количества детей (n=4319). Всего было назначено 533 антибактериальных препарата, преимущественно из группы защищенных аминопенициллинов (66,8%), реже — макролидов (16,1%) и цефалоспоринов (15,2%). Статистический анализ показал, что частота назначения антибактериальной терапии была достоверно ниже в группах пациентов, получавших противовирусное лечение (11,8 и 17,0% в 1-й и 2-й группах соответственно), по сравнению с группой, где такая терапия не проводилась (71,2%). Таким образом, отсутствие противовирусной терапии приводит не только к риску развития осложнений, но и к связанному с ними назначению антибиотиков [8].
В качестве симптоматической терапии при ОРВИ у детей педиатры чаще всего назначали интраназальные (34,5%) и противокашлевые (17,0%) препараты, жаропонижающие средства (13,7%), препараты для лечения инфекции в ротоглотке (13,4%), причем количество этих медикаментов в группе детей, находящихся на симптоматическом лечении без противовирусной терапии, соответствовало понятию «полипрагмазия».
Заключение
Таким образом, в РФ были проведены крупномасштабные программы по оценке эффективности и безопасности терапии ОРВИ у детей в амбулаторной практике, в которых приняли участие 1494 врача-педиатра, наблюдавших 28 530 детей разного возраста. Целью программ являлась оценка эффективности терапии с применением противовирусных препаратов, включая инозин пранобекс. Полученные результаты свидетельствуют о том, что своевременное назначение противовирусной терапии может способствовать сокращению продолжительности респираторного заболевания, снижению частоты бактериальных осложнений и, как следствие, уменьшению числа назначений антибактериальных препаратов. Данные результаты могут рассматриваться в качестве основания для включения инозина пранобекса в клинические рекомендации различных профилей, что поспособствует оптимизации фармакотерапии, а также профилактике антибиотикорезистентности в клинической практике.
Сведения об авторах:
Савенкова Марина Сергеевна — д.м.н., главный внештатный инфекционист Троицкого и Новомосковского административных округов, профессор кафедры клинической функциональной диагностики факультета дополнительного профессионального образования ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-1648-8683
Савенков Михаил Петрович — д.м.н., профессор, заведующий кафедрой клинической функциональной диагностики факультета дополнительного профессионального образования ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-3428-1459
Контактная информация: Савенкова Марина Сергеевна, e-mail: mpsavenkov@mail.ru
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.05.2025.
Поступила после рецензирования 23.06.2025.
Принята в печать 16.07.2025.
About the authors:
Marina S. Savenkova — Dr. Sc. (Med.), Chief Freelance Infectious Disease Expert of the Troitsk and Novomoskovsk
Administrative Districts, Professor of the Department of Clinical Functional Diagnosis, Faculty of Additional Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0002-1648-8683
Mikhail P. Savenkov — Dr. Sc. (Med.), Professor, Head of the Department of Clinical Functional Diagnosis, Faculty of Additional Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0002-3428-1459
Contact information: Marina S. Savenkova, e-mail: mpsavenkov@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.05.2025.
Revised 23.06.2025.
Accepted 16.07.2025
[1] Инструкция по применению препарата Гроприносин® (Электронный ресурс.) URL: https://groprinosinrichter.ru/instruction/ (дата обращения: 02.06.2025).
Информация с rmj.ru



