Педиатрия
Ключевые слова: анемия, дети, железодефицитные состояния, железодефицитная анемия, латентное железодефицитное состояние.
Для цитирования: Васильева Т.М., Захарова И.Н., Заплатников А.Л., Лазарева С.И., Мачнева Е.Б. Алгоритм диагностики и лечения железодефицитных состояний у детей // РМЖ. 2018. №9. С. 2-7
T.M. Vasilyeva1,2, I.N. Zakharova1, A.L. Zaplatnikov1, S.I. Lazareva2, E.B. Machneva1
1 Russian Medical Academy of Continuous Professional Education, Moscow
2 Children’s City clinic № 133 of the Moscow City Health Department
Iron deficiency disorders (IDD) are the most common deficiency conditions in the human population, most common in children and women of reproductive age. Depending on the degree of severity of iron deficiency in the body, the latent iron deficiency state (LID) and iron deficiency anemia (IDA) are identified. The clinical manifestations of IDD are non-specific, and therefore their diagnosis is based on the identification of characteristic laboratory changes, which include: a decrease in the serum concentration of iron, ferritin and a decrease in the saturation index of transferrin by iron. In this case, if these laboratory markers are detected at a normal level of hemoglobin, the LID is diagnosed. In the same cases, when hypochromic, microcytic anemia takes place simultaneously with laboratory signs of iron deficiency (the criteria of which are reduction of hemoglobin concentration, decrease in the values of «blood color indices» and average volume of erythrocytes), the IDA diagnosed. At the same time, irrespective of the form of iron deficiency, the main method of therapy is the use of iron preparations. The choice of specific iron-containing drugs, as well as the way they are administered, the duration of the course of treatment and the dosage regimen depend on the initial degree of severity of iron deficiency, the age of the child and the state of the health in general.
Key words: anemia, children, iron deficiency, iron deficiency anemia, latent iron deficiency.
For citation: Vasilyeva T.M., Zakharova I.N., Zaplatnikov A.L. et al. Algorithm for diagnosis and treatment of iron deficiency in children // RMJ. 2018. № 9. P. 2–7.
В статье представлен алгоритм диагностики и лечения железодефицитных состояний у детей. Рассмотрен выбор конкретных железосодержащих лекарственных средств, а также способ их введения, продолжительность курса лечения и режим дозирования.
Содержание статьи
Актуальность
Железодефицитные состояния (ЖДС) — самые распространенные дефицитные состояния в человеческой популяции, которые наиболее часто встречаются у детей и женщин репродуктивного возраста [1–7]. Так, установлено, что явный или скрытый дефицит железа имеет место практически у половины детей дошкольного возраста и беременных женщин [8]. При этом отмечено, что распространенность ЖДС неодинакова в различных странах и зависит от социальных и экономических условий [1].
Особо следует подчеркнуть, что вопросы своевременной диагностики и адекватного лечения ЖДС имеют наибольшую остроту в детской практике. При этом актуальность проблемы ЖДС в педиатрии обусловлена не только широким распространением, но и существенным неблагоприятным влиянием дефицита железа на состояние здоровья детей. Доказано, что ЖДС является причиной нарушения функций многих органов и систем организма. Это обусловлено тем, что железо входит в состав многих белков (гемоглобин, миоглобин, цитохромы, железосеропротеиды, оксидазы, гидроксилазы, супероксиддисмутазы и др.), обеспечивающих системный и клеточный аэробный метаболизм и окислительно-восстановительный гомеостаз организма в целом. Так, цитохромы и железосеропротеиды необходимы для транспорта электронов, а гемоглобин — для транспорта кислорода. В свою очередь, такие железосодержащие белки, как оксидазы, гидроксилазы и супероксиддисмутазы, обеспечивают адекватный уровень окислительно-восстановительных реакций в организме [9, 10]. Установлено, что недостаточное содержание в организме железа неблагоприятно сказывается на метаболических процессах, что приводит к нарушению функционирования различных органов и систем. При этом доказано, что прогрессирующее ЖДС сопровождается анемией, нарушением роста и развития детей, в частности психомоторного развития, изменением поведения, снижением интеллекта, дисфункциями иммунитета и другими патологическими проявлениями [1–9, 11–13].
Причины развития ЖДС
Основными причинами ЖДС являются недостаточное поступление железа в организм, плохое его всасывание в кишечнике и повышенные потери. При этом следует отметить, что для определенных этапов роста и развития детского организма имеются характерные факторы риска ЖДС. Так, в антенатальном периоде к дефициту железа в организме плода и новорожденного приводят: нарушение маточно-плацентарного кровообращения, фетоплацентарные и фетоматеринские кровотечения, фетофетальная трансфузия при многоплодной беременности, внутриутробная мелена, недоношенность, а также дефицит железа у матери (длительный латентный). Факторами риска развития ЖДС в интранатальный период являются: преждевременная перевязка пуповины, фетоплацентарная трансфузия, геморрагический синдром различного генеза (кровотечения из-за травматичных акушерских пособий или аномалий развития плаценты и сосудов пуповины) [1, 6].
В постнатальном периоде ведущая роль в развитии ЖДС у детей принадлежит алиментарному фактору. Так, на первом году жизни неадекватное вскармливание ребенка (использование неадаптированных молочных заменителей грудного молока, позднее введение мясных продуктов, недостаточное содержание железа в рационе детей с ускоренными темпами роста — недоношенные, макросоматики, лимфатики) приводит к ЖДС. В последующие периоды детства алиментарный фактор также может играть ведущую роль в развитии ЖДС (нарушение пищевого поведения, веганство, вегетарианство). Особое внимание необходимо обратить на то, что фактором риска ЖДС может стать несбалансированное питание с недостаточным содержанием мясных продуктов в рационе детей, профессионально занимающихся спортом [1, 6].
Нарушение всасывания железа из кишечника может быть обусловлено различными заболеваниями ЖКТ (наследственные и приобретенные синдромы мальабсорбции, хронические воспалительные заболевания кишечника, паразитарные инвазии). Среди основных причин ЖДС, связанных с повышенными потерями железа из организма, следует отметить длительный легкий геморраж из ЖКТ при гастроинтестинальных проявлениях пищевой аллергии (у детей раннего возраста — наиболее часто на белки коровьего молока), а также кровотечения различной локализации и этиологии. При этом группой особо высокого риска по развитию ЖДС являются девушки в период становления менструальной функции [1, 6].
Клиническая картина ЖДС
Развитие ЖДС имеет стадийный характер. При этом сначала происходит опустошение тканевых запасов железа, в то время как в органах кроветворения его уровень остается в пределах нормативных значений. В результате уменьшения содержания железа в тканях снижается активность железосодержащих ферментов, что проявляется симптомами сидеропении. Клинически при этом можно отметить сухость кожи; ломкость, слоистость, поперечную исчерченность и ложкообразную форму ногтей; глоссит, гингивит, стоматит, дисфагию, диспепсические нарушения. Следует подчеркнуть, что на ранних стадиях ЖДС значимых нарушений эритропоэза нет, что и определяет отсутствие анемического синдрома в этот период. Состояние, при котором недостаток железа в тканях и органах организма не сопровождается анемией, принято называть латентным железодефицитом. В случае дальнейшего нарастания дефицита железа в организме уменьшается его содержание и в органах кроветворения. Это приводит к снижению синтеза гемоглобина и развитию анемии. На данном этапе к клиническим проявлениям сидеропении добавляется симптоматика анемического синдрома (вялость, слабость, быстрая утомляемость, снижение физической активности, тахикардия, приглушенность сердечных тонов и т. д.). Стадию ЖДС, при которой уменьшение содержания железа в организме сопровождается нарушением эритропоэза с развитием гипохромной микроцитарной анемии, терминологически определяют как железодефицитную анемию (ЖДА) [1–7].
Диагностика ЖДС
Принимая во внимание низкую специфичность клинических проявлений сидеропении и анемического синдрома, критериями диагностики латентного железодефицита (ЛЖДС) и ЖДА являются характерные лабораторные признаки. При этом показано, что для верификации ЖДС могут быть использованы рутинные лабораторные методы исследования, которые доступны для широкой практики (клинический анализ крови, определение в сыворотке крови железа, ферритина и общей железосвязывающей способности с последующим вычислением коэффициента насыщения трансферрина железом). Особо следует отметить, что поскольку ферритин относится к протеинам воспаления, то его определение должно проводиться одновременнно с С-реактивным белком (СРБ) [1–7, 14, 15].
При этом следует подчеркнуть, что для корректной трактовки клинического анализа крови необходимо оценить все показатели, представленные в гемограмме. Нельзя ограничиваться только анализом уровня гемоглобина, лейкоцитов и СОЭ. Должны быть обязательно интерпретированы такие показатели, как количество эритроцитов и ретикулоцитов, эритроцитарные индексы, «лейкоцитарная формула», абсолютные значения нейтрофилов, лимфоцитов, моноцитов, эозинофилов, тромбоцитов, а также тромбоцитарные индексы [14–16].
Лабораторным критерием анемии является снижение концентрации гемоглобина ниже возрастной нормы. При этом установлено, что нижней границей нормы гемоглобина для детей в возрасте от 1 мес. до 5 лет является уровень 110 г/л, для детей 6–12 лет — 115 г/л, для детей старше 12 лет и подростков — 120 г/л. Следует отметить, что уже на первом этапе расшифровки клинического анализа крови можно не только выявить анемию, но и определить ее тяжесть. Критерием тяжести анемии является степень снижения концентрации гемоглобина (Нb). Так, у детей старше одного месяца жизни используются следующие подходы: снижение Нb до 90 г/л — признак легкой анемии, уровень Нb в пределах 70–90 г/л — маркер среднетяжелой анемии, снижение Нb ниже 70 г/л — критерий тяжелой анемии [6].
Выявление лабораторных признаков анемии определяет необходимость обязательной одновременной оценки значений и других показателей гемограммы. Если при этом анемия сочетается с другими изменениями в клиническом анализе крови (лейкопения, агранулоцитоз, тромбоцитопения), к курации пациента необходимо привлекать гематолога. В тех же случаях, когда в клиническом анализе имеют место только маркеры анемии, врач-педиатр может продолжить поиск причин заболевания самостоятельно. Для этого следующим диагностическим шагом является оценка эритроцитарных индексов, представленных в анализе крови (рис. 1). При этом в первую очередь обращают внимание на показатели, характеризующие степень насыщения эритроцитов гемоглобином. К ним относятся цветовой показатель (ЦП) и среднее содержания гемоглобина в эритроците — MCH (Mean Corpuscular Hemoglobin). В зависимости от степени насыщения эритроцитов гемоглобином различают анемии нормохромную (адекватное содержание Нb в эритроцитах), гипохромную (недостаточное содержание Нb в эритроцитах) и гиперхромную (избыточное содержание Нb в эритроцитах).
При снижении гемоглобина ниже возрастной нормы и обнаружении признаков гипохромии эритроцитов (ЦП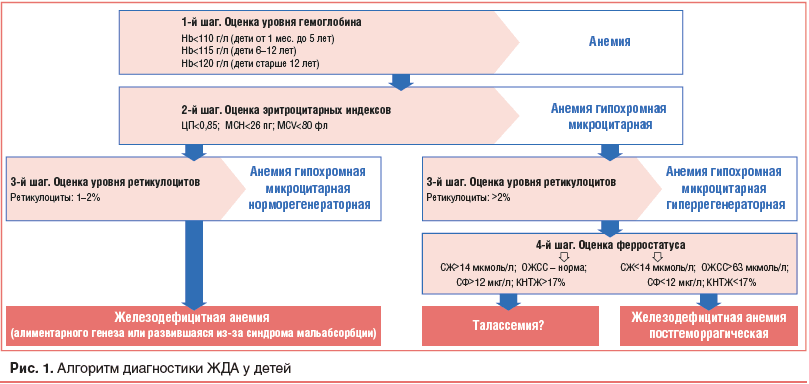
В тех же случаях, когда гипохромная микроцитарная анемия сопровождается повышением уровня ретикулоцитов (>2%), констатируют гиперрегенераторный характер анемии. При этом следует помнить, что указанные характеристики анемии могут быть как при ЖДА, развившейся в результате кровопотери (постгеморрагическая ЖДА), так и при талассемии. Напомним, что талассемии — это группа наследственных заболеваний, обусловленных нарушением
синтеза альфа- или бета-цепей гемоглобина, при которых уровень железа в организме не только не снижается, но в ряде случаев даже повышен. Установлено, что талассемия имеет четкую этническую связь. Так, бета-талассемия чаще всего встречается у выходцев из Средиземноморья, Среднего Востока и Индии, а альфа-талассемия — у выходцев из Африки и Юго-Восточной Азии. Учитывая это, при выявлении гипохромной микроцитарной анемии у ребенка с указанной этнической принадлежностью, помимо поиска типичных клинических (легкая иктеричность, гепатоспленомегалия) и лабораторных (мишеневидность эритроцитов) проявлений талассемии, необходимо детализировать семейный анамнез, обращая особое внимание на состояние здоро-вья ближайших родственников (хроническая анемия, гепатоспленомегалия, холелитиаз с молодого возраста и др.) [17–20].
Таким образом, при выявлении гипохромной микроцитарной гиперрегенераторной анемии необходимо проводить дифференциальный диагноз между ЖДА постгеморрагического генеза и талассемией (см. рис. 1). Поскольку при талассемии, в отличие от ЖДА, содержание железа в организме не снижается, то для уточнения генеза заболевания в этом случае необходимо исследовать ферростатус ребенка. Для этого в сыворотке крови определяют уровень железа (СЖ), ферритина (ФС), общей железосвязывающей способности (ОЖСС), а также вычисляют коэффициент насыщения трансферрина железом (КНТЖ). Одновременно с ФС целесообразно исследовать СРБ, т. к. ферритин относится к белкам воспаления и его значение может иметь ложноположительный уровень при воспалительном процессе в организме.
Если при обследовании ребенка с гипохромной микроцитарной гиперрегенераторной анемией обнаруживается нормальный или повышенный уровень ЖС, ФС (при нормальных значениях СРБ) и КНТЖ, то необходимо в первую очередь предположить наличие талассемии. Для этого пациента направляют на консультацию к гематологу, который проводит исследование осмотической резистентности эритроцитов, электрофорез гемоглобина, а при необходимости рекомендует генетическое обследование. Если гипохромная микроцитарная гиперрегенераторная анемия сопровождается снижением СЖ (<14 мкмоль/л), ФС (<12 мкг/л), КНТЖ (<17%) и одновременным повышением ОЖСС (>63 мкмоль/л), то имеет место ЖДА постгеморрагического генеза (см. рис. 1).
Диагностика латентных ЖДС
Лабораторные критерии снижения содержания железа в организме (СЖ63 мкмоль/л) используются не только для диагностики ЖДА, но и для верификации ЛЖДС (табл. 1). Следует напомнить, что ЛЖДС — это начальная стадия дефицита, при которой истощаются тканевые запасы железа в организме, но еще отсутствуют глубокие нарушения эритропоэза, что и объясняет отсутствие анемического синдрома. В результате этого лабораторные изменения при ЛЖДС характеризуются только особенностями ферростатуса, типичными для железодефицита, и не сопровождаются признаками анемии. Поскольку клинические признаки ЛЖДС неспецифичны, а анемический синдром на ранних стадиях железодефицита в организме отсутствует, то в подавляющем большинстве случаев ЛЖДС не диагностируется. В связи с этим истинная частота распространенности ЛЖДС в детской популяции (в т. ч. в России) остается неуточненной. В то же время результаты проведенных пилотных исследований свидетельствуют о том, что в целевых группах и/или в определенных регионах нашей страны частота ЛЖДС может достигать 40% [5–7, 20–24]. В связи с этим актуальность проведения скрининга для своевременного выявления ЛЖДС не вызывает сомнений. Однако понятно, что в условиях рутинной педиатрической практики скрининг ЖДС, основанный на определении в венозной крови ферростатуса, в подавляющем большинстве случаев не может быть реализован. В связи с этим в настоящее время активно изучаются альтернативные способы ранней диагностики ЛЖДС, основанные на исследовании новых показателей клинического анализа крови [6, 16, 23, 24].![Таблица 1. Лабораторные критерии ЖДС у детей [6] Таблица 1. Лабораторные критерии ЖДС у детей [6]](https://medblog.su/wp-content/uploads/2018/12/1543760103_524_algoritm-diagnostiki-i-lecheniya-zhelezodefitsitnyh-sostoyanij-u-detej-vasileva-t-m-zaharova-i-n-zaplatnikov-a-l-lazareva-s-i-machneva-e-b.png)
Появление в практическом здравоохранении гематологических анализаторов последнего поколения позволяет при исследовании клинического анализа крови дополнительно определить степень насыщения ретикулоцитов гемоглобином (показатель Ret-Hb) и разницу между содержанием гемоглобина в зрелых эритроцитах и в ретикулоцитах (показатель Delta-Hb) [25]. При этом установлено, что с помощью корректной оценки указанных показателей можно выявить начальные нарушения синтеза гемоглобина при ЛЖДС. Так, если у детей из групп риска по развитию железодефицита отсутствует анемия (концентрация Hb в пределах нормы), а эритроциты характеризуются нормохромией (MCH=26–32 пг) и нормоцитозом (MCV=80–95 фл), то особое внимание необходимо уделить оценке таких показателей, как Ret-Hb и Delta-Hb. При этом выявление снижения среднего содержания гемоглобина в ретикулоцитах (Ret-Hb 2 пг) позволяет сделать вывод о том, что у ребенка имеет место значимое ЛЖДС с начальными признаками нарушений эритропоэза. Данное заключение основано на том, что ретикулоциты несут «самую свежую» информацию о состоянии эритропоэза, т. к. они обнаруживаются в кровотоке только в течение первых суток после выхода из костного мозга, средняя же продолжительность жизни эритроцитов составляет 120 дней. Таким образом, выявление низких значений насыщения ретикулоцитов гемоглобином (Ret-Hb 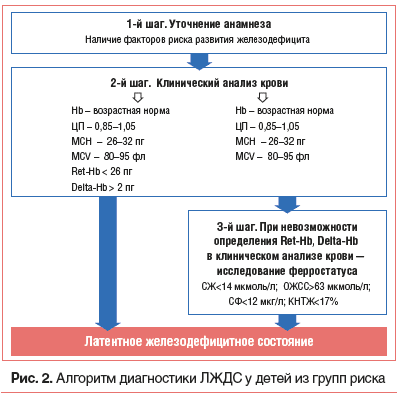
Терапия ЖДС
В основе терапии ЖДС, как латентных, так и манифестных, лежит рациональное применение препаратов железа. В подавляющем большинстве случаев для лечения ЖДС используют пероральные формы препаратов железа. Следует отметить, что в современном лекарственном арсенале врача-педиатра имеются различные по составу (солевые, гидроксид полимальтозные комплексы) и форме выпуска (таблетки, капсулы, сиропы, капли) препараты железа. Расчет индивидуальных доз препаратов при этом, независимо от формы выпуска, должен проводиться с учетом содержания элементарного железа в лекарственном средстве. Так, если используются препараты железа в виде гидроксид полимальтозного комплекса, то суточная доза элементарного железа должна составлять 5 мг/кг в сутки. В тех случаях, когда применяют солевые препараты железа, рекомендуются следующие суточные дозы элементарного железа: детям в возрасте до 3-х лет — 3 мг/кг в сутки; детям старше 3-х лет — 45–60 мг/сут; подросткам — до 120 мг/сут. При этом у детей начиная с 6 лет и у подростков для лечения ЛЖДС и ЖДА может с успехом применяться обновленная формула хорошо известного препарата Тардиферон [28].
Тардиферон является пролонгированным препаратом, в котором железо представлено в виде сульфата двухвалентного железа [28]. Следует отметить, что результаты исследований фармакокинетических особенностей обновленной формулы препарата Тардиферон [29, 30] свидетельствуют о пролонгированном высвобождении железа в желудочно-кишечном тракте. При этом было показано, что продолжительное высвобождение железа из препарата способствует его оптимальной абсорбции и хорошей переносимости [29, 30]. Подтверждение хорошей переносимости препарата Тардиферон, а также его высокой клиническо-экономической эффективности получено и в серии отечественных исследований [31, 32]. В 1 таблетке препарата Тардиферон содержится 80 мг элементарного железа, что позволяет рекомендовать следующий режим дозирования: детям 6–10 лет — 1 таблетка в сутки; детям старше 10 лет и подросткам — 1–2 таблетки в сутки [28]. Препарат Тардиферон принимают перед едой (не разжевывая), запивая водой, или во время приема пищи. Следует помнить, что препарат Тардиферон не рекомендуется применять одновременно с антацидами и тетрациклинами. Кроме этого, необходимо учитывать, что всасывание в кишечнике железа уменьшается при одновременном использовании продуктов, содержащих полифенолы (бобы, орехи, чай, кофе), фитаты (зерновые, бобовые, овощи, орехи) и большое количество пищевых волокон.
При правильно установленном диагнозе ЖДА, адекватном выборе препаратов железа и корректно подобранной дозе в клиническом анализе крови на 10–14-й день
терапии отмечается увеличение ретикулоцитов, а к концу 3–4-й недели лечения — прирост гемоглобина на 10 г/л. Нормализация уровня гемоглобина достигается через
4–8 нед. от начала терапии. В тех случаях, когда на фоне адекватно проводимой терапии в декретируемые сроки в клиническом анализе крови отсутствуют ожидаемые позитивные сдвиги, следует усомниться в правильности диагноза. Учитывая, что гипохромия эритроцитов характерна не только для ЖДА, но и для сидеробластоза и талассемии, необходимо отменить препараты железа и вернуться к диагностическому поиску причин анемии.
Считаем необходимым обратить внимание еще на один очень важный аспект — строгое соблюдение рекомендованной продолжительности применения препаратов железа при лечении ЖДС. К сожалению, на практике эти рекомендации не всегда строго соблюдаются. Нормализация уровня гемоглобина, которая, как правило, отмечается в течение 1–2 мес. от начала лечения, не должна быть поводом для отмены препаратов железа. Это обусловлено тем, что купирование анемии свидетельствует только о нормализации эритропоэза, в то время как дефицит железа в тканевых депо все еще сохраняется. Иными словами, купирование ЖДА — это устранение только верхушки айсберга, тогда как его основная часть (ЛЖДС) скрыта под водой. В связи с этим необходимо четко придерживаться следующего правила: продолжительность лечения препаратами железа определяется выраженностью ЖДС и степенью тяжести анемии. Так, при легкой степени ЖДА курс лечения препаратами железа составляет 3 мес., при среднетяжелой — 4,5 мес., при тяжелой степени — до 6 мес. [6].
Заключение
В заключение целесообразно еще раз отметить, что ранняя диагностика ЖДС, их своевременная и адекватная коррекция с помощью препаратов железа позволят существенно снизить риск нарушений функционирования различных органов и систем растущего организма, что не только позитивно скажется на состоянии здоровья ребенка, но и улучшит качество его жизни в целом.
Литература
1. Iron deficiency anemia: assessment, prevention and control. A guide for programme managers. Geneva: World Health Organization, 2001. 114 p.
2. Коровина Н. А., Заплатников А. Л., Захарова И. Н. Железодефицитные состояния у детей: учеб. пособие. К.: БЭСТ-В, 1997. 33 с. [Korovina N.A., Zaplatnikov A. L., Zakharova I. N. Zhelezodefitsitnyye sostoyaniya u detej: ucheb. posobiye. K.: BEST-V, 1997. 33 s. (in Russian)].
3. Казюкова Т. В., Самсыгина Г. А., Левина А. А. и др. Дефицит железа у детей: проблемы и решения // Педиатрия. 2002. № 1. С.17–19 [Kazyukova T.V., Samsygina G. A., Levina A. A. i dr. Defitsit zheleza u detej: problemy i resheniya // Pediatriya. 2002. № 1. S.17–19 (in Russian)].
4. Захарова И. Н., Коровина Н. А., Малова Н. Е. Современные аспекты диагностики и лечения железодефицитных состояний у детей // Вопросы современной педиатрии. 2002. Т.1. № 1. С.60–62 [Zakharova I.N., Korovina N. A., Malova N. Ye. Sovremennyye aspekty diagnostiki i lecheniya zhelezodefitsitnykh sostoyanij u detej // Voprosy sovremennoj pediatrii. 2002. T.1. № 1. S.60–62 (in Russian)].
5. Тарасова И. С. Разработка и научное обоснование скрининга железодефицитных состояний у подростков: автореф. дис. … д-ра. мед. наук. М., 2013. 67 с. [Tarasova I. S. Razrabotka i nauchnoye obosnovaniye skrininga zhelezodefitsitnykh sostoyaniy u podrostkov: avtoref. dis. … d-ra. med. nauk. M., 2013. 67 s. (in Russian)].
6. Диагностика и лечение железодефицитной анемии у детей и подростков: пособие для врачей / под ред. А. Г. Румянцева, И. Н. Захаровой. М., 2015. 75 с. [Diagnostika i lecheniye zhelezodefitsitnoj anemii u detej i podrostkov: posobiye dlya vrachey / pod red. A. G. Rumyantseva, I. N. Zakharovoy. M., 2015. 75 s. (in Russian)].
7. Захарова И. Н., Мачнева Е. Б. Лечение и профилактика железодефицитных состояний у детей // РМЖ. 2013. № 14. С.789–792 [Zakharova I.N., Machneva Ye.B. Lecheniye i profilaktika zhelezodefitsitnykh sostoyanij u detej // RMZH. 2013. № 14. S.789–792 (in Russian)].
8. Osendarp S., Murray-Kolb L., Black M. Case study on iron in mental development — in memory of John Beard (1947–2009) // Nutr. Rev. 2010. Vol. 68 (Suppl. 1). Р.48–52.
9. Iron nutrition in health and disease / Ed. L. Hallberg, N. G. Asp. London: Libbey and Co, 1996.
10. Эллиот В., Эллиот Д. Биохимия и молекулярная биология. М.: Изд-во НИИ Биомедицинской химии РАМН, 2000. С.311–321 [Elliot V., Elliot D. Biokhimiya i molekulyarnaya biologiya. M.: Izd-vo NII Biomeditsinskoy khimii RAMN, 2000. S.311–321 (in Russian)].
11. Lozoff B., Jimenez E., Hagen J. et al. Poorer behavioral and developmental outcome more than 10 years after treatment for iron deficiency in infancy // Pediatrics. 2000. Vol. 105. Р. E51.
12. Lozoff B., Jimenez E., Smith J. B. Double burden of iron deficiency in infancy and low socioeconomic status: a longitudinal analysis of cognitive test scores to age 19 years // Arch. Pediatr. Adolesc. Med. 2006. Vol. 160 (11). P.1108–1113.
13. Grantham-McGregor S., Ani C. A review of studies on the effect of iron deficiency on cognitive development in children // J. Nutr. 2001. Vol. 131. Р.649–668.
14. Долгов В. В., Луговская С. А., Морозова В. Т., Почтарь М. Е. Лабораторная диагностика анемий. Тверь: Губернская медицина, 2001. [Dolgov V.V., Lugovskaya S. A., Morozova V. T., Pochtar’ M. Ye. Laboratornaya diagnostika anemiy. Tver’: Gubernskaya meditsina, 2001 (in Russian)].
15. Луговская С. А., Морозова В. Т., Почтарь М. Е., Долгов В. В. Лабораторная гематология. М.: Триада, 2006 [Lugovskaya S.A., Morozova V. T., Pochtar’ M. Ye., Dolgov V. V. Laboratornaya gematologiya. M.: Triada, 2006 (in Russian)].
16. Заплатников А. Л., Кузнецова О. А., Воробьева А. С. и др. Алгоритм верификации характера анемии на основе корректной трактовки показателей клинического анализа крови // РМЖ. 2017. № 12. С.908–912 [Zaplatnikov A.L., Kuznetsova O. A., Vorob’yeva A.S. i dr. Algoritm verifikatsii kharaktera anemii na osnove korrektnoy traktovki pokazateley klinicheskogo analiza krovi // RMZH. 2017. № 12. S.908–912 (in Russian)].
17. Руководство по гематологии (в 3 т.). / под ред. А. А. Воробьева. М.: Нью Диамед, 2002 [Rukovodstvo po gematologii (v 3 t.). / pod red. A. A. Vorob’yeva. M.: N’yu Diamed, 2002 (in Russian)].
18. Анемии у детей: диагностика, дифференциальная диагностика, лечение / под ред. А. Г. Румянцева и Ю. Н. Токарева. 2-е изд. доп. и перераб. М.: МАКС Пресс, 2004. 216 с. [Anemii u detey: diagnostika, differentsial’naya diagnostika, lecheniye / pod red. A. G. Rumyantseva i Yu.N. Tokareva. 2-ye izd. dop. i pererab. M.: MAKS Press, 2004. 216 s. (in Russian)].
19. Уиллоуби М. Детская гематология. Пер. с англ. М.: Медицина, 1981. 672 с. [Uilloubi M. Detskaya gematologiya. Per. s angl. M.: Meditsina, 1981. 672 s. (in Russian)]
20. Пашкина И. В., Шарухо Г. В., Туровинина Е. Ф. и др. О состоянии латентного дефицита железа у детей в Тюменской области // Медицинская наука и образование Урала. 2010. № 2. С.104–106 [Pashkina I.V., Sharukho G. V., Turovinina Ye.F. i dr. O sostoyanii latentnogo defitsita zheleza u detey v Tyumenskoy oblasti // Meditsinskaya nauka i obrazovaniye Urala. 2010. № 2. S. 104–106 (in Russian)].
21. Кузьмина О. В., Булиева Н. Б. Анализ железодефицитных состояний у детей в возрасте от 9 месяцев до 3 лет // Научный медицинский вестник Югры. 2012. № 1–2. С.182–184 [Kuz’mina O.V., Buliyeva N. B. Analiz zhelezodefitsitnykh sostoyanij u detey v vozraste ot 9 mesyatsev do 3 let // Nauchnyy meditsinskiy vestnik Yugry. 2012. № 1–2. S. 182–184 (in Russian)].
22. Архестова Д. Р. Распространенность железодефицитных состояний, факторы риска их развития у детей первого года жизни в Кабардино-Балкарской Республике: автореф. дис. … канд. мед. наук. Ставрополь, 2016. 22 с. [Arkhestova D. R. Rasprostranennost’ zhelezodefitsitnykh sostoyanij, faktory riska ikh razvitiya u detey pervogo goda zhizni v Kabardino-Balkarskoy Respublike: avtoref. dis. … kand. med. nauk. Stavropol’, 2016. 22 s. (in Russian)].
23. Мачнева Е. Б. Оптимизация диагностики и контроля эффективности терапии железодефицитных состояний у детей: автореф. дис. … канд. мед. наук. М., 2016. 25 с. [Machneva Ye.B. Optimizatsiya diagnostiki i kontrolya effektivnosti terapii zhelezodefitsitnykh sostoyaniy u detey: avtoref. dis. … kand. med. nauk. M., 2016. 25 s. (in Russian)].
24. Тарасова И. С., Красильникова М. В., Сметанина Н. С. и др. Трехэтапный скрининг в диагностике железодефицитных состояний — мера вторичной профилактики // Анемия. Журнал рабочей группы по анемии. 2006. № 1–2. С. 7–16 [Tarasova I.S., Krasil’nikova M.V., Smetanina N. S. i dr. Trekhetapnyy skrining v diagnostike zhelezodefitsitnykh sostoyanij — mera vtorichnoy profilaktiki // Anemiya. Zhurnal rabochey gruppy po anemii. 2006. № 1–2. S.7–16 (in Russian)].
25. Briggs С., Rogers R., Thompson В., Machin S. New Red Cell Parameters as Potential Markers of Functional Iron Deficiency // Infusion Therapy and Transfusion Medicine. 2001. Vol. 28 (5). Р.249–308.
26. Mei Z., Parvanta I., Cogswell M. E. et al. Erythrocyte protoporphyrin or hemoglobin: which is a better screening test for iron deficiency in children and women? // Am. J. Clin. Nutr. 2003. Vol. 77 (5). P.1229–1233.
27. Beguin Y. Soluble transferrin receptor for the evaluation of erythropoiesis and iron status // Clin. Chim. Acta. 2003. Vol. 329. P.9–22.
28. Тардиферон®. Инструкция по применению лекарственного препарата для медицинского применения // Государственный реестр лекарственных средств РФ [Tardiferon®. Instruktsiya po primeneniyu lekarstvennogo preparata dlya meditsinskogo primeneniya // Gosudarstvennyy reyestr lekarstvennykh sredstv RF (in Russian)]. [Электронный ресурс]. URL: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=4f0e9896–52f5–4eb9-acaa-04fbd6342374andt= (дата обращения: 30.06.2018).
29. Zaim M., Piselli L., Fioravanti P. et al. Efficacy and tolerability of a prolonged release ferrous sulphate formulation in iron deficiency anaemia: a noninferiority controlled trial // Eur J Nutr. 2012. Vol. 51. P.221–229.
30. Leary A., Barthe L., Clavel T. et al. Pharmacokinetics of ferrous sulphate (Тardyferon®) after single oral dose administration in women with iron deficiency anaemia // Drug Res. 2015. Vol. 66. Р.51–56.
31. Доброхотова Ю. Э., Маркова Э. А. Коррекция железодефицитной анемии у пациенток с акушерско-гинекологической патологией (фармакоэкономический сравнительный анализ) // РМЖ. 2018. Т.2 (1). С.29–33 [Dobrokhotova Yu.E., Markova E. A. Korrektsiya zhelezodefitsitnoy anemii u patsiyentok s akushersko-ginekologicheskoy patologiyey (farmakoekonomicheskiy sravnitel’nyy analiz) // RMZh. 2018. T.2 (1). S.29–33 (in Russian)].
32. Грибкова И. В., Холовня-Волоскова М.Э., Полякова К. И. и др. Фармакоэкономический анализ применения пероральных препаратов железа для лечения и профилактики железодефицитной анемии беременных // Акушерство и гинекология. 2018. Т.3. C.138–144 [Gribkova I.V., Kholovnya-Voloskova M.E., Polyakova K. I. i dr. Farmakoekonomicheskiy analiz primeneniya peroral’nykh preparatov zheleza dlya lecheniya i profilaktiki zhelezodefitsitnoy anemii beremennykh // Akusherstvo i ginekologiya. 2018. T.3. S.138–144 (in Russian)]. [Электронный ресурс]. URL: https://dx.doi.org/10.18565/aig.2018.3 (дата обращения: 01.07.2018).
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru





