Содержание статьи
Введение
Центральная серозная хориоретинопатия (ЦСХРП) — патология центральной зоны сетчатки, часто встречающаяся у лиц молодого трудоспособного возраста, преимущественно мужского пола. При длительном течении патологический процесс может стать причиной снижения зрительных функций [1–4]. ЦСХРП характеризуется идиопатической серозной отслойкой нейросенсорной сетчатки, которая может сопровождаться отслойкой ретинального пигментного эпителия (РПЭ). Известно, что важная роль в развитии ЦСХРП принадлежит локальным дефектам в клетках РПЭ с нарушением барьерной и насосной функций [5].
Одной из особенностей острой ЦСХРП является возможность спонтанного регресса без лечения [6]. По данным литературы, без лечения самопроизвольная полная резорб-ция субретинальной жидкости наблюдалась у 18,2% пациентов с ЦСХРП за 1 мес., у 27,3% за 3 мес. и у 63,6% за 1 год наблюдения [7] и у 14,2% за 1 мес., у 26% за 3 мес., у 41,5% за 6 мес. и у 53,2% за 11 мес. [8]. В обширном исследовании, проведенном на 295 глазах, спонтанная резорбция суб-ретинальной жидкости у пациентов с ЦСХРП произошла в 52% случаев [9].
В клинической практике для лечения ЦСХРП широко применяется микроимпульсный режим лазерного излучения [10–17]. При технологии селективной микроимпульсной индивидуальной ретинальной терапии (СМИРТ) применяется селективный микроимпульсный режим, определенный с помощью компьютерного моделирования, при котором происходит избирательное разрушение РПЭ [18, 19]. На основе количественной оценки денатурированного белка в тканях хориоретинального комплекса определены параметры и режимы лазерного излучения, которые реализуются на серийных лазерных установках [20–24]. По данным компьютерного моделирования установлено, что для избирательного воздействия на РПЭ и минимального повреждения нейросенсорной сетчатки и хориоидеи необходимо учитывать прозрачность оптических сред и концентрацию меланина в РПЭ [24], т. е. индивидуальные особенности пациентов. Поэтому актуальным вопросом лазерной хирургии патологии сетчатки в целом и, особенно, ЦСХРП является персонализация лечения. Учитывая различную степень пигментации глазного дна, прозрачность оптических сред, рефракцию каждого пациента, перед лечением необходимо проводить предварительное тестирование микроимпульсного режима с оценкой индивидуальной реакции ткани хориоретинального комплекса на лазерное воздействие [25, 26]. Ранее было установлено, что аутофлюоресценция является наиболее чувствительным и информативным неинвазивным методом диагностики для оценки термического повреждения РПЭ микроимпульсным воздействием [27, 28]. Предварительное тестирование позволяет определить минимальные параметры, приводящие к повреждению РПЭ и достаточные для достижения клинического результата [25, 26].
С разработкой инновационных лазерных установок, оснащенных системой навигации, появилась возможность прицельно воздействовать на патологический очаг за счет высокоточного нанесения импульса в необходимую точку, не затрагивая окружающие ткани, и проводить топографически ориентированное лечение [25, 26, 29, 30]. Прецизионность воздействия обеспечивается предварительным планированием операции после наложения результатов флюоресцентной ангиографии (ФАГ), оптической когерентной томографии (ОКТ) и их сопоставления с цветной фотографией глазного дна пациента. Применение топографически ориентированного и патогенетически обоснованного лечения позволяет наносить аппликаты прицельно, не затрагивая интактные структуры, что уменьшает риск дополнительного коллатерального повреждения тканей.
Таким образом, применение навигационных возможностей при СМИРТ, технологии, разработанной на основе применения селективных микроимпульсных режимов на серийных лазерных установках с учетом индивидуальных особенностей каждого пациента, выводит на новый уровень лечение ЦСХРП. Современные разработки и оборудование позволяют проводить персонализированное лечение с прицельной доставкой лазерного излучения, воздействующего исключительно на РПЭ, с наименьшим количеством аппликатов, необходимых для достижения клинического результата.
Цель исследования: оценить клинические результаты СМИРТ при навигационном лечении ЦСХРП с подбором параметров путем предварительного тестирования.
Материал и методы
В проспективное исследование был включен 61 пациент в возрасте от 36 до 58 лет с острой ЦСХРП. Все пациенты предъявляли жалобы на метаморфопсии, микропсии и появление пятна перед глазом. Длительность симптомов заболевания варьировала от 3 до 6 мес. По данным ОКТ, во всех случаях определялась отслойка нейросенсорной сетчатки в макуле со скоплением субретинальной жидкости под ней.
Критерии невключения в исследование: сопутствующая патология органа зрения, помутнение оптических сред, тяжелые соматические заболевания, хроническое течение ЦСХРП и ранее выполненное лазерное лечение, введение ингибиторов ангиогенеза и проведение фотодинамической терапии в анамнезе.
Случайным образом пациенты были разделены на 2 группы. Пациенты основной группы (31 глаз) были пролечены на навигационной лазерной системе Navilas 577s (OD-OS, Teltow, Германия) по технологии СМИРТ с предварительным тестированием. Использовали селективные микроимпульсные режимы, при которых происходит избирательное воздействие на РПЭ по данным компьютерного моделирования с учетом технических характеристик лазерной установки: диаметр пятна 100 мкм, длительность импульса 50–100 мкс, интервал между импульсами 2000 мкс, рабочий цикл 2,4–4,8%, длительность пакета 10 мс, количество импульсов в пакете 5, мощность 0,4–1,9 Вт, длина волны 577 нм [24]. Результаты тестирования оценивали по данным коротковолновой аутофлюоресценции (488 нм). Пациентам контрольной группы лазерное лечение не проводили.
Для определения точек фильтрации выполняли ФАГ. Центральную толщину сетчатки (ЦТС) оценивали с помощью ОКТ на аппарате Cirrus HD-OCT 5000 (ZEISS, Германия). Коротковолновую аутофлюоресценцию (488 нм) и ФАГ выполняли на ретиноангиографе Spectralis® HRA (Heidelberg Engineering, Германия). Светочувствительность (СЧ) центральной зоны определяли на приборе MAIA (Center Vue, США).
Параметры для лечения по технологии СМИРТ подбирали индивидуально путем предварительного тестирования. На этапе планирования выполняли исследование коротковолновой аутофлюоресценции глазного дна. Для этого расширяли зрачок более 6 мм путем закапывания глазных капель фенилэфрина 2,5% и тропикамида 1%. Перед тестированием на лазерной установке выполняли цветную фотографию глазного дна. Определяли зоны, на которых отсутствуют видимые патологические изменения, с учетом результатов аутофлюоресценции. Затем планировали протокол тестирования путем постановки трех лазерных аппликатов различной мощности и длительности микроимпульса на интактные участки глазного дна в области верхней или нижней сосудистых аркад. По указанному плану наносили тестовые аппликаты в группе по три, затем через 1–2 ч исследовали аутофлюоресценцию. Для получения контрастных снимков фоторегистрацию проводили многократно, с разными точками фокусировки и углами поворота камеры. На изображениях оценивали выраженность участков лазерного воздействия. Для лечения выбирали минимальные энергетические параметры, соответствующие аппликатам с видимым повреждением РПЭ на снимках аутофлюоресценции, выполненной после тестирования (рис. 1).
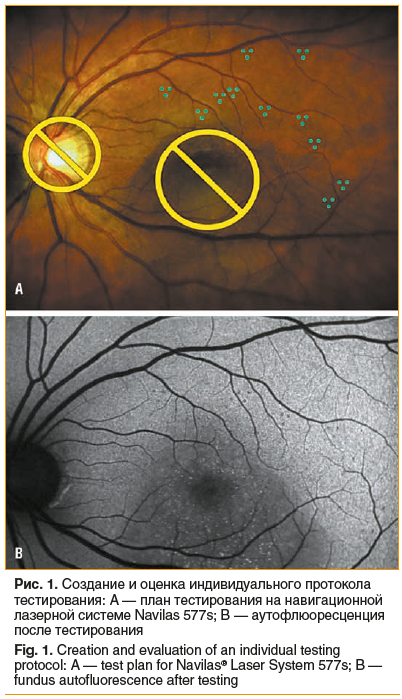
Результаты ФАГ импортировали в лазерную установку Navilas 577s и выполняли цветную фоторегистрацию глазного дна. Используя программное обеспечение, накладывали и сопоставляли цифровые изображения ФАГ с цветной фотографией глазного дна (рис. 2A). С учетом полученных данных определяли локализацию точек фильтрации относительно сосудистой сети на цветной фотографии глазного дна и составляли план лечения (рис. 2B). Для этого выбирали паттерн из одного или нескольких аппликатов, вплотную друг к другу (без интервала между ними), и располагали их таким образом, чтобы полностью покрыть точки фильтрации. Дополнительно устанавливали две зоны безопасности на участки глазного дна, на которые не должно попадать лазерное излучение. Одна зона безопасности — на диск зрительного нерва, другая — в области фовеальной аваскулярной зоны. Если лазерное лечение проводилось в фовеальной аваскулярной области, то зону безопасности устанавливали рядом в произвольном месте. Затем параметры устанавливали в паттерны на лазерной установке, включали режим активации лазера с системой автотрекинга и нажатием на педаль наносили лазерные аппликаты согласно заданному плану. На протоколе лечения видна область нанесения аппликатов и выбранные параметры (рис. 2C).

В контрольные сроки наблюдения через 1, 3, 6 и 12 мес. всем пациентам проводили исследование максимально корригированной остроты зрения (МКОЗ), ОКТ и компьютерную микропериметрию.
Статистическую обработку полученных результатов осуществляли с использованием программы Microsoft Excel. Результаты описательной статистики представлены в виде M±σx, где M — среднее значение, σx — стандартная ошибка среднего. Для оценки статистической значимости различий между средними основной и контрольной групп применяли t-тест Стьюдента.
Результаты исследования
Исходная характеристика пациентов основной и контрольной групп представлена в таблице.

Тестирование и лечение с помощью навигационной лазерной системы Navilas 577s не требовало постановки роговичной контактной линзы, не сопровождалось дискомфортом для пациента. Лазерные аппликаты наносили вплотную друг к другу, полностью покрывая точку фильтрации по данным ФАГ. Во всех случаях в области нанесения лазерных аппликатов при осмотре глазного дна видимые изменения отсутствовали.
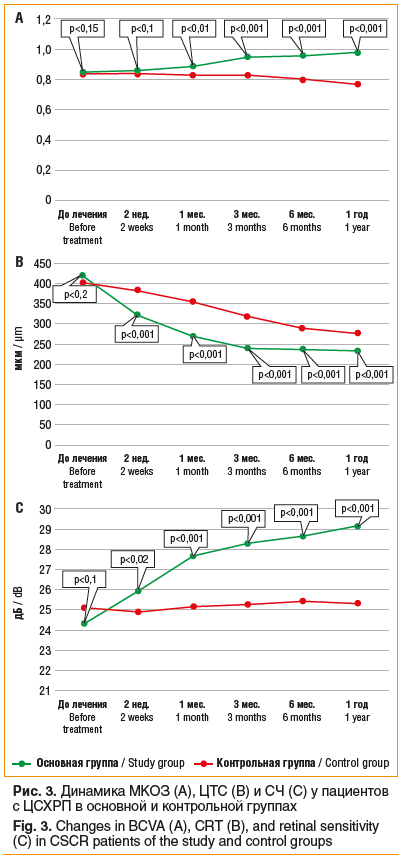
Полная резорбция субретинальной жидкости была достигнута через 2 нед. после лазерного лечения на 6 (19,3%) глазах, через 1 мес. на 19 (61,2%) глазах, через 3 мес. во всех случаях. Через 1 мес. после лечения у всех пациентов была отмечена положительная динамика. Острота зрения увеличилась в среднем до 0,89±0,02. По данным ОКТ, ЦТС уменьшилась и составила в среднем 271,1±10,05 мкм. СЧ по данным микропериметрии повысилась в среднем до 27,67±0,17 дБ. Через 3 мес. средние значения МКОЗ повысились до 0,95±0,02 (р<2,8×10-5). По данным ОКТ, ЦТС составила 241,9±4,27 мкм. СЧ повысилась в среднем до 28,29±0,28 дБ (р<5,4×10-7). Через 6 мес. средние значения МКОЗ повысились до 0,96±0,02. ЦТС составила 238,55±4,36 мкм. СЧ повысилась в среднем до 28,66±0,21 дБ. Через 1 год средние значения МКОЗ повысились до 0,98±0,02 (р<10-8 по сравнению с контрольной группой). По данным ОКТ, ЦТС составила 233,8±3,35 мкм. СЧ повысилась в среднем до 29,15±0,17 дБ (р<6,3×10-6 по сравнению с контрольной группой). В различные сроки наблюдения снижения СЧ в области лазерного лечения не наблюдалось. Участки лазерного воздействия в зоне лечения и тестирования не визуализировались как при биомикроскопии, так и на цифровых изображениях в отраженном инфракрасном свете, снимках аутофлюоресценции и флюоресцентных ангиограммах.
В контрольной группе у пациентов без лечения полная резорбция субретинальной жидкости отмечалась на 2 (6,7%) глазах через 1 мес., на 5 (16,6%) глазах через 3 мес., на 7 (23,3%) глазах через 6 мес., а через 1 год на 10 (33,3%) глазах. Прилегание нейросенсорной сетчатки с 6 мес. до 1 года наблюдалось на 5 глазах, однако на 2 глазах отмечен рецидив заболевания. Уменьшение средней ЦТС было отмечено на всех сроках наблюдения. Через 1 год наблюдения отмечено снижение средней МКОЗ с 0,84±0,02 до 0,77±0,03. Среднее значение СЧ незначительно повысилось. У пациентов, у которых произошла самопроизвольная резорбция субретинальной жидкости, отмечено повышение остроты зрения и СЧ. На глазах с длительным сохранением отслойки нейросенсорной сетчатки происходило снижение остроты зрения и СЧ. Динамика МКОЗ, ЦТС и СЧ у пациентов с ЦСХРП в основной и контрольной группах представлена на рисунке 3.
Обсуждение
Центральная серозная хориоретинопатия встречается, как правило, у пациентов молодого трудоспособного возраста, поэтому важно применять максимально бережные тканесохраняющие методики лечения. По данным литературы [7, 8], частота самопроизвольной резорбции субретинальной жидкости в первые 3 мес. составляет около 30%, в связи с чем широко применяется выжидательная тактика [6]. Однако, как свидетельствуют результаты исследований [31, 32], при наличии субретинальной жидкости происходит необратимое повреждение фоторецепторов с атрофией их наружных сегментов и снижением зрения [33], а также истончение наружного ядерного слоя, коррелирующее со сроком заболевания [32]. В этой связи ряд авторов рекомендует переход к активной лечебной тактике при длительности отслойки нейросенсорной сетчатки более 3 мес. [34].
В нашем исследовании в контрольной группе с длительностью симптомов от 3 до 6 мес. полную резорбцию субретинальной жидкости в течение 1 года наблюдения констатировали у 33,3% пациентов. У пациентов с прилеганием нейроэпителия происходило повышение МКОЗ и СЧ. На глазах с длительной персистенцией субретинальной жидкости отмечалось постепенное снижение зрительных функций (см. рис. 3), что согласуется с данными литературы [33].
Исходя из патогенеза заболевания, основной точкой приложения лазерного излучения является РПЭ [4, 5, 16]. В зоне лазерного воздействия клетки РПЭ пролиферируют, мигрируют и полностью закрывают дефект [35]. В результате восстанавливается их наносная и барьерная функция, что обеспечивает резорбцию субретинальной жидкости и прилегание нейроэпителия. Термическое повреждение соседних структур (нейросенсорной сетчатки и хориоидеи) в данном случае нецелесообразно и является негативным последствием лечения.
Прицельно воздействовать на РПЭ с минимизацией повреждающего воздействия на прилежащие структуры ХРК позволяет использование селективных микроимпульсных режимов, которые применяются при технологии СМИРТ [24]. Для прицельного воздействия на РПЭ, несомненно, необходимо учитывать индивидуальные особенности каждого пациента. По данным литературы, коэффициент абсорбции лазерного излучения отличается практически в 3 раза в зависимости от этнической принадлежности и внешних признаков [36]. Также с возрастом уменьшается концентрация меланина [37]. Известно, что вследствие изменений оптических свойств хрусталика пропускание света линейно снижается с возрастом [38]. Концентрация меланина и прозрачность оптических сред являются основными (наиболее значимыми) факторами, определяющими прохождение и поглощение лазерного излучения [18, 19]. Следовательно, применяя одни и те же параметры микроимпульсного режима для лечения разных пациентов, следует ожидать различный уровень повреждения РПЭ и прилежащих структур. Поэтому применение технологии СМИРТ для конкретного пациента происходит с учетом его индивидуальных особенностей. Для этого выполняется тестирование микроимпульсного режима, и с помощью высокочувствительных методов диагностики оценивается индивидуальная реакция тканей на воздействие [25–28].
Центральная (фовеальная) аваскулярная область сетчатки отличается меньшим количеством слоев, большим скоплением колбочек, отвечает за максимальные зрительные функции, является самой функционально значимой и, следовательно, требует наиболее деликатного отношения. При работе в фовеальной аваскулярной зоне особенно важно использовать селективные режимы, с минимальной длительностью импульса, рабочим циклом и количеством импульсов при высокой мощности, которые применяются при СМИРТ [24]. Максимально избирательное и эффективное воздействие достигается индивидуальным подбором минимальных энергетических параметров, достаточных для достижения клинического результата [25, 26].
Применение СМИРТ на навигационной лазерной системе Navilas 577s имеет целый ряд преимуществ в сравнении с мануальным подходом. Во-первых, лечение осуществляется прицельно, по четко заданному топографическому плану, основанному на использовании данных мультимодальной визуализации. Во-вторых, встроенная система высокоскоростного eye-трекинга полностью исключает случайное попадание лазерного луча на соседние интактные участки [25, 26, 29, 30]. При работе на стандартной лазерной установке и осмотре глазного дна часто практически невозможно визуализировать дефект РПЭ, соответствующий точке фильтрации. Поэтому сложно определить место воздействия в ходе лазерной операции, приходится пользоваться дополнительными анатомическими ориентирами и определять локализацию точки фильтрации приблизительно относительно сосудистой сети, сопоставляя визуально с распечаткой флюоресцентной ангиограммы пациента. При работе на стандартных лазерных системах невозможно выполнить лечение прицельно, не затронув области сетчатки, непосредственно прилежащие к точке просачивания, поэтому требуется нанесение большего количества лазерных аппликатов. Другая сложность, связанная с работой в микроимпульсном режиме, заключается в том, что, поскольку следы лазерного воздействия на сетчатке не видны, нельзя исключить возможность повторного попадания импульса на один и тот же участок. Мануальный режим не позволяет выполнить полный объем лечения по площади ввиду отсутствия визуализации уже нанесенных аппликатов, соответственно, могут остаться «необработанные» участки, что может снижать клинический эффект. Использование навигационной технологии позволяет полностью решить вышеуказанные проблемы за счет прицельного нанесения лазерных аппликатов точно в указанное место, в соответствии с предварительным планом, обеспечивая четкую топографическую ориентированность воздействия.
Персонализированный подход к лазерному лечению ЦСХРП, основанный на технологии СМИРТ с индивидуальным подбором параметров селективного микроимпульсного режима, позволяет избирательно воздействовать на РПЭ с наименьшими энергетическими параметрами и приводит к быстрой резорбции субретинальной жидкости, повышению остроты зрения и СЧ.
Заключение
Как показали результаты проведенного нами исследования, у пациентов с ЦСХРП без лечения с сохранением субретинальной жидкости отмечалось постепенное снижение МКОЗ и СЧ. Установлено, что СМИРТ с подбором параметров путем предварительного тестирования приводит к резорбции субретинальной жидкости и повышению зрительных функций без повреждения сетчатки. Разработанный метод является эффективным и безопасным, позволяет проводить навигационное лазерное лечение ЦСХРП с использованием минимальных энергетических параметров, достаточных для достижения клинического эффекта, и может применяться в фовеа.
Сведения об авторах:
Володин Павел Львович — д.м.н., заведующий отделом лазерной хирургии сетчатки ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0003-1460-9960.
Иванова Елена Владимировна — к.м.н., врач-офтальмолог отделения лазерной хирургии сетчатки ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0001-9044-340.
Контактная информация: Володин Павел Львович, e-mail: volodinpl@mntk.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 30.05.2023.
Поступила после рецензирования 23.06.2023.
Принята в печать 18.07.2023.
About the authors:
Pavel L. Volodin — Dr. Sc. (Med.), Head of the Department of Laser Retinal Surgery, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskiy blvd, Moscow, 127486, Russian Federation; ORCID iD 0000-0003-1460-9960.
Elena V. Ivanova — Cand. Sc. (Med.), ophthalmologist of the Department of Laser Retinal Surgery, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskiy blvd, Moscow, 127486, Russian Federation; ORCID iD 0000-0001-9044-340.
Contact information: Pavel L. Volodin, e-mail: volodinpl@mntk.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 30.05.2023.
Revised 23.06.2023.
Accepted 18.07.2023.
материал rmj.ru
