Введение
Несмотря на существующие эффективные методы диагностики и лечения острых проявлений ишемической болезни сердца (ИБС), а также активное внедрение профилактических стратегий, перенесенный инфаркт миокарда (ИМ) продолжает ассоциироваться с высоким риском развития повторных острых сердечно-сосудистых событий, таких как повторный ИМ, ишемическй инсульт или внезапная сердечно-сосудистая смерть [1]. Причинами для сохранения остаточного сердечно-сосудистого риска (ССР) после ИМ, иначе называемого резидуальным, выступает недостаточный контроль над факторами риска и коморбидными состояниями, что в итоге приводит к прогрессирующему течению атеросклероза, ухудшая долгосрочный прогноз и качество жизни пациентов [2].
Несмотря на понимание механизмов управления различными звеньями резидуального ССР, в реальной практике даже у пациентов с должным поддержанием приверженности улучшающему прогноз лечению (липидснижающей, антигипертензивной, антитромботической и коронароактивной терапии) после госпитализации регистрируется недостижение целевых показателей холестерина липопротеинов низкой плотности (Хс-ЛПНП), артериального давления (АД), частоты сердечных сокращений (ЧСС) в покое [3]. В качестве основных причин этого в научно-медицинских публикациях рассматриваются клинические, социально-экономические и поведенческие различия самих пациентов, а также неоптимальность проводимого амбулаторного наблюдения после ИМ, в частности несоблюдение врачами постулатов клинических рекомендаций, наблюдение у непрофильного специалиста, инертность в отношении оптимизации постинфарктного ведения, отсутствие доверия к обучению пациентов как эффективной опции вторичной профилактики [4–8]. Настоящее же исследование стало попыткой ответить на вопрос, какие именно факторы характеризуют пациентов с резидуальным ССР в течение 1 года после ИМ при приверженности регулярному наблюдению у кардиолога, дополнительном обучении комплексной коррекции факторов CCР и достаточной приверженности пациентов приему лекарственных препаратов.
Цель исследования: изучить различия исходных клинико-анамнестических, поведенческих и социально-экономических характеристик пациентов, а также клинических эффектов оригинальной программы оптимизированной вторичной профилактики ИМ в зависимости от реализации однолетнего резидуального ССР.
Содержание статьи
Материал и методы
Исследование по характеру одноцентровое, проспективное. Протокол рассмотрен на соответствие стандартам надлежащей клинической практики, а также принципам Хельсинкской декларации и одобрен 26 марта 2021 г. локальным этическим комитетом центра (№ 03/1).
Пациенты с ИМ были отобраны из числа госпитализированных в стационар ГБУЗ «Кузбасский клинический кардиологический диспансер имени академика Л.С. Барбараша» в 2021 г.
Критерии включения:
-
ИМ 1 типа без летального исхода в стационаре;
-
возраст 35–70 лет;
-
проживание на территории г. Кемерово или Кемеровского муниципального округа (сельское поселение не менее 50 км от города численностью не ниже 5000 человек, без планов на переезд из домохозяйства в течение ближайших 5 лет);
-
«ожидаемая» продолжительность жизни пациента превышает 1 год за счет отсутствия тяжелой сопутствующей патологии (онкологических, ревматических, эндокринных заболеваний (исключая сахарный диабет), тяжелых заболеваний органов пищеварения и болезней крови, тяжелой хронической обструктивной болезни легких, тяжелой сердечной недостаточности IV функционального класса, декомпенсированной патологии клапанного аппарата и сосудов, хронического алкоголизма и наркомании, синдрома длительной неподвижности);
-
подписание информированного добровольного согласия установленной формы;
-
техническая возможность (наличие телефонной коммуникации и/или постоянный доступ к Telegram-каналу) и желание обучиться комплексной коррекции CCР после ИМ.
В исследование вошло 75 пациентов с ИМ. В качестве переменных на этапе включения оценивались клинические данные об анамнезе, течении ИМ и особенностях ведения по первичной медицинской документации (история болезни, выписной эпикриз, электронные протоколы медицинской информационной системы). Кроме того, был проведен анкетный опрос для оценки социально-экономических показателей (место проживания, семейное положение, уровень образования, наличие работы, уровень доходов за месяц) и выявления поведенческих факторов риска (употребление алкоголя и курения, стрессы за предшествующий месяц, низкий уровень недельной физической активности, годовой стереотип питания).
Все включенные пациенты в течение 1 года обязательно наблюдались у кардиолога после ИМ и имели достаточную приверженность (не менее 75% по действующим рекомендациям) [9] компонентам прогнозоулучающей терапии, а также к обучению в рамках оригинальной программы по комплексной коррекции CCР, включающей таргетное информирование по вторичной профилактике с помощью ежемесячных персонифицированных телефонных обзвонов кардиолога и рассылки материалов через cозданный кардиологом информационно-профилактический канал «Время сердцу» 2–3 раза в неделю.
На протяжении 1 года после ИМ на визите у кардиолога у пациентов оценивались клинические эффекты: развитие конечных точек (смерти и экстренные сердечно-сосудистые госпитализации), достижение целевых показателей (Хс-ЛПНП менее 1,4 ммоль/л, АД менее 130/80 мм рт. ст., ЧСС в покое 55–60 в 1 мин), модификация поведенческих факторов риска (при их наличии) и изменение питания. У умерших пациентов анализ проводился по данным последнего визита к кардиологу по амбулаторной карте и/или электронному протоколу медицинской информационной системы.
Статистическая обработка результатов проводилась с помощью программы Statistica 10.0 (США). Качественные переменные представлены в виде абсолютных значений (n) с выражением частоты встречаемости признака (%). Количественные данные проверены на нормальность распределения по критерию Шапиро — Уилка. При отличном от нормального распределении количественные показатели отражены в виде медианы (Me), 1-го и 3-го квартилей [Q1; Q3], при нормальном — в виде средних (M) и стандартного отклонения (SD). Качественные признаки сравнивались с помощью построения таблиц сопряженности с применением критерия χ2 Пирсона, для сравнения двух независимых групп по количественному признаку использовался U-критерий Манна — Уитни. Различия показателей считались значимыми при р<0,05.
Результаты исследования
Через 1 год после ИМ у 5 (6,7%) пациентов реализовался резидуальный CCР в виде 4 (5,3%) экстренных госпитализаций по причине нестабильной стенокардии, в одном случае закончившейся фатальной аритмией и в 2 (2,7%) случаях — смертью (1 — сердечно-сосудистая в стационаре при госпитализации и 1 — от злокачественного новообразования).
При сопоставлении групп с реализованным резидуальным ССР и без не выявлено значимых различий по предшествующему анамнезу, однако обращает на себя внимание превалирование у пациентов с неблагоприятным исходом так называемого белково-углеводного стереотипа питания в течение 1 года до ИМ, включавшего преимущественное употребление недиетической молочной продукции и мяса, сложных углеводов, выпечки и сладостей (табл. 1).
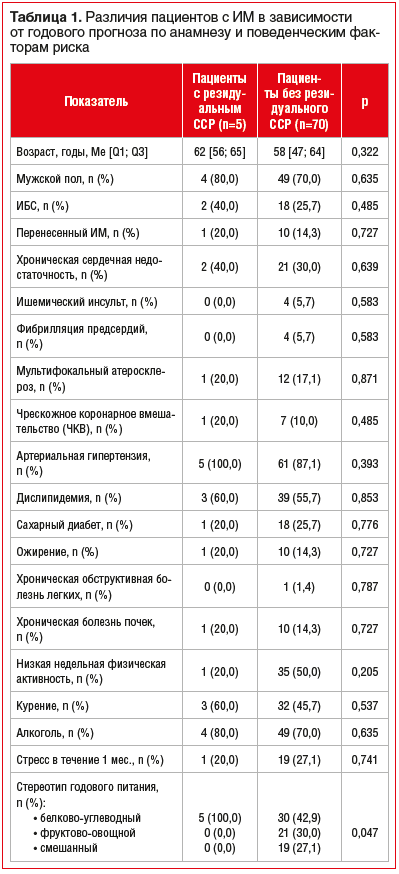
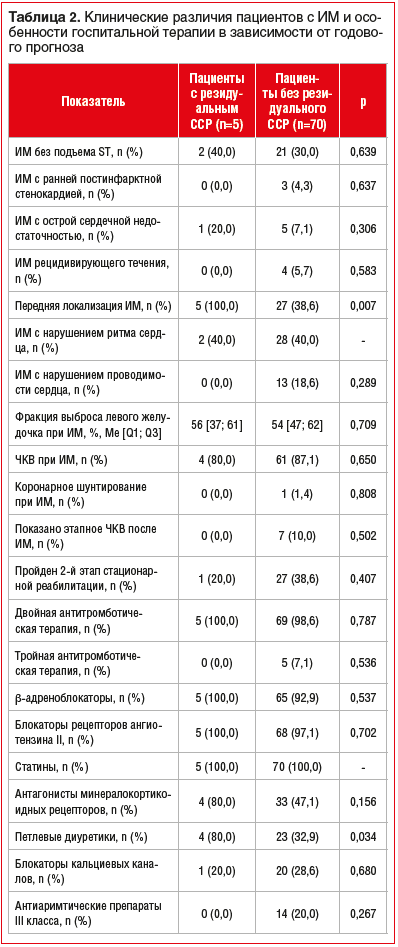
Различий по типу ИМ, частоте его осложнений, особенностям реваскуляризации получено не было. Однако пациенты с реализовавшимся резидуальным ССР в течение 1 года, в отличие от лиц без него, при индексном событии в 2,6 раза чаще имели переднюю локализацию ИМ, а также в 2,4 раза чаще получали в стационаре терапию петлевыми диуретиками, что, вероятно, свидетельствовало о большей склонности данной группы к застойным явлениям на фоне острой коронарной катастрофы (табл. 2).
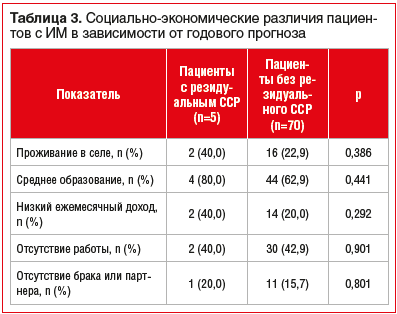
Социально-экономический портрет пациентов с развившимися на протяжении 1 года после ИМ неблагоприятными исходами и без них не различался (табл. 3).
Необходимо обратить внимание, что пациенты с ИМ как с реализовавшимся CCР, так и без него, несмотря на достаточную приверженность приему лекарственных препаратов и регулярное наблюдение у кардиолога, имели крайне низкую частоту достижения целевого Хс-ЛПНП, ЧСС в покое (табл. 4). Целевое АД в 2,2 раза чаще было достигнуто пациентами с ИМ, имевшими благоприятный годовой исход ССР, в отличие от лиц с неблагоприятным исходом.

Различия пациентов с ИМ в зависимости от остаточного ССР также заключались в лучшей приверженности больных с благоприятным годовым исходом минимизации ежемесячного стресса, кроме того, у данных пациентов прослеживалась тенденция и к увеличению общей недельной физической активности (см. табл. 4). Выявлено, что модификация ряда компонентов питания также чаще отмечалась в группе с отсутствием резидуального ССР (в частности, употребление в пищу преимущественно диетической молочной продукции и диетического мяса, рыбы, увеличение потребления фруктов и ягод, отказ от жареного и фастфуда, ограничение углеводов) в отличие от группы с его наличием (см. табл. 4).
Обсуждение
Настоящее исследование продемонстрировало, что пациенты с ИМ, у которых резидуальный ССР реализуется в виде развития неблагоприятных исходов в течение 1 года даже при регулярном наблюдении, достаточном уровне приверженности лечению и обучению вторичной профилактике, характеризуются недостаточными поведенческими изменениями, что в итоге сопровождается низкой частотой достижения целевых показателей Хс-ЛПНП, АД, ЧСС в покое. Данный факт подтверждается и зарегистрирован в Российском регистре острого ИМ [10].
Известно, что резидуальный ССР при ИБС обусловлен тремя основными компонентами — липидным, воспалительным и тромботическим [11]. Первый связан с отсутствием должного контроля дислипидемии (Хс-ЛПНП, триглицеридов, холестерина липопротеинов высокой плотности) у большей части пациентов, несмотря на улучшение приверженности назначению и использованию комбинированной липидснижающей терапии [10, 12–14]. Второй обусловлен увеличением продукции провоспалительных цитокинов на фоне хронического воспаления, что усугубляет дисфункцию эндотелия и окислительный стресс, приводя к прогрессированию атеросклероза. В частности, потенцирующими воспалительный ответ заболеваниями являются сахарный диабет 2 типа, ожирение, ревматологические патологии, хронические воспалительные заболевания кишечника, что отражается в повышении высокочувствительного С-реактивного белка [15, 16]. Тромботический компонент контролируется с помощью продления комплексного антитромботического лечения у пациентов с наиболее высоким ишемическим риском при отсутствии противопоказаний и/или повышенного геморрагического риска [17].
Необходимо подчеркнуть, что ведение всех пациентов в настоящем исследовании после ИМ осуществлялось согласно постулатам действующих клинических рекомендаций [18, 19], равноценное получение препаратов было достигнуто за счет действующей в России системы льготного лекарственного обеспечения. Согласно полученным данным становится очевидным, что в постинфарктном периоде требуется не только оптимизация в области медикаментозного сопровождения, сдерживающего три основных компонента резидуального ССР, но и работа с поведенческими факторами риска (коррекция зависимостей и психологического статуса, диетическое консультирование, обучение физической реабилитации). Так, например, показано, что целесообразна модификация рациона питания (увеличение потребления ягод, фруктов, овощей, рыбы, цельнозерновых продуктов и бобовых, кисломолочной продукции, наряду с ограничением животного жира, сахаров, жареной продукции и фастфуда), что совокупно способствует улучшению коррекции дислипидемии, подавлению воспаления и агрегации тромбоцитов, нормализации функции эндотелия. Однако среди пациентов с резидуальным ССР, даже получивших знания о важности следования диете и ее основным принципам, лишь малые доли больных были привержены необходимым изменениям [20]. Доказанными эффектами в отношении сдерживания резидуального ССР также обладают физическая реабилитация и стресс-менеджмент, отказ от вредных привычек [21, 22]. Между тем в полученных нами результатах фактическая приверженность их коррекции остается неоптимальной даже на фоне информирования о потребности в модификации данных факторов и ее способах.
Настоящее исследование показало необходимость активного наблюдения за пациентами с ИМ, имеющими резидуальный ССР. Применение, наряду с обучением вторичной профилактике, систем дистанционного телемедицинского мониторинга состояния пациентов с помощью портативных устройств и системы обратной связи может стать одним из успешных примеров дополнения к стандартному наблюдению [23]. Перспективой продолжения текущей работы может стать изучение ключевых барьеров между эффективной вторичной профилактикой ИМ, пациентом и врачом. В качестве ограничений исследования следует отметить малую выборку пациентов с ИМ и субъективизм ответов пациентов при анкетировании.
Заключение
Таким образом, показано, что среди пациентов с перенесенным ИМ в течение 1 года регулярного наблюдения у кардиолога и обучения в рамках вторичной профилактики даже при постоянном приеме прогнозоулучшающей терапии имеет место реализация ССР в виде случаев смерти и экстренной госпитализации по причине нестабильной стенокардии. Отличительными характеристиками пациентов, имеющих резидуальный ССР в виде развития годовых неблагоприятных исходов, выступили: белково-углеводный стереотип питания в течение 1 года до ИМ, передняя локализация ИМ, терапия петлевыми диуретиками в стационаре, меньшая доля достижения целевого АД спустя 1 год после индексного события, недостаточные минимизация ежемесячного стресса и тенденция к увеличению общей недельной физической активности, а также меньшая склонность к модификации компонентов питания (употреблению диетической молочной продукции и мяса, увеличению недельного употребления рыбы, фруктов и ягод, суточному ограничению углеводов, отказу от жареного и фастфуда).
Источник финансирования: работа выполнена в рамках темы ФНИ № 0419-2022-0002.
Информация с rmj.ru



