Введение
Монохориальная многоплодная беременность составляет примерно 20% всех многоплодных беременностей [1]. Одной из наиболее редких и тяжелых форм монохориальной беременности (менее 1% от всех случаев) является синдром обратной артериальной перфузии (СОАП) близнецов [2]. В основе патогенеза этого состояния лежит обратный ток крови по сосудам одного из плодов, плода-акардиуса (акардиус, fetus amorphous acardius): оксигенированная кровь поступает к плоду-реципиенту не по вене пуповины, а через артерию пуповины, а деоксигенированная кровь поступает в плаценту по вене пуповины [3]. Плод-акардиус — порок развития плода, у которого отсутствует сердце и ряд других внутренних органов, представляющий собой бесформенное образование, не имеющее сходства с обычным плодом [4]. O. Spiegelberg в своем учебнике «Акушерство для врачей и учащихся» 1879 г. описывал плод-акардиус как «бессердечного урода» [5].
Акардиальные плоды классифицируются на основании их морфологических особенностей и параметров, наблюдаемых при ультразвуковом исследовании (УЗИ). Существует несколько типов классификаций [6]:
Морфологическая классификация:
Acardius acephalus (65% случаев) — наиболее распространенная форма. Характеризуется хорошо развитыми тазом и нижними конечностями, отсутствием головы, верхних конечностей и органов грудной клетки.
Acardius anceps (около 20% случаев) — наиболее морфологически развитая форма, с рудиментарно сформированной головой и лицом, а также частично развитым телом и конечностями.
Acardius acormus (около 10% случаев) — крайне редкая форма, где присутствует только голова (часто соединенная с плацентой через пуповину) без полноценного тела.
Acardius amorphus (примерно 5% случаев) — полностью аморфный плод, без каких-либо узнаваемых структур, часто представляющий собой бесформенную массу тканей [7].
Классификация по размеру плода-акардиуса и состоянию плода-помпы:
Тип I: мелкие или средние акардиальные плоды с соотношением окружности живота (ОЖ) <50% от ОЖ плода-помпы. В зависимости от состояния плода-помпы различают:
Тип Ia: без признаков сердечной недостаточности (СН) плода-помпы.
Тип Ib: с признаками СН плода-помпы.
Тип II: крупные акардиальные плоды (ОЖ≥50%), которые могут сопровождаться отеками или водянкой.
Тип IIa: без СН плода-помпы.
Тип IIb: с признаками СН плода-помпы (тахикардией, гипертрофией миокарда) [8, 9].
Содержание статьи
Патогенез
Ведущая гипотеза развития плода-акардиуса, согласно K. Benirschke, — гемодинамическая, которая включает в себя две основные гипотезы формирования СОАП близнецов [10, 11]. Первая гипотеза предполагает формирование аномальных сосудистых анастомозов между артериальными сосудами в плаценте, что приводит к несбалансированному кровотоку между плодами [7]. Плод-помпа развивается нормально и получает оксигенированную кровь, в то время как плод-акардиус получает обедненную кислородом кровь по артерио-артериальным анастомозам между пупочными артериями плодов. Из-за увеличенного объема крови, приходящей по пупочным артериям, у плода-акардиуса возникает ретроградный ток крови в направлении от подвздошных артерий к сердцу, который приводит к увеличенному давлению в нижней половине тела плода и сниженному давлению в его верхней половине. У такого плода происходит замедление развития верхнего пояса конечностей и сердца, но при этом нижние конечности могут развиваться нормально [12, 13]. Вторая гипотеза строится на том, что первостепенно возникает порок сердца одного из плодов, что приводит к снижению артериального давления у плода-акардиуса по сравнению с плодом-помпой, в связи с чем его перфузия нарушается [7]. Основное отличие этих двух гипотез в том, что согласно первой у плода сформирован ретроградный ток крови, при этом изначально сердце сформировано нормально, но в процессе дальнейшего эмбриогенеза, в силу нехватки кислорода, кардиомиоциты атрофируются, в то время как по второй гипотезе изначально сердце сформировано с пороком, что приводит к снижению его насосной функции, падает системное артериальное давление и формируется ретроградный ток крови, вследствие чего плод-акардиус становится полностью зависимым от кровотока плода-помпы [13].
Недостаток кислорода на ключевых этапах органогенеза (3–8-я неделя беременности) вызывает: аплазию или грубую гипоплазию сердца, аплазию головного мозга (анэнцефалия) или тяжелую гипоплазию центральной нервной системы (ЦНС), нарушения формирования конечностей, в основном верхних, отсутствие или гипоплазию внутренних органов, таких как почки, печень, кишечник. В свою очередь сердце плода-донора работает с повышенной нагрузкой, перекачивая кровь в тело плода-акардиуса через анастомозы. Это может привести к гипертрофии миокарда с развитием СН, водянке плода, задержке роста плода, внутриутробной гибели плода или преждевременным родам [3, 14–17]. Плод-акардиус — редко встречающаяся патология в акушерской практике, поэтому описание подобных клинических наблюдений поможет усовершенствовать методы ее диагностики и лечения, а также улучшить перинатальные исходы.
Клиническое наблюдение 1
Пациентка С., 36 лет, поступила по направлению женской консультации в ГБУЗ «ГКБ № 67 им. Л.А. Ворохобова ДЗМ» с диагнозом «монохориальная моноамниотическая двойня» (МХМА-двойня) в сроке беременности 19 нед. 5 дней, гестационный сахарный диабет на диетотерапии, рубец на матке после операции кесарева сечения 2 года назад вследствие отслойки нормально расположенной плаценты. Беременность наступила спонтанно. Со слов беременной, скрининг I триместра прошла своевременно, но протокол предоставить не смогла. В ходе второго скрининга выявлены пороки развития второго плода (акрания, омфалоцеле и двусторонняя косолапость), отсутствие сердечной пульсации второго плода, СОАП, акардиальный синдром второго плода, множественные сосудистые анастомозы, предполагаемая масса 1-го плода — 330 г (64,5 процентиля), предполагаемую массу 2-го плода определить невозможно. По результатам городского консилиума прогноз для здоровья первого плода с прогрессированием беременности расценен как неблагоприятный, было принято решение о проведении эндоскопической лазерной коагуляции сосудов пуповины плода-акардиуса. Хирургическое вмешательство выполнялось под местной анестезией лидокаином, в асептических условиях на сроке беременности 19 нед. Под УЗ-контролем проведена пункция амниотической полости, через пункционную иглу зонд лазерного коагулятора подведен к пупочному кольцу акардиального плода, проведена коагуляция сосудов пуповины. Энергия (60–100 Вт) подавалась до прекращения кровотока у плода в течение 1 мин. По окончании процедуры начата антибиотикопрофилактика препаратом цефалоспоринового ряда в течение 3 дней, токолитическая терапия нифедипином. Учитывая удовлетворительное состояние пациентки и живого плода после лазерной коагуляции сосудов пуповины второго плода, спустя 3 дня беременная выписана домой под наблюдение врача женской консультации. Рекомендована контрольная УЗ-фетометрия, УЗ-допплерометрия маточно-плацентарного кровотока через 2 нед. с момента выписки.
Через 1 мес. пациентка по направлению жен-ской консультации повторно госпитализирована с диагнозом «МХМА-двойня» в сроке беременности 24 нед. 4 дня, СОАП, состояние после лазерной коагуляции сосудов пуповины второго плода, рецидив кровотока в плоде-акардиусе по данным УЗИ, гестационный сахарный диабет на диетотерапии. По данным УЗ-допплерометрии в приемном отделении: 1-й плод: пульсационный индекс в артерии пуповины (PI arteria umblicalis) — 0,95(N)/0,99(N), пиковая систолическая скорость кровотока в средней мозговой артерии (MCA PSV) — 36 cм/c, пульсационный индекс в венозном протоке (PI ductus venosus) — 0,65(N). Фетометрия: предполагаемая масса плода (ПМП) — 660 г, без признаков СН; 2-й плод (рис. 1): PI arteria umblicalis — 1,75. Заключение: нарушений кровотоков первого плода не выявлено. Возобновление кровотока в артерии пуповины плода-акардиуса. Проведена профилактика респираторного дистресс-синдрома плода дексаметазоном в курсовой дозе 24 мг. На 3-и сутки госпитализации у беременной отмечена гипергликемия (уровень глюкозы плазмы 20,13 мМоль/л) и кетоацидоз. Пациентка переведена в отделение анестезиологии-реанимации, врачом-эндокринологом поставлен диагноз «сахарный диабет 2 типа», начата инсулинотерапия. Доза инсулина в дальнейшем неоднократно корректировалась до достижения целевых показателей гликемии. Пациентка стабилизирована и выписана из стационара в удовлетворительном состоянии под наблюдение врача акушера-гинеколога женской консультации.
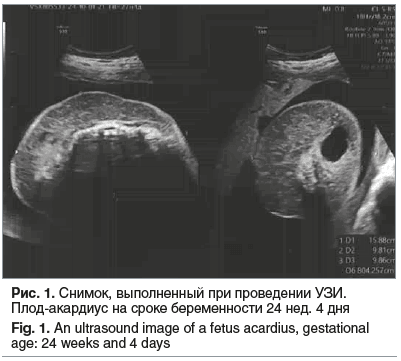
Спустя 2 нед. после выписки в связи с низкой комплаентностью пациентка вновь госпитализируется с диагнозом «неконтролируемый сахарный диабет 2 типа» на инсулинотерапии для коррекции терапии. Через 2 дня в сроке 27 нед. 6 дней было принято решение об экстренном абдоминальном родоразрешении в связи с патологическим типом кардиотокографии (КТГ) (рис. 2), а также отсутствием диастолического компонента PI arteria umblicalis у 1-го плода по данным УЗ-допплерометрии.

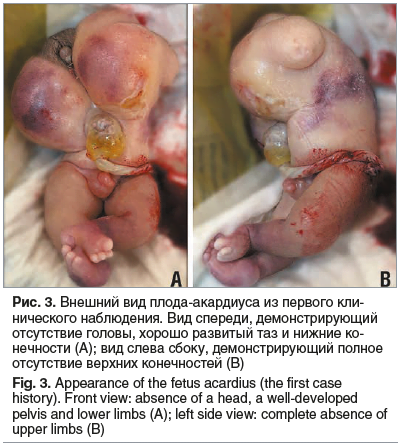
Проведено кесарево сечение, в целом плодном пузыре за головку извлечен недоношенный мальчик массой 982 г и ростом 34 см. Ребенок переведен в отделение реанимации и интенсивной терапии. Затем за ножки извлечен плод длиной 15 см, массой 240 г, мужского пола, с пороками развития (акардиус) — акрания, туловище, сформированное с омфалоцеле, двусторонняя косолапость и абрахия (рис. 3).
Единая плацента имела массу 658 г, диаметр до 18 см, толщину 2 см. Длина пуповины плода-помпы 40 см с центральным прикреплением, тремя сосудами. В 1,5 см от ее основания отходит пуповина второго плода в виде тяжа длиной 20 см с двумя сосудами. Между основаниями пуповин крупный артерио-артериальный анастомоз. При гистологическом исследовании установлено следующее: ворсинчатое дерево плаценты соответствует сроку беременности, с кровоизлияниями в строме отдельных ворсин, с субхориальным тромбозом под основанием пуповины, тромбоз единственной артерии и вены пуповины плода-акардиуса.
Новорожденный мальчик был оценен на 7/8 баллов по шкале Апгар: ЧСС больше 100 в 1 мин с регулярным дыханием, дыхательными нарушениями, акроцианозом, мышечной гипотонией. Была начата респираторная поддержка, неинвазивная вентиляция легких (НИВЛ) через маску, на 5-й минуте продолжена НИВЛ через назальные канюли. На фоне продолжающейся НИВЛ отмечалось нарастание дыхательной недостаточности 4–5 баллов по шкале Сильвермана, в связи с чем на 10-й минуте жизни ребенок был интубирован. На 30-й минуте жизни в тяжелом состоянии для дальнейшего лечения ребенок был переведен в отделение реанимации и интенсивной терапии, где начата инфузионная, кардиотоническая, вазопрессорная, антибактериальная и антигрибковая терапия. С первых часов жизни у ребенка развился шок смешанного генеза, который, несмотря на максимальные дозировки проводимой вазопрессорной и кардиотонической терапии, прогрессировал. У ребенка с первых секунд жизни отмечалось нарушение углеводного обмена: гипогликемия (уровень глюкозы плазмы крови 2,1 ммоль/л), возникшая сразу после рождения, сменившаяся гипергликемией (максимальный уровень глюкозы в плазме крови 16,5 ммоль/л) с эпизодами гипогликемии, развился метаболический ацидоз. После начатой инсулинотерапии и ощелачивающей терапии уровень глюкозы крови снизился до 6,5 ммоль/л.
На 2-е сутки — прогрессирование полиорганной недостаточности с последующей гибелью плода. Ребенок прожил 1 день 3 ч 36 мин.
Пациентка была выписана домой на 4-е сутки после родов под наблюдение врача акушера-гинеколога и врача-эндокринолога КДО ГБУЗ «ГКБ № 67 им. Л.А. Ворохобова ДЗМ». В заключение можно отметить, что причиной неблагоприятного исхода послужил комплекс факторов: неэффективная коагуляция сосудов пуповины плода-акардиуса, которая привела к нарастанию СН у плода-помпы, и неадекватный контроль гликемии вследствие низкого комплаенса пациентки. Отсутствие адекватной инсулинотерапии во время беременности привело к тяжелой, стойкой гипергликемии матери, что впоследствии усугубило состояние новорожденного, вызвав неонатальную гипогликемию.
Клиническое наблюдение 2
Повторнобеременная пациентка А., 33 года, поступила по наряду скорой помощи в ГБУЗ «ГКБ № 24 ДЗМ» с диагнозом «монохориальная диамниотическая (МХДА) двойня» в сроке беременности 33 нед. 2 дня , головное предлежание 1-го плода, нарушение кровотока в маточно-плацентарном комплексе 1-го плода, СОАП, Acardius acephalus, выраженное многоводие 2-го плода, выраженное маловодие 1-го плода. Жалоб на момент осмотра не было. При сборе анамнеза выявлено, что данная беременность вторая, наступила самостоятельно. Первая беременность закончилась своевременными самопроизвольными родами в 2016 г., родился мальчик массой 3380 г, ростом 52 см, с оценкой по шкале Апгар 8/9 баллов, послеродовый период протекал без особенностей. На первом УЗИ настоящей беременности в сроке 10 нед. в полости матки определяется одно плодное яйцо с двумя эмбрионами, сердцебиение 1-го плода 180 уд/мин, сердцебиение второго плода не определяется, копчико-теменной размер (КТР) 1-го плода соответствует 10 нед. 6 дням беременности, КТР 2-го плода — 7 нед. 4 дням. По данным пренатального скринингового исследования II триместра в полости матки визуализируется плодное яйцо размерами 99×54×89 мм, содержащее аморфный плод, имеющий нижнюю часть туловища с выраженным отеком подкожной жировой клетчатки, правую конечность (состоящую из трех сегментов), левую конечность (состоящую из бедра), при цветовом допплеровском картировании визуализируется сосуд с артериальным типом кровотока. Заключение: беременность 19 нед. 5 дней. МХДА-двойня. СОАП. Acardius acephalus. Пациентке было предложено проведение лазерной коагуляции сосудов пуповины 2-го плода, от которого пациентка отказалась. В течение II и III триместра проводилось динамическое наблюдение за состоянием беременной и плодов, контрольные УЗИ в динамике: МХДА-двойня, СОАП, нарушений маточно-плацентарного кровотока нет, нормальное количество околоплодных вод.
При поступлении, по данным УЗИ, в сроке беременности 33 нед. 2 дня выявлено выраженное маловодие (максимальный вертикальный карман (МВК) 1,8 см) 1-го плода и выраженное многоводие (МВК 12 см), выраженные отеки подкожно-жировой клетчатки (ПЖК) 2-го плода. Голова 2-го плода не сформирована, мышечно-костные изменения конечностей — плод аморфный, пуповина — три сосуда, признаков тромбоза нет, кровоток не определяется (рис. 4). По данным допплерометрии 1-го плода: PI arteria umblicalis — 1,33/1,10, MCA PSV — 36,4 cм/c.
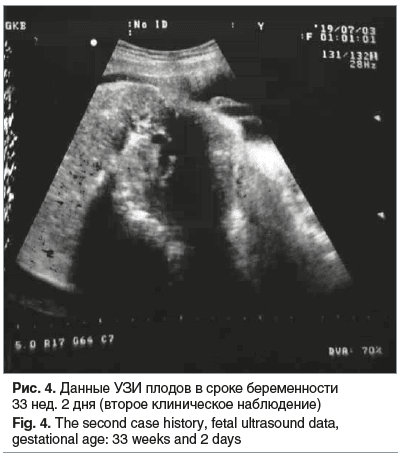
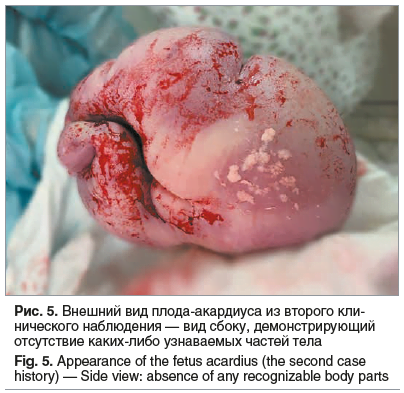
Нарушение кровотока в артерии пуповины. Фетометрия: ПМП — 2015 г, без признаков СН. Учитывая выраженное маловодие 1-го плода у беременной с МХДА, СОАП, нарушение кровотока в артерии пуповины, Acardius acephalus, выраженное многоводие 2-го плода, пациентка была родоразрешена путем операции кесарева сечения в экстренном порядке. Был извлечен за головку недоношенный мальчик массой 1860 г, ростом 43 см, с оценкой по шкале Апгар 6/7 баллов. Через 2 мин был извлечен аморфный плод без дифференциации туловища, головы и конечностей, массой 3000 г (рис. 5).
Единая плацента имела массу 710 г. При осмотре плаценты от нее отходят две пуповины, в обеих три сосуда, между основаниями пуповин крупный артерио-артериальный анастомоз.
Состояние матери в послеродовом периоде удовлетворительное, данные клинико-лабораторных и инструментальных исследований без патологии. На 4-е сутки пациентка была выписана домой.
У первого ребенка при рождении отмечался разлитой цианоз, ЧСС более 100 в 1 мин с нерегулярным дыханием. Состояние недоношенного тяжелое, обусловлено дыхательной недостаточностью, неврологической симптоматикой в виде синдрома угнетения ЦНС. С рождения начато проведение НИВЛ и наблюдение в условиях отделения реанимации и интенсивной терапии новорожденных. На 30-е сутки жизни состояние ребенка удовлетворительное, переведен в неонатологическое отделение для дальнейшего наблюдения. Выписан домой на 46-е сутки после рождения.
Обсуждение
В мировой практике на сегодняшний день не существует единого алгоритма ведения пациенток с СОАП, но, в зависимости от срока беременности, хориальности и амниальности, могут быть предложены такие способы ведения, как:
лекарственная терапия СН, купирование угрозы преждевременных родов;
амниоредукция (в случае развития многоводия);
внутриутробное хирургическое вмешательство, направленное на прекращение кровоснабжения плода с акардией — главный способ ведения [8].
Существует много методов остановки тока крови, такие как чрескожная спиральная эмболизация, фетоскопическое лигирование, экстракорпоральное лигирование под контролем УЗИ, окклюзия тромбогенными агентами под контролем УЗИ, термокоагуляция под контролем УЗИ, фетоскопическая лазерная фотокоагуляция и радиочастотная абляция под контролем УЗИ [8].
В своей работе G. Pagani et al. [17] доказали, что неблагоприятные исходы беременности значительно реже встречаются при лазерной коагуляции сосудов пуповины до 16 нед. по сравнению с коагуляцией анастомозов на 16-й неделе и позднее. Исходя из проведенной работы, авторами было предложено проводить лазерную терапию между 13-й и 16-й неделями.
P. Chaveeva et al. [18] выявили взаимосвязь между сроками проведения лазерной коагуляции сосудов пуповины и сроком беременности на момент родоразрешения (средний срок родоразрешения составил 38 и 34 нед., когда лечение было проведено на 13-й и 27-й неделях соответственно). Таким образом авторы пришли к выводу, что данную методику лечения рекомендуется проводить на 12–14-й неделе.
В первом клиническом наблюдении лазерная коагуляция сосудов пуповины была выполнена на 19-й неделе, однако на 24-й неделе было зафиксировано возобновление кровотока в артерии пуповины плода-акардиуса. Во втором клиническом наблюдении пациентка отказалась от проведения лазерной коагуляции сосудов пуповины, тем самым не удалось минимизировать перинатальные осложнения для плода-помпы.
Заключение
Феномен плода-акардиуса — редкая, но значимая патология в акушерской практике, представляющая собой специфическое осложнение монохориальной многоплодной беременности. Несмотря на высокий уровень медицинских технологий, эти случаи остаются сложными как в диагностике, так и в лечении. Современные методы диагностики, такие как УЗИ и допплерометрия, позволяют своевременно выявить данную аномалию и принять решение о тактике ведения беременности для снижения перинатальных рисков. Вмешательства, направленные на коррекцию кровообращения между близнецами, повышают шансы на благоприятный исход для донора. Дальнейшие исследования механизма развития акардиального плода помогут не только лучше понять причины данной патологии, но и усовершенствовать методы ее диагностики и лечения.
Сведения об авторах:
Кузнецов Павел Андреевич — к.м.н., доцент кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2492-3910
Пониманская Мария Александровна — к.м.н., заместитель главного врача по акушерско-гинекологической помощи «ГКБ № 67 им. Л.А. Ворохобова ДЗМ»; 123423, Россия, г. Москва, ул. Саляма Адиля, д. 2/44; ORCID iD 0000-0001-9447-110X
Десятник Кирилл Александрович — врач акушер-гинеколог, заведующий акушерским отделением патологии беременности № 1 Перинатального центра «ГКБ № 67 им. Л.А. Ворохобова ДЗМ»; 123423, Россия, г. Москва, ул. Саляма Адиля, д. 2/44; ORCID iD 0000-0001-6758-2605
Саная Севастина Зурабовна — врач акушер-гинеколог акушерского отделения патологии беременности № 1 Перинатального центра «ГКБ № 67 им. Л.А. Ворохобова ДЗМ»; 123423, Россия, г. Москва, ул. Саляма Адиля, д. 2/44; ORCID iD 0000-0001-8289-3380
Матвеев Максим Олегович — врач акушер-гинеколог акушерского отделения патологии беременности № 1 Перинатального центра «ГКБ № 67 им. Л.А. Ворохобова ДЗМ»; 123423, г. Москва, ул. Саляма Адиля, д. 2/44; ORCID iD 0000-0003-2431-1615
Попенова Юлия Александровна — врач акушер-гинеколог акушерского отделения патологии беременности № 1 Перинатального центра «ГКБ № 67 им. Л.А. Ворохобова ДЗМ»; 123423, Россия, г. Москва, ул. Саляма Адиля, д. 2/44; ORCID iD 0009-0005-8789-600X
Тягунова Анна Владимировна — к.м.н., доцент кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001- 7836-6369
Путря Анна Викторовна — клинический ординатор 1-го года кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0003-6628-3357
Аббасова Лейла Яшар кызы — клинический ординатор 1-го года кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0006-1701-8620
Ловкова Анна Ивановна — клинический ординатор 1-го года кафедры акушерства и гинекологии факультета фундаментальной медицины МГУ имени М.В. Ломоносова; 119991, Россия, г. Москва, Ломоносовский пр-т, д. 27, корп. 1; ORCID iD 0009-0006-9215-3750
Федяев Денис Александрович — клинический ординатор 1-го года по специальности «сердечно-сосудистая хирургия» ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ»; 129090, Россия, г. Москва, Большая Сухаревская пл., д. 3; ORCID iD 0009-0009-7172-3496
Контактная информация: Кузнецов Павел Андреевич, e-mail: poohsmith@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.06.2025.
Поступила после рецензирования 27.06.2025.
Принята в печать 22.07.2025.
About the authors:
Pavel A. Kuznetsov — C. Sc. (Med.), Assistant Professor of the Department of Obstetrics and Gynecology, Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0003-2492-3910
Maria A. Ponimanskaya — C. Sc. (Med.), Deputy Chief Physician for Obstetric and Gynecological Care, L.A. Vorokhobov City Clinical Hospital No. 67; 2/44, Salyam
Adil str., Moscow, 123423, Russian Federation; ORCID iD 0000-0001-9447-110X
Kirill A. Desyatnik — Obstetrician-Gynecologist, Head of the Obstetric Department of Pregnancy Failure No. 1, Perinatal Center of L.A. Vorokhobov City Clinical Hospital No. 67; 2/44, Salyam Adil str., Moscow, 123423, Russian Federation; ORCID iD 0000-0001-6758-2605
Sevastina Z. Sanaya — Obstetrician-Gynecologist, Obstetric Department of Pregnancy Failure No. 1, Perinatal Center of L.A. Vorokhobov City Clinical Hospital No. 67; 2/44, Salyam Adil str., Moscow, 123423, Russian Federation; ORCID iD 0000-0001-8289-3380
Maksim O. Matveev — Obstetrician-Gynecologist, Obstetric Department of Pregnancy Failure No. 1, Perinatal Center of L.A. Vorokhobov City Clinical Hospital No. 67; 2/44, Salyam Adil str., Moscow, 123423, Russian Federation; ORCID iD 0000-0003-2431-1615
Yuliya A. Popyonova — Obstetrician-Gynecologist, Obstetric Department of Pregnancy Failure No. 1, Perinatal Center of L.A. Vorokhobov City Clinical Hospital No. 67; 2/44, Salyam Adil str., Moscow, 123423, Russian Federation; ORCID iD 0009-0005-8789-600X
Anna V. Tyagunova — C. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology, Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0001-7836-6369
Anna V. Putrya — 1st-year Clinical Resident at the Department of Obstetrics and Gynecology, Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0009-0003-6628-3357
Leila Ya. Abbasova — 1st-year Clinical Resident at the Department of Obstetrics and Gynecology, Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0009-0006-1701-8620
Anna I. Lovkova — 1st-year Clinical Resident at the Department of Obstetrics and Gynecology, Faculty of Fundamental Medicine, Lomonosov Moscow State University; 27, bld. 1, Lomonosovskyi ave., Moscow, 119991, Russian Federation, ORCID iD 0009-0006-9215-3750
Denis A. Fedyaev — 1st-year Clinical Resident specializing in cardiovascular surgery, N.V. Sklifosovskiy Research Institute for Emergency Medical Aid; 3, Bolshaya Sukharevskaya sq., Moscow, 129090, Russian Federation; ORCID iD 0009-0009-7172-3496
Contact information: Pavel A. Kuznetsov, e-mail: poohsmith@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.06.2025.
Revised 27.06.2025.
Accepted 22.07.2025.
Информация с rmj.ru



