Введение
Несмотря на достижения в области диагностики и лечения артериальной гипертензии (АГ), повышенное артериальное давление (АД) продолжает оставаться главной причиной таких осложнений, как инфаркт миокарда, острое нарушение мозгового кровообращения, сердечная и почечная недостаточность [1].
Одним из механизмов, приводящих к ремоделированию сердца и сосудов, является перегрузка давлением. Ремоделирование — это внутриклеточная и молекулярная трансформация, которая приводит к изменению конфигурации и функции сердца [2]. Одним из патогенетических механизмов ремоделирования является активация ренин-ангиотензин-альдостероновой системы (РААС), которая стимулирует повышение уровня ангиотензинпревращающего фермента и поддерживает повышенное содержание ангио-тензина II [3, 4].
Гипертрофия левого желудочка (ЛЖ) у пациентов, страдающих АГ, является неблагоприятным прогностическим фактором развития сердечно-сосудистых осложнений [5–7]. В исследовании В.Н. Кандиловой и соавт. [8] выявлено более выраженное ремоделирование сердца и сосудов у пациентов с АГ в старших возрастных группах.
На данный момент недостаточно изучена взаимо-связь ремоделирования сердца и сосудов с содержанием ренина в крови у пациентов, страдающих АГ. А данные о распространенности норморениновой и гиперрениновой АГ в разных возрастных группах весьма противоречивы [4, 9].
Цель исследования: установление зависимости частоты и выраженности ремоделирования сердца от уровня ренина в крови у пациентов различного возраста и пола, страдающих АГ.
Материал и методы
Обследовано 120 человек с АГ 2-й степени, со стойким повышением АД (длительностью от 1 мес. до нескольких лет), не получавших ранее регулярную антигипертензивную терапию. Пациенты были распределены на 3 возрастные группы по 40 человек (по 20 мужчин и 20 женщин): пациенты молодого возраста (25 лет — 44 года), среднего возраста (45–59 лет) и пожилого возраста (60 лет и старше).
Критерии невключения: наличие патологии, которая оказывает влияние на активацию РААС: заболевания почек, хроническая сердечная недостаточность, наличие новообразований. На момент обследования пациенты не принимали лекарственные препараты, которые могли оказать влияние на содержание ренина и альдостерона в крови.
Ренин и альдостерон в плазме крови определяли методом иммуноферментного анализа. За норму ренина были приняты значения 2,50–58,78 пг/мл [4]. При этих значениях ренина пациенты были отнесены к группе норморениновой АГ, со значениями ренина ≤2,4 пг/мл — гипорениновой АГ, при значениях ренина ≥58,79 пг/мл — гиперрениновой АГ. За нормальные значения альдостерона в крови приняты 30–199 пг/мл.
Эхокардиографию выполняли на ультразвуковом сканере MINDRAYDC-70. Индекс массы миокарда (ИММ) ЛЖ вычисляли по формуле Devereux, гипертрофию ЛЖ диагностировали при значении >115 г/м2 для мужчин и >95 г/м2 для женщин [10].
Геометрическую модель ЛЖ оценивали на основании ИММ ЛЖ и показателя относительной толщины стенок (ОТС) ЛЖ. Последний рассчитывали по формуле:
ОТС = (ТМЖП + ТЗС ЛЖ) / КДР ЛЖ,
где ТМЖП — толщина межжелудочковой перегородки, ТЗС ЛЖ — толщина задней стенки левого желудочка, КДР — конечно-диастолический размер.
Критерии геометрии ЛЖ [6]:
нормальная геометрия ЛЖ: ИММ в пределах нормы, ОТС ≤0,42;
концентрическое ремоделирование ЛЖ: ИММ в пределах нормы, ОТС >0,42;
концентрическая гипертрофия ЛЖ: увеличение ИММ, ОТС >0,42;
эксцентрическая гипертрофия ЛЖ: увеличение ИММ, ОТС ≤0,42.
Статистические расчеты проводили в программе STATTECH. Статистическую значимость различий между показателями оценивали с помощью t-критерия Стьюдента. С целью установления наличия связи уровня ренина с ИММ и ОТС ЛЖ был использован коэффициент корреляции Спирмена (ρ); при оценке силы связи коэффициентов корреляции использовали шкалу Чеддока [11].
Исследование было одобрено локальным комитетом по этике Новгородского государственного университета имени Ярослава Мудрого. Информированное согласие было получено от всех участников, включенных в исследование.
Результаты и обсуждение
По результатам проведенного исследования установлено значимое влияние возраста пациентов на такие структурные показатели сердца, как ОТС и ИММ ЛЖ (табл. 1). Значения ОТС ЛЖ у лиц среднего возраста были достоверно выше, чем у молодых пациентов (р<0,05), и еще более увеличивались у пациентов пожилого возраста (на 21,6%, относительно молодых пациентов, р<0,01). Показатель ИММ ЛЖ практически не отличался в группах молодых пациентов и пациентов среднего возраста (р>0,05) и значительно (на 40% в сравнении с молодыми пациентами) увеличивался у лиц старшего возраста (р<0,01).
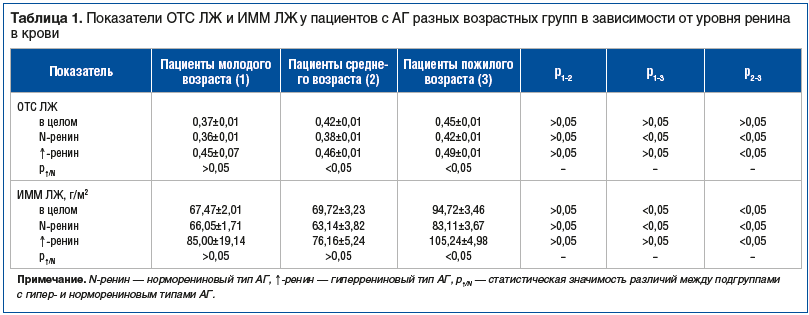
Влияние возраста на увеличение массы сердца у здоровых лиц уже было отмечено в ряде исследований [12, 13], наличие же у пациентов высокого АД и действие различных патогенетических факторов на развитие АГ усиливает эти возрастные различия.
Одним из ведущих факторов развития ремоделирования сердца, как известно, является повышение активности РААС [14]. Результаты нашего исследования показали, что с возрастом у пациентов с АГ происходит значительное повышение содержания ренина в плазме крови: с 24,39±2,36 пг/мл у молодых лиц до 46,89±4,77 пг/мл в среднем возрасте (р<0,01) и 48,63±3,93 пг/мл в старшей возрастной группе (р<0,01). Полученные нами данные противоречат результатам исследования других авторов. Так, в исследовании, проведенном R. Alnazer et al. [15], у пациентов с эссенциальной АГ содержание ренина было обратно пропорционально возрасту.
В молодой возрастной группе достоверно преобладала норморениновая АГ — у 37 (92%) человек, и лишь у 3 (8%) пациентов выявлен гиперрениновый тип АГ (р<0,05).
В средней возрастной группе норморениновая АГ регистрировалась значительно реже — у 21 (52%) человека, а гиперрениновая — у 19 (48%).
Особенностью пациентов старшей возрастной группы было преобладание лиц с гиперрениновой АГ — у 22 (55%) человек, норморениновый тип АГ обнаружен у 18 (45%) человек.
В каждой возрастной группе показатели ОТС и ИММ ЛЖ были выше в группах с повышенным содержанием ренина в крови (см. табл. 1), но достоверными различия по обоим показателям были только в старшей возрастной группе (р<0,01), в средней возрастной группе — лишь по величине ОТС (р<0,01).
В результате проведенного корреляционного анализа была выявлена прямая связь уровня ренина в крови с ОТС и ИММ ЛЖ. Ренин венозной крови положительно связан с ОТС ЛЖ у пациентов среднего возраста (ρ=0,621, сила связи по шкале Чеддока — заметная) и у лиц пожилого возраста (ρ=0,366, сила связи по шкале Чеддока — умеренная). Также ИММ ЛЖ положительно связан с ренином у пациентов средней (ρ=0,355, сила связи по шкале Чеддока — умеренная) и пожилой (ρ=0,428, сила связи по шкале Чеддока — умеренная) возрастных групп.
Тот факт, что возрастное увеличение ОТС и ИММ ЛЖ происходит в группах и с нормальным, и с повышенным содержанием ренина в крови, свидетельствует о том, что в развитии более выраженной гипертрофии сердца у лиц среднего и пожилого возраста играют роль и другие регуляторные механизмы.
Рассматривая значение функционального изменения РААС в развитии структурно-функциональных изменений сердца, нельзя ограничиваться только его влиянием на выраженность гипертрофии и фиброза сердца. Важно определить роль этой системы в формировании того или иного типа ремоделирования сердца.
В нашем исследовании у пациентов молодой возрастной группы нормальная геометрия ЛЖ выявлена у 39 (98%) человек (из которых 37 — с норморениновой АГ и 2 — с гиперрениновой АГ), концентрическая гипертрофия ЛЖ была обнаружена лишь у 1 (2%) человека (с гиперрениновой АГ).
Среди пациентов средней возрастной группы нормальная геометрия ЛЖ выявлена у 24 (60%) пациентов (из которых 20 — с норморениновой АГ и 4 — с гиперрениновой АГ), у 3 (7,5%) пациентов диагностирована концентрическая гипертрофия (с гиперрениновой АГ), концентрическое ремоделирование ЛЖ выявлено у 12 (30%) пациентов с гиперрениновой АГ, и у 1 (2,5%) пациента была диагностирована эксцентрическая гипертрофия ЛЖ (с норморениновой АГ).
У пациентов старшей возрастной группы нормальная геометрия ЛЖ была выявлена у 11 (27,5%) пациентов (с норморениновой АГ), концентрическая гипертрофия — у 12 (30%) (все с гиперрениновой АГ), концентрическое ремоделирование ЛЖ — у 14 (35%) человек (из которых 6 — с норморениновой АГ и 8 — с гиперрениновой АГ), эксцентрическая гипертрофия ЛЖ диагностирована у 3 (7,5%) человек (2 — с норморениновой АГ и 1 — с гиперрениновой АГ).
Результаты исследования влияния пола пациентов с АГ на возрастную динамику структурных изменений сердца и систем его регуляции представлены в таблице 2.

Полученные данные свидетельствуют о более высоких значениях ИММ ЛЖ у мужчин во всех возрастных группах, достоверно выраженных у лиц среднего и пожилого возраста.
Пол и возраст пациентов с АГ не влияли на содержание альдостерона в крови. Интересные, на наш взгляд, отличия обнаружены при исследовании уровня ренина в крови.
В целом по группе установлено некоторое преобладание содержания ренина у мужчин (43,67±3,44 пг/мл) в сравнении с женщинами (36,35±3,36 пг/мл, р=0,1306). При этом в группе пациентов молодого возраста гендерных отличий в значениях уровня ренина не установлено, они становятся заметными в группах пациентов среднего и пожилого возраста. Обращает на себя внимание более чем двукратное увеличение содержания ренина в крови у мужчин старших возрастных групп по сравнению с показателями у мужчин молодого возраста. У женщин также происходило достоверное увеличение с возрастом уровня ренина в плазме крови, но менее выраженное по сравнению с показателями, полученными у мужчин.
На содержание ренина в плазме крови у женщин значительное влияние оказывает менопауза — ее наступление сопровождается более чем двукратным увеличением содержания ренина по сравнению с женщинами с сохраненным менструальным циклом (с 24,50±3,13 до 47,34±3,24 пг/мл, р<0,01). Длительность постменопаузы не оказывала влияния на содержание ренина: 49,00±2,91 пг/мл при ранней менопаузе и 45,41±3,62 пг/мл — при поздней менопаузе (р>0,05).
Данные литературы по гендерному различию активности ренина плазмы разнятся. В одних исследованиях женщины, страдающие АГ, имеют более высокий показатель активности ренина плазмы, чем мужчины, в других исследованиях у пациентов с эссенциальной АГ существенного отличия между мужчинами и женщинами в содержании ренина не получено [16, 17]. В исследовании J. Rechelhoff [18] активность ренина плазмы у женщин была несколько ниже, чем у мужчин, при этом она повышалась в постменопаузе. Если рассматривать здоровую популяцию, есть данные, свидетельствующие о более низком показателе активности ренина у женщин после наступления менопаузы по сравнению с мужчинами и женщинами в репродуктивном периоде [19].
Наше исследование имеет ограничение: все участники были набраны в одном регионе, что сужает обобщаемость выводов.
Выводы
У пациентов с АГ с увеличением возраста происходит выраженное увеличение массы миокарда ЛЖ и содержания ренина в крови. Частота норморенинового типа АГ уменьшается с 92% в молодом возрасте до 52% в среднем и 45% в пожилом возрасте. Частота гиперрениновой АГ увеличивается, соответственно, с 8% до 48 и 55%.
Возраст пациентов с АГ оказывает значительное влияние на частоту развития концентрического ремоделирования ЛЖ — с отсутствия в группе молодых до 30% у лиц средней возрастной группы и 35% у лиц пожилого возраста. У пациентов с гиперрениновым типом АГ значительно чаще развивается концентрический вариант ремоделирования ЛЖ. Выявлена положительная корреляционная связь уровня ренина в крови с ОТС и ИММ ЛЖ.
В среднем и пожилом возрасте ИММ ЛЖ и содержание ренина в крови достоверно выше у мужчин, чем у женщин. Наступление постменопаузы у женщин сопровождается значительным увеличением содержания ренина. Возраст и пол не оказывают значимого влияния на содержание альдостерона в крови пациентов с АГ.
Информация с rmj.ru





