Введение
Фибрилляция предсердий (ФП) — самая распространенная разновидность наджелудочковой тахиаритмии с хаотической электрической активностью предсердий и частотой сердечных сокращений (ЧСС) 350–700 в 1 мин (с отсутствием P-волны на электрокардиограмме (ЭКГ)), что исключает возможность их координированного сокращения и вызывает, как правило, нерегулярный ритм желудочков. Распространенность ФП в общей популяции составляет 1–2%, при этом частота встречаемости увеличивается с возрастом: от <0,5% в возрасте 40–50 лет до 5–15% в возрасте старше 80 лет. У мужчин ФП развивается чаще, чем у женщин1. По данным зарубежных авторов, ФП наблюдается более чем у 33 млн человек во всем мире и связана со значительным увеличением заболеваемости и смертности [1].
Важной проблемой остается вопрос назначения сердечных гликозидов (СГ) для длительного приема пациентам с постоянной формой ФП, что обусловлено узким «терапевтическим окном», сложностью контроля их концентрации в крови, высоким риском развития осложнений на фоне токсического воздействия на кардиальные электрофизиологические процессы. Одним из таких осложнений является двунаправленная желудочковая тахикардия (ДЖТ) — редкая форма желудочковой тахикардии, которая проявляется на ЭКГ двойной морфологией комплексов QRS. Впервые о ней сообщалось в 1920-х годах именно как об осложнении приема дигоксина. ДЖТ встречается и при других состояниях, таких как миокардит, саркоидоз, катехоламинергическая полиморфная желудочковая тахикардия и синдром Андерсена — Тавиля [2].
Точный механизм ДЖТ до конца не изучен. Наиболее вероятной гипотезой является наличие двух различных очагов с разными порогами частоты желудочковых бигеминий, вызывающих реципрокную активацию, что приводит к чередованию осей [3].
Представляем собственное клиническое наблюдение возникновения ДЖТ у пациентки с постоянной формой ФП на фоне длительного бесконтрольного приема дигоксина (согласие пациентки на публикацию данных в обезличенном виде получено).
Содержание статьи
Клиническое наблюдение
Пациентка П., 78 лет, обратилась с жалобами на повышение артериального давления (АД) до 200/100 мм рт. ст., головную боль средней интенсивности без иррадиации, преимущественно в затылочной области, ноющего характера, снижение памяти, тошноту в течение двух недель, однократный эпизод рвоты.
Анамнез заболевания. Со слов пациентки и по данным электронной медицинской карты, хронические заболевания: гипертоническая болезнь III стадии, неконтролируемая артериальная гипертензия (АГ), риск сердечно-сосудистых осложнений 4 (очень высокий), нарушение ритма сердца (постоянная форма ФП), риск тромбоэмболических осложнений по шкале СHA2DS2-VASc составлял 4 балла, риск кровотечений по шкале HAS-BLEED — 2 балла, хроническая сердечная недостаточность (ХСН) 2А стадии, II функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца (New York Heart Association, NYHA), цереброваскулярная болезнь, хроническая ишемия головного мозга. В течение последних 10 лет постоянно принимает: бисопролол 10 мг, аторвастатин 10 мг, дигоксин 0,25 мг, ривароксабан 15 мг, спиронолактон 25 мг. В ходе беседы установлено, что прием дигоксина осуществляется бесконтрольно, перерывов в приеме препарата нет, контроль сывороточной концентрации дигоксина не проводится, контрольная ЭКГ выполняется нерегулярно.
Анамнез жизни. Венерические заболевания, туберкулез, вирусный гепатит, инфаркт миокарда, острое нарушение мозгового кровообращения, сахарный диабет отрицает. Травмы в анамнезе отрицает. Операции: экстирпация матки с придатками в 2005 г. Аллергологический анамнез: непереносимости лекарственных препаратов и пищевых продуктов нет. Побочное действие лекарственных препаратов отрицает. Эпидемиологический анамнез: респираторные заболевания в течение последних 14 дней, а также контакт с инфекционными и лихорадящими больными в течение 14 дней отрицает.
Объективный статус. Общее состояние средней степени тяжести. Кожные покровы и видимые слизистые без особенностей. Отеков нет. Щитовидная железа не увеличена. Периферические сосуды без особенностей. Лимфоузлы не увеличены, безболезненные. Костно-суставная и мышечная системы без видимой патологии. Частота дыхательных движений (ЧДД) 24 в 1 мин. Границы легких в пределах физиологической нормы, ясный легочный перкуторный звук. В легких дыхание везикулярное, проводится во все отделы, хрипов нет. Тоны сердца приглушены, ритм неправильный, акцент II тона над аортой, шумов нет. АД на обеих руках 200/100 мм рт. ст. ЧСС 140 в 1 мин. Дефицита пульса нет, пульс не напряжен. Живот мягкий, безболезненный. Печень не увеличена, безболезненная. Селезенка не пальпируется. Симптом поколачивания отрицательный с обеих сторон. Физиологические отправления в норме. Поведение спокойное. Контакт сохранен, верно ориентирована во времени, пространстве и собственной личности. Когнитивные функции снижены, к своему состоянию не критична. Менингеальных и очаговых симптомов нет. Видимых травм и повреждений не обнаружено.
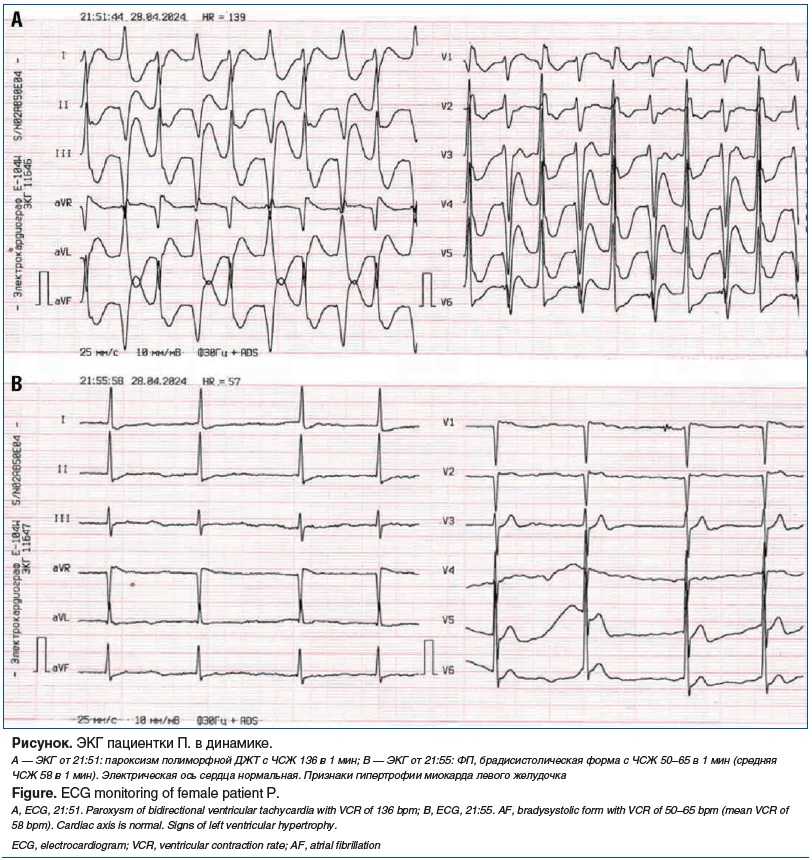
Данные инструментальных исследований. Пульсоксиметрия: SpO2 98%, ЧСС 140 в 1 мин. На ЭКГ: полиморфная ДЖТ с частотой сокращения желудочков (ЧСЖ) 136 в 1 мин (см. рисунок, А).
На основании анамнеза, жалоб, объективного осмотра и данных инструментального обследования установлен предварительный диагноз: нарушение ритма сердца: постоянная форма ФП. Пароксизм полиморфной ДЖТ от 28.04.2024. Гипертоническая болезнь III стадии. Неконтролируемая АГ. Гипертрофия миокарда левого желудочка. Риск 4 (очень высокий). Целевое АД <130–139/70–79 мм рт. ст. Гипертонический криз от 28.04.2024. ХСН 2А стадии, II ФК по NYHA.
Оказанная помощь и ее эффект
Продолжен ЭКГ-мониторинг. Проведена катетеризация периферической вены для введения антиаритмического препарата, однако через 4 мин на ЭКГ-мониторе зарегистрировано спонтанное купирование пароксизма ДЖТ (см. рисунок, В).
Состояние пациентки средней тяжести, АД 200/100 мм рт. ст., ЧСС 55 в 1 мин, ЧДД 20 в 1 мин, SpO2 98%. В связи со спонтанным купированием полиморфной желудочковой тахикардии введение антиаритмиков не показано, назначены гипотензивные препараты — с положительным эффектом.
В связи с развившимся эпизодом ДЖТ пациентке была предложена госпитализация в стационар, от которой она категорически отказалась. Пациентке были даны рекомендации: необходимость контроля концентрации дигоксина и уровня электролитов в крови, контроль ЭКГ в амбулаторных условиях.
Сформулирован заключительный диагноз: нарушение ритма сердца: постоянная форма ФП. Пароксизм полиморфной ДЖТ от 28.04.24. Гипертоническая болезнь III стадии. Неконтролируемая АГ. Гипертрофия миокарда левого желудочка. Риск 4 (очень высокий). Целевое АД <130–139/70–79 мм рт. ст. Гипертонический криз от 28.04.2024. ХСН 2А стадии, II ФК по NYHA.
Обсуждение
Согласно действующим рекомендациям Минздрава России «Фибрилляция и трепетание предсердий» при постоянной форме ФП для контроля ЧСС применяют β-адреноблокаторы, недигидропиридиновые антагонисты кальция и СГ (дигоксин)1 [4].
Дигоксин назначается пациентам с малоактивным образом жизни (пожилые лица со сниженной физической активностью) при невозможности применения других ритмурежающих препаратов в качестве монотерапии или в комбинации с β-адреноблокаторами для снижения ЧСЖ. Одной из наиболее распространенных причин развития дигиталисной интоксикации является узкий диапазон между терапевтическим и токсическим эффектами, характерный для СГ [5]. По данным зарубежных авторов, ежегодно выписывается около 3 млн рецептов на дигоксин и примерно у 1% пациентов развиваются токсические эффекты, риск развития которых увеличивается с возрастом [6]. Учитывая тот факт, что дигоксин имеет узкое «терапевтическое окно» и высокую вероятность передозировки, назначение данного препарата у пациентов с низкой комплаентностью неоправданно из-за риска возникновения существенных спонтанных и неконтролируемых изменений концентрации лекарственного препарата [7].
Дигоксин может вызвать жизнеугрожающие нарушения ритма и проводимости. К ним относятся синоатриальные и атриовентрикулярные блокады, желудочковая тахикардия и фибрилляция желудочков. Причинами их возникновения являются постдеполяризационные потенциалы, усиленная диастолическая реполяризация и механизмы re-entry. Также немаловажная роль отводится накоплению ионов кальция внутри клетки, что повышает риск развития тахиаритмий [8].
Исследование AFFIRM (Atrial Fibrillation Follow-Up Investigation of Rhythm Management) у больных с ФП объективно продемонстрировало негативное воздействие дигоксина. В группе исследуемых пациентов, получавших данный препарат, выявлено статистически значимое повышение аритмогенной смертности на 61%. Превалирование непосредственно аритмогенной смертности можно обосновать проаритмогенным и токсическим действием дигоксина [9, 10]. Схожие результаты демонстрируют данные многоцентрового исследования TREAT-AF, в котором прием дигоксина был связан с повышенным риском смерти у пациентов с ФП независимо от приверженности лечению, функции почек, сопутствующих сердечно-сосудистых заболеваний и сопутствующей терапии [11].
При обзоре исследований по наблюдению сывороточной концентрации дигоксина (СКД) определена рациональность лабораторного наблюдения за действием препарата в течение нескольких недель от начала приема первой дозы у пациентов старших возрастных групп.
Связно это с тем, что у пожилых пациентов наблюдается существенное увеличение периода полувыведения СГ [12]. Также имеется взаимосвязь между скоростью клубочковой фильтрации и СКД, вследствие чего снижение почечного клиренса у пожилых пациентов должно подлежать тщательному контролю [13, 14]. Кроме того, рекомендации по лабораторному мониторингу СКД актуальны для тех пациентов с ФП, у которых недостаточно эффективны обычные дозировки препаратов для контроля ЧСС [7]. Имеются данные о различной частоте развития дигиталисной интоксикации в зависимости от пола: у женщин желудочковые нарушения ритма и интоксикация возникают чаще, чем у мужчин, из-за чего женщинам обычно назначается меньшая дозировка СГ [15].
Оптимальная СКД, которая обеспечивает наиболее благоприятное соотношение безопасности и эффективности, — 0,5–0,9 нг/мл. Принимая во внимание большую разницу в длительности периода полувыведения препарата среди разных возрастных групп, оправданно выполнение контрольного измерения уровня дигоксина в сыворотке крови через 2 и 4 нед. от начала лечения, в тех случаях, когда требуется быстрое насыщение, измерение СКД нужно провести через 3–4 и 10–12 дней от начала терапии. Такая тактика дает возможность, учитывая индивидуальные особенности фармакокинетики препарата у пациента, наиболее точно подобрать оптимальную дозу дигоксина и снизить возможный риск его токсического действия [10].
В представленном клиническом наблюдении описано развитие одного из возможных проаритмогенных побочных эффектов бесконтрольного приема дигоксина — редкой формы полиморфной желудочковой тахикардии. Впоследствии пациентка предоставила результаты исследования концентрации дигоксина в крови, которая составила 2,1 нг/мл. Таким образом, порог концентрации дигоксина был существенно выше оптимального, с присущей для дигиталисной интоксикации клинической картиной, но пока еще без характерных для нее изменений на ЭКГ (депрессия сегмента ST «корытообразной» формы). Данный случай не имел тяжелых последствий для пациентки, так как эпизод ДЖТ купировался спонтанно без применения медикаментозной терапии, повторных эпизодов не регистрировалось, а прием дигоксина в последующем был отменен кардиологом по месту жительства.
Заключение
В случаях вынужденного назначения дигоксина нужно учитывать и минимизировать факторы, предрасполагающие к гликозидной интоксикации: пожилой возраст, электролитные нарушения, нарушение функции печени и почек, потенциальное усиление токсического эффекта СГ при взаимодействии с рядом других лекарственных препаратов (верапамил, амиодарон, спиронолактон и др.). Пациенты, длительно принимающие дигоксин, нуждаются в регулярной оценке его сывороточной концентрации, определении уровня электролитов в крови и рутинном контроле ЭКГ в амбулаторных условиях для своевременной диагностики признаков дигиталисной интоксикации и коррекции дозы препарата. Кроме того, при необходимости длительной терапии дигоксином, следует обращать внимание на когнитивное состояние пациента с целью предотвращения развития фатальных осложнений на фоне низкой комплаентности.
1Клинические рекомендации. Фибрилляция и трепетание предсердий у взрослых. 2020. (Электронный ресурс.) UPL: https://cr.minzdrav.gov.ru/schema/382_1?ysclid=ly5ieg5rzg682246202 (дата обращения: 30.04.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Петербургский Дмитрий Владимирович — клинический ординатор кафедры факультетской терапии и профболезней лечебного факультета НОИ клинической медицины им. Н.А. Семашко ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; врач-терапевт бригады неотложной медицинской помощи взрослому населению CCиНМП им. А.С. Пучкова; 129090, Россия, г. Москва, 1-й Коптельский пер., д. 3, стр. 1; ORCID iD 0009-0005-8364-9239.
Синицын Евгений Александрович — к.м.н., ассистент кафедры факультетской терапии и профболезней лечебного факультета НОИ клинической медицины им. Н.А. Семашко ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; старший научный сотрудник лаборатории клинической пульмонологии ФГБУ «НИИ пульмонологии» ФМБА России; 115682, Россия, г. Москва, Ореховый б-р, д. 28; ORCID iD 0000-0002-8813-5932.
Смолякова Екатерина Владимировна — к.м.н., ассистент кафедры факультетской терапии и профболезней лечебного факультета НОИ клинической медицины им. Н.А. Семашко ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; ORCID iD 0000-0002-1904-5319.
Зыков Кирилл Алексеевич — д.м.н., профессор РАН, член-корреспондент РАН, заведующий кафедрой
факультетской терапии и профболезней лечебного факультета НОИ клинической медицины им. Н.А. Семашко ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; заместитель директора по научной и инновационной работе ФГБУ «НИИ пульмонологии» ФМБА России; 115682, Россия, г. Москва, Ореховый б-р, д. 28; ORCID iD 0000-0003-3385-2632.
Контактная информация: Петербургский Дмитрий Владимирович, e-mail: kasper.piter@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 13.05.2024.
Поступила после рецензирования 05.06.2024.
Принята в печать 01.07.2024.
ABOUT THE AUTHORS:
Dmitry V. Peterburgsky — Clinical Resident of the Department of Faculty Therapy and Occupational Diseases of the Medical Faculty of the N.A. Semashko Research and Educational Institute of Clinical Medicine, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; general practitioner of the Emergency Medical Team for Adult Population, A.S. Puchkov Ambulance and Emergency Medical Care Station; 3, build. 3, Koptelskiy Lane, Moscow, 129090, Russian Federation; ORCID iD 0009-0005-8364-9239.
Evgeny A. Sinitsyn — C. Sc. (Med.), Assistant Professor of the Department of Faculty Therapy and Occupational Diseases of the Medical Faculty of the N.A. Semashko Research and Educational Institute of Clinical Medicine, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; Senior Researcher at the Laboratory of Clinical Pulmonology, Research Institute of Pulmonology of the Russian Federal Medical Biological Agency, Moscow; 28, Orekhovy Avenue, Moscow, 115682, Russian Federation; ORCID iD 0000-0002-8813-5932.
Ekaterina V. Smolyakova — C. Sc. (Med.), Assistant Professor of the Department of Faculty Therapy and Occupational Diseases of the Medical Faculty of the N.A. Semashko Research and Educational Institute of Clinical Medicine, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; ORCID iD 0000-0002-1904-5319.
Kirill A. Zykov — Dr. Sc. (Med.), Professor of the RAS, Corresponding Member of the RAS, Head of the Department of Faculty Therapy and Occupational Diseases of the Medical Faculty of the N.A. Semashko Research and Educational Institute of Clinical Medicine, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; Deputy Director for Scientific and Innovative Work, Research Institute of Pulmonology of the Russian Federal Medical Biological Agency, Moscow; 28, Orekhovy Avenue, Moscow, 115682, Russian Federation; ORCID iD 0000-0003-3385-2632.
Contact information: Dmitry V. Peterburgsky, e-mail: kasper.piter@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 13.05.2024.
Revised 05.06.2024.
Accepted 01.07.2024.
Информация с rmj.ru