Введение
В настоящее время в развитых странах мира наблюдается рост числа пациентов с проявлениями хронического коронарного синдрома (ХКС), что ассоциируется с высокими глобальными медико-социальными рисками. Непривычный для российского врача термин «хронический коронарный синдром» вместо привычного «ишемическая болезнь сердца» (ИБС) еще в предыдущей версии клинических рекомендаций (КР) (2019) ввели эксперты Европейского кардиологического общества. Его используют для описания клинических проявлений ИБС в стабильные периоды, в том числе предшествующие развитию острого коронарного синдрома (ОКС) или следующие за ним. В связи с этим глобальное бремя хронических и острых проявлений ишемии миокарда становится значимым вызовом для систем здравоохранения ведущих стран мира. Согласно версии европейских КР по ведению пациентов с ХКС 2024 г. оптимальной стратегией менеджмента больных с проявлениями ХКС являются: максимально ранняя оценка и стратификация клинических проявлений ишемии миокарда (боль, одышка); стратификация пациентов по вероятности выявления обструктивного атеросклеротического поражения коронарных артерий на основании выявления факторов кардиоваскулярного риска; назначение нагрузочных проб или визуализирующих методик, направленных на выявление скрытой ишемии миокарда (стресс-эхокардиография (стресс-ЭхоКГ), магнитно-резонансная томография (МРТ) сердца, сцинтиграфия миокарда) или морфологических проявлений коронарного атеросклероза (мультиспиральная компьютерная томография (МСКТ) с коронарографией); назначение оптимальной медикаментозной терапии (улучшающей прогноз и качество жизни); решение вопроса о необходимости реваскуляризации миокарда [1].
В данной работе нами рассмотрены обновленные аспекты ведения пациентов с ХКС в версии КР по ХКС Европейского кардиологического общества (2024) и проанализировано, насколько эти аспекты согласуются с реальной клинической практикой в России.
Содержание статьи
Подходы к ведению пациентов с ХКС
Согласно определению Европейского общества кардиологов под ХКС подразумевается ряд клинических проявлений или синдромов, которые возникают у пациента из-за структурных и/или функциональных изменений, связанных с хроническими заболеваниями коронарных артерий, и/или микроциркуляции [1]. Термин «хронический коронарный синдром» представляется более широким в отличие от используемого российскими экспертами понятия стабильных клинических проявлений ИБС, определяемой как патологический процесс в эпикардиальных артериях с накоплением обструктивных или необструктивных атеросклеротических бляшек. Появление нового термина было обусловлено ростом за последние годы числа случаев необструктивных функциональных поражений коронарных артерий и нарушений микроциркуляторного русла как причины развития коронарной недостаточности и приступов стабильной стенокардии напряжения [2].
Все причины ишемии миокарда при ХКС можно условно разделить на эпикардиальные (структурные — атеросклероз очаговый или диффузный, интрамуральная гематома, миокардиальные мостики, коронарная аневризма), функциональные (вазоспазм в результате дисфункции эндотелия и/или гиперреактивности миоцитов, нарушение вегетативной регуляции), микроваскулярные (структурные — ремоделирование артериол, разрежение капилляров, внутрисосудистый тромбоз, периваскулярный фиброз или инфильтрация, экстрамуральное давление (гипертрофия миокарда)) и функциональные (нарушение вазодилатации, повышенная вазоконстрикция в результате дисфункции эндотелия и/или гиперреактивности миоцитов, нарушение вегетативной регуляции) [1].
Хронический коронарный синдром включает 5 вариантов клинических проявлений: 1) бессимптомный — с признаками ХКС по данным анатомических или функциональных диагностических тестов; 2) стенокардию или ишемию без обструктивного поражения коронарных артерий; 3) стенокардию напряжения или ее эквивалент с обструктивным поражением коронарных артерий; 4) стабильную фазу после перенесенных ОКС, чрескожного коронарного вмешательства (ЧКВ) или аортокоронарного шунтирования (АКШ); 5) дисфункцию левого желудочка или сердечную недостаточность ишемического генеза [1].
При подозрении на наличие у пациента ХКС (боль в грудной клетке или одышка при физической нагрузке) следует использовать пошаговый подход к диагностике.
На первом этапе врачу следует провести общую клиническую оценку состояния пациента, позволяющую дифференцировать признаки и симптомы экстракардиальных причин боли в груди и исключить неотложные состояния (ОКС, декомпенсация сердечной недостаточности или жизнеугрожающие нарушения ритма). На данном этапе проводится сбор жалоб, анамнеза, физикальное обследование, пациенту назначается биохимический анализ крови, электрокардиография (ЭКГ) в покое, рентгенография легких.
На втором этапе диагностики ХКС выполняется кардиологическое обследование с оценкой предтестовой вероятности (ПТВ) обструктивного поражения коронарных артерий, проведением ЭхоКГ в покое для исключения дисфункции миокарда левого желудочка и патологии клапанного аппарата сердца, ЭКГ с физической нагрузкой (за исключением категории пациентов с очень низкой ПТВ, <5%). Начать медикаментозное лечение уже на данном этапе и отказаться от продолжения дальнейшего обследования для подтверждения обструктивных проявлений коронарного атеросклероза возможно при наличии у пациента тяжелых сопутствующих заболеваний или ожидаемой недостаточной продолжительности жизни (например, при метастатическом онкологическом процессе).
Вероятность обструктивных проявлений ХКС, согласно КР 2024 г., оценивается по обновленной, в отличие от версии 2019 г., модели стратификации (шкала клинической вероятности обструктивной ИБС) (табл. 1).
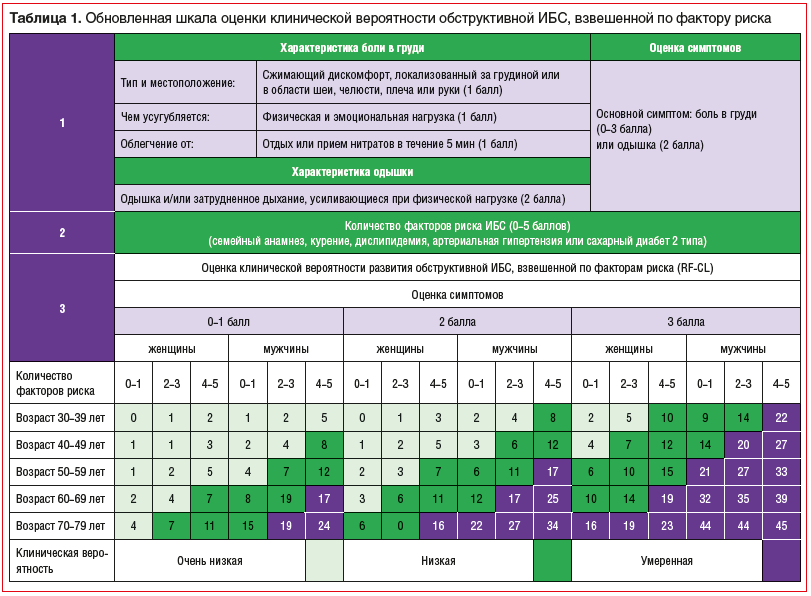
Исходно при осмотре врачом проводится оценка клинических симптомов у пациента с подозрением на ХКС. В рамках концепции ХКС неприменимо выделение типичных и атипичных проявлений стенокардии, приемлемым является подробное описание симптомов, включая потенциальные эквиваленты стенокардии. Среди симптомов, повышающих вероятность ХКС, рассматриваются: дискомфорт или боли в груди (по характеру удушающие, стягивающие, сжимающие, давящие, тянущие; по локализации загрудинные, с иррадиацией в левую руку, шею или лопатку, размером «с кулак») длительностью до 5–10 мин, вызванные физической нагрузкой или эмоциями (тревога, гнев, возбуждение), холодной погодой, обильным приемом пищи, пропадающие в течение 1–5 мин после прекращения нагрузок или при использовании препаратов нитроглицерина; одышка (затрудненное дыхание), провоцируемая физической нагрузкой и проходящая после ее прекращения.
Далее проводится учет количества факторов риска ИБС (семейный анамнез сердечно-сосудистых заболеваний, курение, дислипидемия, артериальная гипертензия и сахарный диабет (СД)) для оценки клинической вероятности развития обструктивной ИБС (в процентах) с помощью шкалы RF-CL, взвешенной по факторам риска, учитывающей пол, возраст и характер симптомов (см. табл. 1).
Следует отметить, что расчетный показатель RF-CL может быть подвергнут коррекции с учетом: отличных от нормы результатов обследования пациента, в частности при изменениях на ЭКГ в состоянии покоя (изменения зубца Q или сегмента ST/зубца T); отличных от нормы данных ЭКГ с физической нагрузкой; дисфункции левого желудочка (тяжелая или сегментарная); желудочковой аритмии; наличия заболевания периферических артерий; кальциноза коронарных артерий при проведении МСКТ грудной клетки. Низкий показатель RF-CL (>5–15%), согласно рекомендациям, может быть пересмотрен с помощью данных, оценивающих у пациента наличие коронарного кальциноза.
Третий этап подразумевает подтверждение наличия скрытой коронарной недостаточности (ишемии) и определение риска будущих нежелательных событий на основании нагрузочного тестирования. Как правило, рекомендуется проведение такой методики идентификации ишемии, которая максимально доступна в данной клинической ситуации, тут важны локальный опыт проведения таких исследований клиническим центром, доступность методики, а также предпочтения самого пациента.
Последовательность тестов первого порядка при ХКС следующая: у пациентов при очень низкой вероятности обструктивной ИБС (≤5%) не требуется дальнейшее обследование; при низкой вероятности обструктивной ИБС (>5–15%) требуется провести оценку коронарного кальция, ЭКГ с физической нагрузкой и для выявления атеросклероза в некоронарных артериях — ультразвуковое исследование брахиоцефальных артерий или артерий нижних конечностей. При низкой умеренной (>5–50%) вероятности: провести МСКТ-коронарографию для диагностики обструктивной ИБС и прогнозирования больших сердечно-сосудистых событий. При умеренной высокой (>15–85%) вероятности: провести стресс-ЭКГ, однофотонную эмиссионную компьютерную томографию или позитронную эмиссионную томографию (ПЭТ) с перфузией миокарда или МРТ сердца с перфузией. Очень высокая (>85%) вероятность обструктивной болезни коронарных артерий с высоким риском сердечно-сосудистых осложнений (наличие дисфункции левого желудочка, желудочковая аритмия или гипотония при физической нагрузке), а также при наличии тяжелой ишемии миокарда подразумевает выполнение инвазивной коронарографии с оценкой фракционного резерва кровотока.
Для подтверждения диагноза стенокардии и ишемии с необструктивными коронарными артериями используются инвазивные коронарные функциональные тесты в случае выявления необструктивной ИБС.
Следующий (четвертый) этап ведения пациента с подтвержденной ишемией и оцененной вероятностью обструктивной ИБС включает инициацию изменений образа жизни и модификацию факторов риска для улучшения дальнейшего прогноза. Кроме того, пациентам назначается медикаментозная терапия, оптимизирующая прогноз болезни, а также подбираются антиангинальные препараты с целью уменьшения симптомов ХКС. Важным звеном становится выполнение реваскуляризации, в особенности для уменьшения симптомов, рефрактерных к оптимальной лекарственной терапии, и улучшения прогноза у пациентов с высоким риском нежелательных сердечно-сосудистых осложнений (по результатам проведения нагрузочных проб или визуализационных тестов) при обструктивной ИБС.
Антиангинальные препараты, уменьшающие симптомы ХКС, рекомендуется подбирать с учетом особенностей пациента, сопутствующих заболеваний, терапии, переносимости лечения и собственно патофизиологии, лежащей в основе стенокардии, а также учитывая локальную доступность лекарств и их цену. Начальное антиангинальное лечение проводится β-адреноблокаторами (БАБ) и/или блокаторами кальциевых каналов (БКК) для контроля симптомов и частоты сердечных сокращений. Нитраты короткого действия рекомендуются как препараты выбора для немедленного облегчения симптомов стенокардии. Нитраты длительного действия или ранолазин рассматриваются в качестве дополнительной терапии при неадекватном контроле симптомов во время лечения БАБ и/или БКК, или как часть начального лечения у должным образом отобранных пациентов. Никорандил или триметазидин также могут быть использованы в дополнение к лечению БАБ и/или ББК при недостаточном контроле симптомов или как часть начального лечения у должным образом отобранных пациентов. Ивабрадин целесообразен к назначению как антиангинальное средство только у пациентов с систолической дисфункцией левого желудочка (фракция выброса <40%) и клиническими проявлениями сердечной недостаточности при неадекватном контроле симптомов или как часть начального лечения у должным образом отобранных пациентов, исключая находящихся на терапии недигидропиридиновыми БКК или другими сильными ингибиторами CYP3A4.
Прогнозоулучшающая терапия при ХКС включает антитромботические, гипотензивные, липидснижающие и противовоспалительные препараты, а также ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГТ-2) и агонисты рецепторов глюкагоноподобного пептида 1 (аГПП-1). Пациентам с ХКС и СД иНГТ-2 показаны независимо от исходного и целевого уровня гликированного гемоглобина (IA). На основании результатов исследования SELECT (более 17 тыс. пациентов) эксперты включили в КР аГПП-1 семаглутид. Его следует назначать пациентам с избыточной массой тела (индекс массы тела (ИМТ) >27 кг/м2) или ожирением без СД для снижения смертности от сердечно-сосудистых заболеваний, инфаркта миокарда или инсульта (IIaB).
У пациентов с атеросклеротическим сердечно-сосудистым заболеванием необходимо рассмотреть применение низких доз колхицина (0,5 мг/сут) для снижения риска инфаркта миокарда, инсульта и потребности в реваскуляризации миокарда (IIaA).
У пациентов с подтвержденной обструктивной ИБС без предшествующего инфаркта миокарда или реваскуляризации миокарда рекомендуется пожизненное применение в качестве антитромботического средства ацетилсалициловой кислоты (АСК) в дозе 75–100 мг/сут. После инфаркта миокарда с выполнением ЧКВ и/или АКШ рекомендуется пожизненное применение АСК в дозе 75–100 мг/сут после окончания периода двойной антитромбоцитарной терапии (ДАТТ). Сроки окончания ДАТТ определяются индивидуальным риском кровотечения.
Пациенты с перенесенным ОКС и хорошей переносимостью ДАТТ в течение 12 мес., а также пациенты без показаний к длительному приему пероральных антикоагулянтов (ПОАК) при ЧКВ, подверженные высокому ишемическому риску и невысокому риску кровотечений, совместно с АСК могут принимать клопидогрел 75 мг/сут, либо (в случае ЧКВ) прасугрел 10 мг/сут (5 мг при возрасте старше 75 лет, массе тела <60 кг), либо тикагрелор 60 мг 2 р/сут. Возможными опциями являются монотерапия тикагрелором 90 мг 2 р/сут, а также комбинация АСК и ривароксабана 2,5 мг 2 р/сут. Пациентам с ХКС и показаниями к ПОАК после неосложненного ЧКВ рекомендуется раннее прекращение приема АСК (≤1 нед.), за которым следует продолжение приема ПОАК и клопидогрела до 6 мес. у пациентов без высокого риска ишемии или до 12 мес. у пациентов с высоким риском, далее следует только прием ПОАК.
Критериями высокого ишемического риска являются: осложненная или неосложненная ИБС с поражением эпикардиальных артерий и сочетающаяся по меньшей мере с одним из признаков: СД, требующий медикаментозного лечения; рецидивирующий инфаркт миокарда в анамнезе; многососудистое поражение коронарных артерий; раннее (<45 лет) или быстропрогрессирующее (появление нового поражения в течение 2 лет) развитие коронарного атеросклероза; сопутствующее системное воспалительное заболевание; мультифокальный атеросклероз; хроническая болезнь почек со скоростью клубочковой фильтрации (СКФ) 15–59 мл/мин/1,73 м2; имплантация не менее 3 стентов; реваскуляризация не менее 3 поражений; общая длина стента >60 мм; технически сложная реваскуляризация в анамнезе (ствол левой коронарной артерии, бифуркационное стентирование с имплантацией ≥2 стентов, реканализация хронической окклюзии, стентирование последней функционирующей артерии); тромбоз стента на фоне антитромбоцитарной терапии в анамнезе. Высокий риск кровотечений определяют как: 1) перенесенное в анамнезе внутричерепное кровоизлияние, ишемический инсульт или другую внутричерепную патологию; 2) недавнее кровотечение из желудочно-кишечного тракта (ЖКТ) или анемия вследствие потери крови из ЖКТ, другая патология ЖКТ, ассоциированная с повышенным риском кровотечения; 3) печеночная недостаточность; 4) геморрагический диатез; 5) старческий возраст и синдром «хрупкости»; 6) хроническая болезнь почек, требующая диализа, или СКФ менее 15 мл/мин/1,73 м2.
Для коррекции артериальной гипертензии при ХКС предпочтительным является применение ингибиторов ангиотензинпревращающего фермента (ИАПФ) или сартанов.
Гиполипидемическая терапия при ХКС прежде всего направлена на снижение уровня холестерина липопротеинов низкой плотности (ХС-ЛПНП) до уровня <1,4 ммоль/л (55 мг/дл) и на 50% по сравнению с исходным значением. Для достижения таких показателей всем пациентам с ХКС рекомендуется прием статинов высокой интенсивности в максимально переносимой дозе, с возможностью усиления лечения комбинацией с эзетимибом и/или ингибитором PCSK9. Пациентам, имеющим непереносимость статинов, которые не достигают целевого уровня ХС-ЛПНП на фоне приема эзетимиба, рекомендуется комбинация с бемпедоевой кислотой. Также следует рассмотреть возможность применения эзетимиба с бемпедоевой кислотой у пациентов, не достигающих целевых значений ХС-ЛПНП при приеме максимально переносимой дозы статинов. При рецидивирующем атеротромботическом событии (необязательно того же типа, что и первое событие) на фоне максимально переносимой терапии статинами может быть рассмотрено снижение целевых значений ХС-ЛПНП до уровня <1,0 ммоль/л (<40 мг/дл).
Реваскуляризация миокарда при ХКС с фракцией выброса левого желудочка (ФВЛЖ) >35% рекомендована пациентам в дополнение к медикаментозной терапии при: 1) функционально значимом стенозе левой коронарной артерии для улучшения выживаемости; 2) функционально значимом трехсосудистом поражении для улучшения долгосрочной выживаемости, снижения долгосрочной сердечно-сосудистой смертности и риска спонтанного инфаркта миокарда; 3) функционально значимом одно- или двухсосудистом поражении c вовлечением проксимальных артерий нижних конечностей для снижения долгосрочной сердечно-сосудистой смертности и риска спонтанного инфаркта миокарда. При хирургически подтвержденной многососудистой ИБС с ФВЛЖ >35% рекомендована реваскуляризация методом АКШ. У отдельных пациентов при функционально значимом многососудистом поражении и ФВЛЖ >35%, имеющих высокий хирургический риск или неоперабельных, может быть рассмотрено ЧКВ как альтернатива АКШ. Оценка перипроцедурных рисков ЧКВ и его исходов осуществляется с помощью внутрисосудистого ультразвукового исследования или оптической когерентной томографии.
При значимом стенозе ствола левой коронарной артерии и низком хирургическом риске вместо медикаментозной терапии для улучшения выживаемости рекомендовано АКШ, в том числе и за счет более низкого риска спонтанного инфаркта миокарда и повторной реваскуляризации. ЧКВ используется в случаях высокого хирургического риска, когда стеноз ствола левой коронарной артерии небольшой и средней степени сложности (оценка SYNTAX 22 и 23–32 балла), а вмешательство способно обеспечить реваскуляризацию, эквивалентную полноте АКШ при меньшей инвазивности и не худшей выживаемости. Сочетание поражений левой коронарной артерии и многососудистого поражения при низком хирургическом риске, наряду с медикаментозной терапией, для улучшения выживаемости требует проведения АКШ, тогда как при высоком риске — ЧКВ.
Пациентам с ХКС и гемодинамически значимым многососудистым поражением на фоне СД при недостаточном ответе на медикаментозную терапию рекомендовано провести АКШ, тогда как выполнение ЧКВ должно рассматриваться для устранения симптомов и неблагоприятных исходов при высоком хирургическом риске. В отсутствие СД при гемодинамически значимом трехсосудистом поражении и сохраненной ФВЛЖ, а также при недостаточном ответе на медикаментозную терапию для улучшения симптомов, выживаемости и других положительных исходов рекомендовано АКШ. При низкой и средней анатомической сложности поражения ЧКВ может обеспечить такую же полноту реваскуляризации, как и АКШ, при меньшей инвазивности и не худшей выживаемости.
При ХКС с ФВЛЖ ≤35% выбор между реваскуляризацией или только медикаментозной терапией проводится после оценки кардиологической командой коронарной анатомии, сопутствующей патологии, ожидаемой продолжительности жизни, индивидуального соотношения риска и пользы с учетом мнения пациента. Информирование пациента о преимуществах, рисках, терапевтических исходах и альтернативных методах реваскуляризации проводится доступным языком, с учетом предпочтений и ожиданий пациента, медицинской осведомленности, культурных условий и социальной поддержки.
В новой версии КР по ХКС особое внимание сосредоточено на необструктивной ИБС, чаще выявляемой среди женщин: стенокардии и ишемии без обструкции коронарных артерий, также ассоциирующейся с ухудшением качества жизни пациентов, высоким риском сердечно-сосудистых событий, потребностью в проведении инвазивной коронарографии и финансовыми затратами здравоохранения. При наличии у пациента типичной клиники стенокардии без объективного подтверждения обструктивной ИБС говорят о стенокардии без обструкции коронарных артерий (ANOCA, клинико-морфологический термин), при подтверждении по данным функциональной визуализации ишемии миокарда (например, при проведении стресс-ЭхоКГ) данная форма ХКС именуется как ишемия без обструкции коронарных артерий (INOCA, функционально-морфологический термин). Распространенность ишемии без обструкции коронарных артерий составляет 10–30% от общего количества пациентов со стенокардией без обструкции коронарных артерий.
У пациентов с постоянными симптомами подтвержденной или предполагаемой стенокардии и/или ишемии без обструкции коронарных артерий для неинвазивной оценки резерва коронарного/миокардиального кровотока может быть рассмотрено проведение стресс-ЭКГ, однофотонной эмиссионной компьютерной томографии или ПЭТ с перфузией миокарда или МРТ сердца с перфузией. При подозрении на вазоспастическую стенокардию рекомендуется запись ЭКГ в 12 отведениях в покое во время приступа стенокардии. При рецидивирующих эпизодах стенокардии покоя у пациентов с подозрением на вазоспастическую стенокардию с изменениями сегмента ST, разрешающимися под действием нитратов и/или БКК, рекомендуется инвазивное коронарное функциональное тестирование для подтверждения диагноза и определения тяжести основного атеросклеротического заболевания. У лиц с подозрением на вазоспастическую стенокардию с частыми симптомами следует рассмотреть амбулаторный мониторинг сегмента ST для выявления отклонения сегмента ST во время приступа стенокардии. У пациентов с постоянными симптомами, несмотря на медикаментозное лечение, с подозрением на стенокардию и ишемию без обструкции коронарных артерий, низким качеством жизни рекомендуется проведение инвазивного коронарного функционального тестирования для выявления потенциально излечимых эндотипов и улучшения симптомов и качества жизни, учитывая выбор и предпочтения пациента.
При лечении эндотипа эндотелиальной дисфункции следует рассмотреть применение ИАПФ для контроля симптомов. Для лечения микроваскулярной стенокардии, связанной со снижением резерва коронарного/миокардиального кровотока, следует назначить БАБ для контроля симптомов. Для лечения изолированной вазоспастической стенокардии: БКК — для контроля симптомов и предотвращения ишемии и потенциально фатальных осложнений; нитраты — для предотвращения повторных эпизодов. У пациентов с признаками перекрывающихся эндотипов может быть назначена комбинированная терапия нитратами, БКК и другими вазодилататорами.
Лечение стенокардии и/или ишемии без обструкции коронарных артерий также начинается с изменения образа жизни и коррекции факторов риска (питание, физические нагрузки, контроль стресса, контроль массы тела, отказ от курения, лечение артериальной гипертензии (АГ), дислипидемии, СД). Далее назначается лечение, основанное на патофизиологических эндотипах: аномальная вазодилатация — микроваскулярный эндотип: БАБ, БКК, ранолазин, триметазидин, ивабрадин; аномальная вазоконстрикция — микроваскулярный эндотип: БКК, нитраты; эпикардиальный эндотип: БКК, нитраты, никорандил; эндотелиальная дисфункция и сопутствующий атеросклероз: ИАПФ, статины.
Далее на примере из реальной клинической практики кардиолога (г. Кемерово) у амбулаторного пациента К. 55 лет будут рассмотрены этапы диагностики и назначения терапии при подозрении на один из вариантов ХКС (ИБС в виде стенокардии напряжения с обструктивным поражением коронарных артерий). Пациентом подписано информированное добровольное согласие на публикацию данных клинического наблюдения.
Клиническое наблюдение
На прием к терапевту в поликлинику (г. Кемерово) обратился пациент К., 55 лет, работающий (управляющий банком).
Предъявляет жалобы на одышку и сжимающие боли за грудиной, иррадиирующие в левую руку и лопатку, до 5 мин длительностью на фоне физической нагрузки (подъем по лестнице на 3-й этаж, легкий бег), проходящие после ее прекращения.
Анамнез заболевания. Клиника АГ с 2019 г., максимальное повышение артериального давления (АД) 170/90 мм рт. ст., адаптирован к АД 118–120/70 мм рт. ст. Обследован, диагноз гипертонической болезни установлен. Антигипертензивная терапия регулярная (небиволол 2,5 мг и эналаприл 5 мг 2 р/сут). Эпизодически по утрам отмечает появление приступов сухого кашля без отделяемого. В течение последнего месяца отмечает эпизоды повышения АД ранним утром до 150/90 мм рт. ст., что сопровождается головной болью. Инсульты, инфаркты миокарда отрицает. Нарушений ритма и проводимости не прослеживается. Длительность описанных выше жалоб — 3 мес. При первом появлении обращался за медицинской помощью в кабинет доврачебного приема, на ЭКГ патологических изменений не выявлено, в связи с чем пациенту были разъяснены необходимые немедикаментозные принципы модификации образа жизни, даны рекомендации продолжить принимаемое лечение, обратиться в плановом порядке на консультацию к терапевту и кардиологу для дообследования. Госпитализация не предлагалась.
Анамнез жизни. Туберкулез, вирусные гепатиты, инфекции, передающиеся половым путем, отрицает. Вакцинирован от гриппа, пневмококка и новой коронавирусной инфекции. Хронические заболевания: хронический вазомоторный ринит, вне обострения; хронический гастрит, вне обострения; ожирение 1-й степени. Аллергологический анамнез не отягощен. Гемотрансфузий не проводилось. Травмы и операции отрицает. Курит. Алкоголь употребляет 1 раз в 3 мес. Имеет отягощенный ранний наследственный анамнез по сердечно-сосудистой патологии (с 50 лет ИБС у отца, с 55 лет гипертоническая болезнь у матери).
Физикальный статус. Состояние ближе к удовлетворительному. Сознание ясное. Кожные покровы и слизистые оболочки чистые, физиологической окраски, умеренной влажности. Отеков нет. Рост 184 см, масса тела 110 кг, ИМТ 32,5 кг/м2. Нормотермия. Дыхание везикулярное, хрипов нет. Частота дыхательных движений 15 в 1 мин. Тоны сердца ясные, ритмичные, шумов нет. Частота сердечных сокращений (ЧСС) 82 в 1 мин. АД 145/85 мм рт. ст. Живот мягкий, безболезненный во всех отделах. Стул регулярный, оформленный. Область почек не изменена. Симптом поколачивания отрицателен с двух сторон. Диурез свободный, адекватен гидратации.
Пациент с подозрением на ИБС был направлен на консультацию к кардиологу без оценки предтестовой или клинической вероятности ИБС, с предварительным диагнозом: ИБС. Стенокардия?
Осмотрен амбулаторным кардиологом. Оценена ПТВ ИБС для мужчины 55 лет с типичной клиникой стенокардии — 32% (умеренная, требуется дообследование, согласно КР ХКС Европейского кардиологического общества 2019 г. и КР «Стабильная ишемическая болезнь сердца» Минздрава России в версиях 2020 и 2024 гг. (табл. 2).
![Таблица 2. Предтестовая вероятность диагноза ИБС (%) [3] Таблица 2. Предтестовая вероятность диагноза ИБС (%) [3]](https://medblog.su/wp-content/uploads/2025/01/1737145970_721_Novoe-v-vedenii-patsientov-s-hronicheskimi-koronarnymi-sindromami-kratkij-obzor.png)
Предварительно кардиологом выставлен диагноз: основное заболевание — ИБС. Стенокардия напряжения, функциональный класс 2 по Канадской классификации.
Фоновые заболевания: гипертоническая болезнь III стадии, риск 4, неконтролируемая АГ. Целевой уровень АД <130/80 мм рт. cт. Ожирение 1-й степени.
Сопутствующие заболевания: хронический гастрит, вне обострения.
Учитывая ПТВ 32%, умеренную для мужчины 55 лет с типичным болевым синдромом в груди, рассчитанную согласно действующим в России КР по ведению таких пациентов [3], наличие факторов риска (ранний семейный анамнез, курение, дислипидемия и гипертоническая болезнь), кардиолог рекомендовала пациенту выполнение стресс-ЭхоКГ для подтверждения наличия коронарной недостаточности (ишемии) и стратификации риска осложнений.
До точной верификации диагноза и проведения рекомендованных обследований пациенту было назначено следующее лечение:
АСК (желудочнорастворимая форма, Кардиомагнил) 75 мг утром;
бисопролол 5 мг утром;
азилсартана медоксомил (Эдарби®) 40 мг утром (с учетом неконтролируемой артериальной гипертонии и наличия эпизодов сухого кашля на фоне приема эналаприла);
аторвастатин 40 мг + эзетимиб 10 мг на ночь.
Следует отметить, что пациенту со значимой ПТВ и диагнозом «ИБС, стабильная стенокардия» была немедленно инициирована лекарственная терапия, оптимизирующая прогноз.
Пациенту разъяснена потребность в комплексном изменении режима питания для снижения массы тела, коррекции дислипидемии и уровня триглицеридов (ограничение суточной калорийности, увеличение потребления фруктов, овощей, цельнозерновых продуктов, бобовых и злаков, диетической молочной продукции, мяса, рыбы; ограничение употребления поваренной соли до 5 г в сутки, жирного, жареного, копченого, продуктов быстрого приготовления, сладостей и кондитерских изделий; отказ от алкоголя). Были даны советы по увеличению физической активности минимум до 2–3 занятий в неделю длительностью более 45 мин, рекомендованы аэробные тренировки (скандинавская ходьба, дозированная ходьба, езда на велосипеде, ходьба на лыжах, плавание, танцы). Пациенту разъяснена необходимость отказа от курения и представлены возможные способы борьбы с никотиновой зависимостью.
Назначено дообследование, результаты которого кардиолог получил через 3 нед. Пациент на фоне назначенного лечения отметил значительное улучшение симптоматики. При повторном осмотре кардиологом на фоне лечения коронарные боли отмечает не чаще 1 раза в месяц, уменьшилась одышка при физической активности, на фоне лечения скомпенсировано АД — 118/70 мм рт. ст., ЧСС в покое составила 60 в 1 мин.
Результаты дообследования:
Лабораторно: общий анализ крови и мочи, коагулограмма — без особенностей. Из значимых изменений в биохимическом анализе крови — дислипидемия (ХС-ЛПНП 3,68 ммоль/л, триглицериды 1,6 ммоль/л, общий холестерин 5,5 ммоль/л), гликемия 5,9 ммоль/л.
По ЭКГ в покое: ритм синусовый, 75 уд/мин, нормальное положение электрической оси сердца, выраженных обменно-трофических изменений миокарда, нарушений ритма и проводимости не выявлено.
Рентгенография органов грудной клетки не выявила данных за очаговые и инфильтративные образования, травматические повреждения.
Нарушений дыхания по рестриктивному и обструктивному типу по функции внешнего дыхания не определяется.
По ЭхоКГ ФВЛЖ 60%, клапаны не изменены, имеются признаки гипертрофии межжелудочковой перегородки 1,2 см, перикард без особенностей, четких нарушений локальной сократимости миокарда не прослеживается.
По данным велоэргометрии, которая проводилась на фоне отмены БАБ, выявлена выраженная гипертоническая реакция АД, нагрузочная проба прекращена ввиду развития изменений зубца Т (выраженно отрицательный) по передней стенке с развитием у пациента дискомфорта в груди, прошедшие при прекращении физической активности в период восстановления. Проба расценена как положительная в отношении ишемии миокарда.
Дуплексное сканирование брахиоцефальных артерий выявило признаки гипоплазии правой позвоночной артерии.
Дуплексное сканирование артерий нижних конечностей данных за атеросклеротическое поражение не выявило.
В динамике через 6 нед. отмечается улучшение липидограммы: ХС-ЛПНП 1,4 ммоль/л, триглицериды 1,3 ммоль/л, общий холестерин 2,6 ммоль/л, холестерин липопротеинов высокой плотности 1,2 ммоль/л.
Пациенту рекомендовано проходить ежегодный осмотр кардиолога, проведение велоэргометрии для оценки эффективности назначенной медикаментозной терапии.
Обсуждение
Назначенная пациенту медикаментозная терапия оценивается как эффективная в отношении профилактики приступов стенокардии. На фоне оптимальной на данный момент медикаментозной терапии показаний к проведению инвазивной коронарографии нет. Пациенту в плановом порядке рекомендовано проведение МСКТ-коронарографии в течение 1 года либо при выявлении признаков ишемии миокарда по данным велоэргометрии без отмены антиангинальной терапии.
Назначенная кардиологом гиполипидемическая, гипотензивная и антиангинальная терапия полностью укладывается в отечественные и европейские рекомендации [1, 3].
Следует обратить внимание на особенности антитромботической терапии. Так, представленный амбулаторный пациент с ИБС получает монотерапию АСК в связи с невысоким ишемическим и геморрагическим риском. Выбранная кардиологом желудочнорастворимая (буферная) форма АСК с минимально возможной дозой 75 мг является максимально безопасной в отношении реализации рисков кровотечений по сравнению с препаратами ингибиторов P2Y12 рецепторов тромбоцитов и предпочтительной по сравнению с кишечнорастворимой формой ввиду более высокой биодоступности [4–6]. Российские и зарубежные исследования показали большую эффективность формы АСК, всасывающейся в желудке, по сравнению с препаратом АСК, всасывающимся в кишечнике, в том числе в отношении снижения вероятности развития инфаркта миокарда, инсульта и сердечно-сосудистой смерти [7–10]. Преимущества рекомендованной кардиологом формы препарата обусловлены тем, что содержащийся в составе гидроксид магния способствует нейтрализации добавочной кислотности от АСК в желудке и за счет создания липофильного микроокружения для частиц АСК уменьшает время контакта со слизистой оболочкой, способствуя быстрому и относительно полному всасыванию через билипидный слой мембран клеток в кровоток [11–13]. В связи с этим желудочнорастворимая (буферная) АСК может равноценно применяться как при острых состояниях с потребностью в быстром антиагрегантном эффекте, так и в терапии хронических атеросклеротических заболеваний, в том числе в уязвимых группах (СД, сердечная недостаточность) [14]. Согласно новым отечественным КР показаны преимущества назначения желудочнорастворимой формы АСК пациентам с ИМТ >35 кг/м2 или массой тела >120 кг, поскольку кишечнорастворимые формы имеют сниженную биодоступность и худшую абсорбцию, что может привести к неадекватному ингибированию тромбоцитов [15].
В настоящее время наблюдается низкая частота назначения АСК у пациентов с ИБС [9]. Согласно анализу данных амбулаторных карт при стабильной ИБС только 46% кардиологов и 39% терапевтов инициируют терапию АСК, такая частота совпадает с результатами регистра РЕКВАЗА [16]. При этом половина пациентов, получивших АСК, досрочно прекращают лечение в результате развития побочных явлений (чаще связанных с влиянием на слизистую оболочку ЖКТ), делая это по собственному убеждению в ее небезопасности, а не по медицинским противопоказаниям [17]. Следует отметить, что подобное несоблюдение режима приема или отмена АСК сопряжены с плохим прогнозом. Так, к примеру, пациенты регистра SWEDEHEART, отказавшиеся от приема АСК в рамках первичной профилактики, имели на 28% выше риск развития сердечно-сосудистых событий в течение 3 лет, при вторичной — на 46% [18]. Согласно данным метаанализа ряда исследований отказ от приема АСК при ИБС повышает риск кардиоваскулярных осложнений в 3 раза, а при наличии стентов — в десятки раз [19].
В связи с этим прием АСК в дозе 75 мг в буферной форме с сопутствующей минимизацией лекарственных взаимодействий (ПОАК и/или ингибиторов P2Y12 рецепторов тромбоцитов, стероидных и нестероидных противовоспалительных препаратов), наряду с назначением ингибиторов протонной помпы пациентам из категории риска (пожилой возраст, анамнез кровотечения из ЖКТ и/или хеликобактерная инфекция), позволит повысить приверженность антитромботическому лечению при ИБС [20–23].
Заключение
Пациенты с такими симптомами, как боль в груди и/или одышка, при наличии факторов сердечно-сосудистого риска остаются группой особого внимания в отношении подозрения на различные клинические варианты ХКС/ИБС, что постулировано обновленной системой клинической оценки ПТВ обструктивной ИБС в европейских КР по ведению ХКС. Уже на этапе предварительного диагноза ИБС при типичных проявлениях стенокардии в сочетании со значимой предтестовой/клинической вероятностью наличия ИБС, несколькими факторами кардиоваскулярного риска необходимо инициировать терапию, улучшающую прогноз при ИБС, а также назначить антиангинальные препараты для профилактики приступов коронарной недостаточности. Обоснованным выбором при инициации антитромботической терапии является назначение АСК в желудочнорастворимой (буферной) форме, в дозе 75 мг с позиции эффективности в силу большей биодоступности, а также безопасности в отношении риска развития желудочно-кишечных кровотечений.
Работа выполнена в рамках фундаментальной темы НИИ КПССЗ «Разработка инновационных моделей управления риском развития болезней системы кровообращения с учетом коморбидности на основе изучения фундаментальных, клинических, эпидемиологических механизмов и организационных технологий медицинской помощи в условиях промышленного региона Сибири (0419-2022-0002)».
Статья подготовлена при поддержке АО «Нижфарм». Мнение авторов может не совпадать с мнением компании.
Информация с rmj.ru





