Введение
Инфекции дыхательных путей остаются основной причиной заболеваемости и смертности во всем мире. По оценкам Всемирной организации здравоохранения, ежегодно от острых респираторных инфекций (ОРИ) погибают 4 млн человек, среди которых большинство составляют младенцы и дети1 [1, 2]. Это в еще большей степени усугубляется сочетанным поражением респираторного тракта возбудителями вирусной и бактериальной этиологии. Еще в 1918 г. была зарегистрирована высокая заболеваемость вследствие развития пневмонии, вызванной бактериальной инфекцией [3], и аналогичное явление наблюдалось во время недавней пандемии COVID-19, когда вторичная бактериальная инфекция усугубила состояние, вызванное коронавирусом тяжелого острого респираторного синдрома (SARS-CoV-2) [4].
Взаимодействие респираторных вирусов и бактерий предрасполагает к бактериальным суперинфекциям, приводящим к тяжелым заболеваниям, и эти взаимодействия могут влиять на микробный патогенез, включая усиление бактериальной адгезии, повышение стабильности вирусов и модуляцию иммунного ответа со стороны одного микроба в пользу другого [5, 6]. Было установлено, что бактериальная инфекция также модулирует вирусные инфекции, усугубляя течение болезни [7–9].
Понимание механизмов взаимодействия возбудителей инфекций поможет глубже понять закономерности сочетанного инфекционного процесса, особенности клинической картины, характер течения [10, 11].
Содержание статьи
Взаимодействие бактерий и вирусов при инфекциях человека
Вирусы и бактерии могут взаимодействовать прямо или косвенно при инфицировании человека, и взаимодействие между ними может быть как положительным, так и отрицательным [12]. Процессы, определяющие синергию между вирусом и бактериями, сложны и многогранны, при этом любое нарушение иммунных реакций на каждом из этапов будет способствовать более тяжелому и затяжному течению инфекции с большим количеством осложнений. В таблице представлены механизмы развития бактериальных осложнений, следующих за вирусной инфекцией.
Механизмы, с помощью которых вирус способствует усилению бактериальной инвазии
Многочисленные исследования демонстрируют, что предшествующая вирусная инфекция усиливает адгезию бактерий к клеткам-хозяевам. A. Håkansson et al. [5] было замечено, что у детей с острым средним отитом предшествующее заражение аденовирусом 1, 2, 3 и 5-го типов значительно усиливает колонизацию пневмококками. O.R. El Ahmer et al. [6] показали, что эпителиальные клетки, инфицированные вирусом гриппа, увеличивают адгезию Streptococcus pneumoniае, Haemophilus influenzае и Moraxella catarrhalis. Индуцируемая вирусом бактериальная адгезия достигается с помощью нескольких механизмов, которые представлены на рисунке 1.
![Рис. 1. Усиление бактериальной колонизации при вирусной инфекции [1] Fig. 1. Elevation of bacterial colonization by viral infection [1] Рис. 1. Усиление бактериальной колонизации при вирусной инфекции [1] Fig. 1. Elevation of bacterial colonization by viral infection [1]](https://medblog.su/wp-content/uploads/2025/01/Ostrye-respiratornye-infektsii-u-podrostkov-i-vzroslyh-vzaimodejstvie-vozbuditelej-strategiya.png)
Одним из наиболее хорошо изученных механизмов является вызванное вирусом гриппа снижение выработки и функции альвеолярных макрофагов (см. рис. 1, H), способствующее последующей бактериальной инфекции [15, 23]. Было обнаружено, что инфекция, вызванная респираторно-синцитиальным вирусом (respiratory syncytial virus, RSV), вызывает дисфункцию нейтрофилов за счет снижения окислительного взрыва и стимулирования апоптоза нейтрофилов, повышая адгезию Staphylococcus aureus или Pseudomonas aeruginosa [16]. Вирус гриппа также изменяет функции моноцитов, подавляя надлежащий иммунный ответ и снижая активность и синтез цитокинов, что приводит к увеличению бактериальной колонизации и риска смерти [1]. C.L. Small et al. [17] обнаружили, что гриппозная инфекция повышает восприимчивость к S. aureus за счет снижения продукции натуральных киллеров (natural killer, NK), индуцируемой фактором некроза опухолей (tumor necrosis factor α, TNF-α) и ухудшения активации NK-клеток.
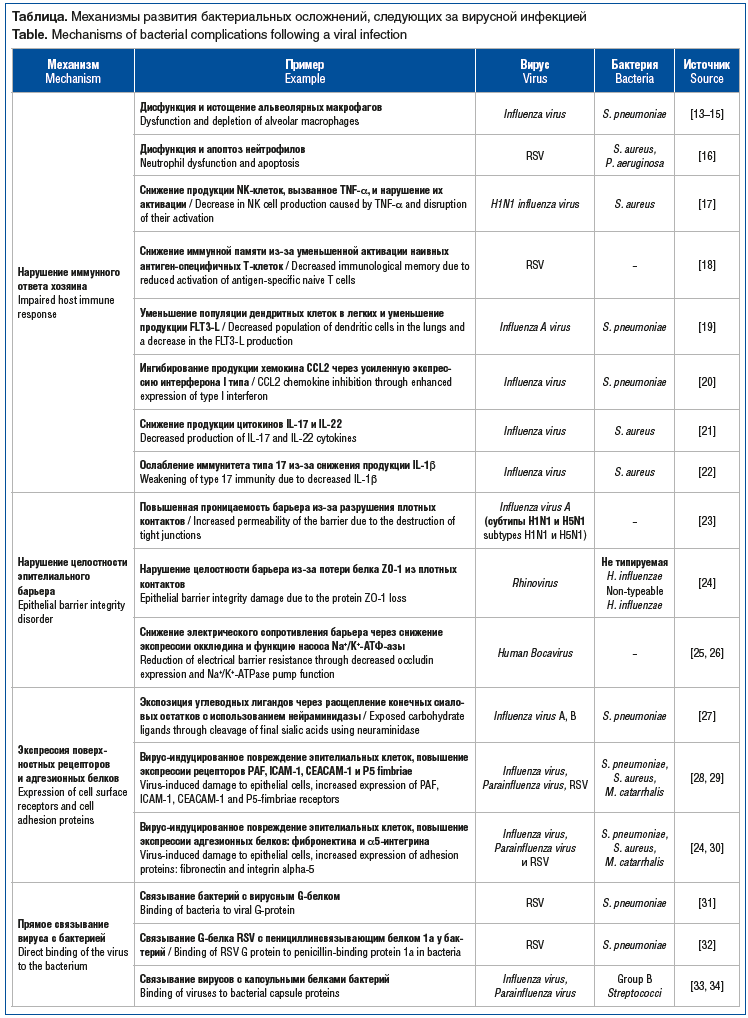
Было установлено, что вирус гриппа подавляет выработку провоспалительных цитокинов, таких как IL-1β, IL-6 и TNF-α, что приводит к снижению бактериального клиренса. S. Nakamura et al. [20] обнаружили, что вирус гриппа ингибирует выработку хемокина CCL2, ответственного за выведение бактерий, за счет повышенной экспрессии интерферона (interferon, IFN) I типа, способствуя таким образом колонизации пневмококками. K.M. Robinson et al. [22] установили, что грипп усугубляет инфекцию S. aureus за счет снижения выработки IL-1β. В исследовании A. Kudva et al. [21] показано, что у мышей, инфицированных вирусом гриппа и S. aureus, наблюдалось значительное снижение продукции цитокинов IL-17 и IL-22. Высвобождение цитокинов на стадии острого воспаления, как было обнаружено, способно усиливать рост бактерий и продлевать бактериальную инфекцию [41].
При вирусной инфекции имеет место повреждение эпителиально-эндотелиального барьера (см. рис. 1, В), при этом снижение регуляции соединительных белков в результате провоспалительной реакции организма-хозяина против вируса приводит к нарушению целостности барьера, повышению проницаемости мембран и снижению трансбарьерного электрического сопротивления [42], что увеличивает проницаемость молекул в эпителиальных клетках дыхательных путей, облегчая проникновение и трансмиграцию бактерий в дыхательные пути [23]. Было обнаружено, что заражение бокавирусом человека снижает трансбарьерное электрическое сопротивление за счет снижения экспрессии окклюдина и снижения функции Na+/K+ АТФ-азы [25, 26].
Вирусы способствуют адгезии бактерий (см. рис. 1, D), воздействуя на рецепторы клеточной поверхности эпителиальных клеток. Вирусы гриппа А и В воздействуют на углеводные лиганды эпителиальных клеток путем отщепления остатков сиаловой кислоты с помощью нейраминидазы, которые в дальнейшем оказываются местом связывания для S. pneumoniae [30, 43]. В результате воспалительной реакции на вирусы гриппа, парагриппа и RSV происходит повреждение эпителия, что приводит к увеличению экспрессии рецепторов клеточной поверхности, таких как рецептор фактора, активирующего тромбоциты (PAFr), молекула клеточной адгезии-1 (ICAM-1), которая служит рецептором для бактерий [27–29]. Патогенные бактерии, такие как S. pneumoniae, S. aureus и M. catarrhalis, могут прочно связываться с фибронектином и α5-интегрином, которые активируются после вирус-индуцированного повреждения клеток [24]. Вирусы также вызывают адгезию бактерий за счет повышенной экспрессии белков вирусной поверхности — рецепторов для бактерий [1].
Роль вирусных гликопротеинов и поверхностных рецепторов в обеспечении адгезии бактерий хорошо известна, что объясняет повышенную адгезию к инфицированным вирусом клеткам, но не полностью объясняет повышенную адгезию бактерий к неинфицированным клеткам. Показано, что вирусы напрямую связываются с поверхностными белками бактерий (см. рис. 1, С), образуя вирусно-бактериальный комплекс, который может поражать как неинфицированные, так и инфицированные клетки [1]. J.M. Hament et al. [31] обнаружили, что G-белок, продуцируемый RSV, облегчает связывание с S. pneumoniae, после чего адгезия пневмококка к неинфицированным эпителиальным клеткам значительно повышается. Вирусы гриппа и парагриппа распознают капсульные полисахариды, экспрессируемые стрептококками группы B, и связываются с бактериями, усиливая их адгезию [33, 34]. S. Okamoto et al. [44] обнаружили, что вирус гриппа может связываться с инкапсулированными стрептококками группы А, способствуя адгезии бактерий к инфицированным вирусом альвеолярным эпителиальным клеткам.
Многие иммунные клетки нуждаются в специфических питательных веществах для обеспечения своей иммунной функции при активации, поэтому доступность метаболитов и питательных веществ в легких, независимо от того, вырабатываются ли они хозяином или микробиотой, вероятно, играет решающую роль в прогрессировании заболевания легких.
Питательный иммунитет классически определяется как связывание микроэлементов, в первую очередь железа, организмом-хозяином с целью блокирования бактериального захвата металлов и, таким образом, ограничения прогрессирования заболевания во время инфекции (см. рис. 1, G). Установлено, что вирус гриппа снижает выработку железа, липокалина-2, подавляя активацию ядерного фактора κB (nuclear factor-κB, NF-κB) и экспрессию IL-1β, повышает доступность сиаловой кислоты и сиалированного муцина в организме-хозяине, стимулируя рост пневмококков в дыхательных путях [34, 35]. RSV повышает концентрацию железа в организме-хозяине, способствуя образованию биопленки P. aeruginosa [36].
Вирусные инфекции могут значительно влиять на формирование и дисперсию бактериальной биопленки, что усиливает инвазивный потенциал бактерий и способствует прогрессированию заболеваний (см. рис. 1, F). Вирус гриппа повреждает эпителиальный барьер дыхательных путей, что облегчает колонизацию бактериями, такими как S. pneumoniae. Вирус снижает мукоцилиарный клиренс, ослабляет иммунные механизмы и способствует адгезии бактерий к эпителию. S. pneumoniae, находясь в биопленке, может переходить от состояния колонизации к инвазивной фазе, вызывая пневмонию или другие вторичные инфекции [45]. RSV приводит к значительному (почти в 2000 раз) увеличению количества колоний P. aeruginosa in vivо в гомогенатах легких по сравнению с результатами мономикробной инфекции [46]. Герпесвирусы, такие как вирус простого герпеса или вирус Эпштейна — Барр, могут создавать благоприятные условия для формирования биопленки бактерий, таких как S. aureus. Эти вирусы изменяют иммунный ответ организма, подавляя активацию макрофагов и нейтрофилов, что способствует выживанию бактерий в биопленке [47].
Механизмы, с помощью которых бактерии способствуют вирусной инвазии
Было проведено множество исследований, посвященных роли бактерий в патогенезе вирусных инфекций, которые дали разнообразные результаты. Некоторые исследования показали, что бактериальная инфекция может оказывать негативное влияние на выживаемость и рост вирусов [48]; однако большинство работ продемонстрировали положительную корреляцию между присутствием бактерий и вирусной активностью [49, 50].
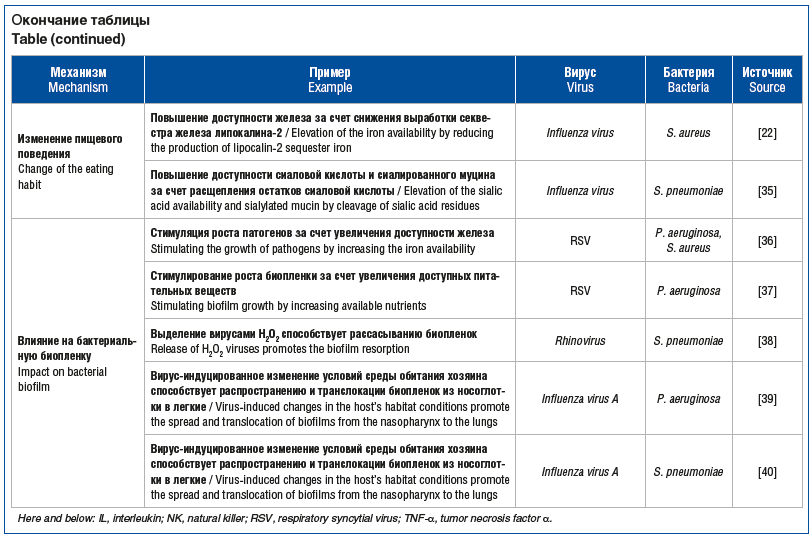
Опосредованная бактериями активация вирусных инфекций достигается в основном за счет влияния бактерий на организм-хозяина и его иммунную систему, а также за счет их прямого воздействия на сам вирус (рис. 2). N.J. Verkaik et al. [7] обнаружили, что воздействие S. pneumoniae связано с повышенной вероятностью сероконверсии к метапневмовирусу человека (human metapneumovirus, hMPV), что указывает на увеличение частоты инфицирования этим вирусом. В экспериментах in vitro также было продемонстрировано, что клетки, предварительно инфицированные S. pneumoniae, становятся более уязвимыми к последующей инфекции hMPV. Эти данные показывают, что S. pneumoniae может усиливать восприимчивость к hMPV-инфекции, что подчеркивает важность бактериально-вирусных взаимодействий в патогенезе респираторных инфекций. В исследовании D.T. Nguyen et al. [9] продемонстрировано, что S. pneumoniae усиливает инфекцию RSV как in vitro, так и in vivo. Авторы показали, что наличие S. pneumoniae приводит к увеличению вирусной нагрузки и ухудшению клинических симптомов у мышей, инфицированных RSV. В клеточных культурах инфекция S. pneumoniae также способствовала увеличению репликации RSV.
![Рис. 2. Механизмы, с помощью которых бактерии способствуют вирусной инвазии [1] Fig. 2. Mechanisms by which bacteria promote viral invasion [1] Рис. 2. Механизмы, с помощью которых бактерии способствуют вирусной инвазии [1] Fig. 2. Mechanisms by which bacteria promote viral invasion [1]](https://medblog.su/wp-content/uploads/2025/01/1737146031_50_Ostrye-respiratornye-infektsii-u-podrostkov-i-vzroslyh-vzaimodejstvie-vozbuditelej-strategiya.png)
L.K. Blevins et al. [49] показали, что предшествующая инфекция S. pneumoniae значительно снизила уровень антивирусной популяции CD8+ Т-клеток в легких, что привело к увеличению численности вируса гриппа А и повышению смертности. На мышиной модели Y. Wu et al. [50] также обнаружили, что вторичная инфекция S. pneumoniae значительно повышает титры вирусов и снижает концентрацию IgA, IgM и IgG, которые являются вирусспецифическими антителами. Они также обнаружили снижение популяции иммунных клеток, таких как CD4 T-клетки, B-клетки и плазматические клетки, что способствовало выживанию вируса в организме-хозяине (см. рис. 2, D) [1].
Бактерии также участвуют в повышении регуляции поверхностного белка в результате изменения иммунного ответа (см. рис. 2, A). U.S. Sajjan et al. [24] обнаружили, что инфекция H. influenzae увеличивает экспрессию внутриклеточных молекул адгезии, таких как ICAM-1 и толл-подобные рецепторы (toll-like receptors, TLR) 3, что приводит к усилению инфекции, вызванной риновирусом, и последующему увеличению выброса цитокинов под влиянием риновируса. Аналогичные результаты были получены F. Gulraiz et al. [51], которые обнаружили, что предшествующая инфекция нетипируемой H. influenzae резко увеличивает связывание человеческого риновируса HRV16 с двумя линиями бронхиальных эпителиальных клеток pBECs и BEAS-2B, скорее всего, за счет повышения уровня ICAM-1.
Различные компоненты бактерий способствуют прикреплению вирусов и инфицированию ими. Было установлено, что протеазы, продуцируемые S. aureus, усиливают репликацию различных штаммов гриппа в легких путем расщепления и активации вирусного гемагглютинина (см. рис. 2, C). Активация гемагглютинина зависит от штамма, т. е. протеазы, продуцируемые одной бактерией, действуют только на определенные штаммы вирусов.
Активаторы плазминогена S. aureus и S. pneumoniae, такие как стафилокиназа и стрептокиназа, могут генерировать фибринолитические протеазы, которые способны расщеплять гемагглютинин вируса гриппа H1N1 [52]. T. Nishikawa et al. [53] обнаружили, что нейраминидаза, выделяемая S. pneumoniae, может способствовать успешному высвобождению вирионов даже после ингибирования вирусной нейраминидазы (см. рис. 2, B). Помимо расщепления вирусных белков, бактериальные пептиды усиливают вирусную инфекцию за счет прямого связывания с вирусом. Было обнаружено, что синтетический бактериальный липопептид Pam3CSK4 усиливает инфицирование первичных эпителиальных, лимфоидных и миелоидных клеток RSV, вирусом кори, ВИЧ-1 и метапневмовирусом человека независимо от активации TLR. Pam3CSK4 содержит две важные катионные структуры, N-пальмитоилированный цистеин и катионную последовательность SK4, которые могут напрямую взаимодействовать с отрицательно заряженными структурами вирусной оболочки или клеток-хозяев, усиливая вирусную инфекцию [54].
Особенности микробиоты дыхательных путей
Дыхательные пути человека населены сложным микробным сообществом, состоящим из комменсальных и условно-патогенных микроорганизмов, наиболее распространенными из которых являются такие бактерии, как S. aureus, S. pneumoniae и M. catarrhalis, наряду с вирусами гриппа, риновирусами, SARS-CoV-2 и др. [55]. Между этими патогенами существует синергическое и конкурентное взаимодействие. Как правило, микробиота дыхательных путей не причиняет вреда организму, и между формальной микрофлорой и комменсальными и условно-патогенными микроорганизмами существует гомеостаз. Однако изменения или дисбиоз в этом сообществе могут привести к попаданию бактериальных или вирусных патогенов и вытеснению условно-патогенных микроорганизмов вредными патогенами, что приводит к патогенной инвазии. Респираторные вирусы, такие как грипп, риновирус и SARS-CoV-2, могут обусловливать бактериальные суперинфекции, вызывая появление условно-патогенных бактерий в дыхательных путях. В результате бактериальных коинфекций наблюдается рост заболеваемости, а впоследствии и значительно возрастает смертность среди пациентов с вирусными инфекциями.
Особенности терапии ОРИ
Актуальные подходы к лечению ОРИ стремятся исключить профилактическое использование антибиотиков. Тем не менее в амбулаторной практике системные антибактериальные препараты продолжают часто назначаться рутинно и без достаточных оснований.
Научный интерес к изучению механизмов, благодаря которым иммунная система человека борется с инфекционными возбудителями, в последние годы нарастает. Современные исследования в этой области охватывают широкий спектр вопросов, включая распознавание патогенов, активацию врожденного и адаптивного иммунного ответа, механизмы воспаления, а также роли различных клеток и молекул в иммунной защите, что позволяет не только раскрыть тайны функционирования иммунной системы, но и найти новые подходы к лечению инфекционных заболеваний.
Ряд значимых открытий в области иммунологии были удостоены Нобелевских премий. В 2011 г. одним из важнейших стало исследование системы врожденного иммунитета и роль паттерн-распознающих рецепторов (pattern recognition receptor, PRR), TLR. Исследования Брюса Бойтлера и Жюля Хоффмана показали, как PRR распознают общие молекулярные структуры патогенов и запускают воспалительный ответ. Эти открытия помогли глубже понять первые шаги иммунного ответа на инфекцию, а также послужили основой для новых подходов к разработке противоинфекционных и противоопухолевых вакцин [56]. Впоследствии целый ряд работ был направлен на изучение возможных механизмов воздействия на работу белков главного комплекса гистосовместимости (MHC)с целью терапии инфекционных заболеваний, преимущественно процесса презентации антигена в иммунном синапсе и регуляции этого процесса с целью создания вакцин нового поколения [57–63].
Результатом отечественных научных разработок в этой области является инновационный препарат Рафамин, разработанный компанией ООО «НПФ «Материа Медика Холдинг» (ООО НПФ ММХ), который содержит технологически обработанные антитела к молекулам и рецепторам, играющим ведущую роль в запуске и реализации противоинфекционного иммунного ответа: IFN-γ, CD4, доменам главного комплекса гистосовместимости β2-МНС класса I и β1-МНС класса II2. Согласно общей фармакопейной статье от 2023 г. относится к группе биологических препаратов, произведенных по градуальной технологии с применением последовательного снижения концентрации исходного вещества при одновременном физическом воздействии3. За счет таргетного воздействия на молекулы MHC и CD4-рецептор данный препарат улучшает распознавание вирусов и бактерий в иммунном синапсе, что приводит к запуску последующей цепочки реакций по уничтожению патогена в рамках реализации адаптивного иммунного ответа. Данный препарат, регулируя активность INF-γ за счет изменения конформации молекулы этого цитокина, повышает специфическое связывание INF-γ со своим рецептором, что способствует активации INF-γ-зависимых генов, ответственных за продукцию специфических противовирусных белков, которые останавливают размножение вирусов и защищают здоровые клетки от заражения, а также модуляции активности иммунных клеток, участвующих в борьбе с вирусами и бактериями.
Рафамин обладает противовирусной, иммунотропной, антибактериальной и противовоспалительной активностью. В экспериментах in vivo было показано, что препарат повышает выживаемость животных на 40% при вирусно-бактериальной пневмонии, вызванной вирусом гриппа и S. aureus [64]. На модели сальмонеллезной инфекции совместное применение данного препарата с ципрофлоксацином обеспечивало снижение бактериальной нагрузки: индекс антимикробной активности под действием препарата увеличился в 4 и 7,7 раза в печени и кишечнике соответственно [65]. При использовании данного препарата в лечебном и лечебно-профилактическом режимах в краткосрочном периоде наблюдения приводит к активации иммунного ответа, опосредованной повышением содержания Т-лимфоцитов [66].
Согласно недавно опубликованным результатам многоцентрового двойного слепого плацебо-контролируемого рандомизированного исследования, применение препарата Рафамин у детей с острыми респираторными вирусными инфекциями (ОРВИ) сокращало на сутки время до разрешения всех симптомов заболевания, приводило к увеличению доли выздоровевших пациентов на 2–3-й день терапии и сопровождалось хорошим профилем безопасности [67]. В исследование было включено 420 пациентов в возрасте от 12 до 18 лет с клинически диагностированной ОРВИ. Методом полимеразной цепной реакции респираторные вирусы были подтверждены у 122 участников, получавших исследуемый препарат, и у 107 участников, получавших плацебо. Среднее значение времени до разрешения симптомов ОРВИ в группе исследуемого препарата составило 3,3±1,7 сут против 4,4±2,6 сут в группе плацебо, разница между группами составила 1,09 сут (р<0,001). К 3-му дню терапии доля пациентов с отсутствием симптомов заболевания на фоне терапии исследуемым препаратом достигла 30%, что значительно превышало аналогичный показатель в группе плацебо (15%, р<0,05). Исследуемый препарат хорошо переносился, не приводил к развитию нежелательных явлений, определенно связанных с препаратом, и сочетался с другими лекарственными средствами, что подтверждает его безопасность у детей исследуемой возрастной группы.
Результаты исследований [64–70] позволяют рассматривать Рафамин в качестве перспективного препарата для лечения пациентов с ОРИ, в том числе входящих в группу риска осложненного течения вирусной инфекции вследствие недостаточности иммунного ответа.
Заключение
С приходом COVID-19 наблюдается новый всплеск интереса к изучению взаимосвязи между респираторными бактериями и вирусом. Поскольку сочетанная инфекция, вызываемая вирусно-бактериальной ассоциацией, может усугублять течение инфекции и даже усиливать вторичные инфекции, которые не были диагностированы, и для борьбы с ней необходима эффективная терапевтическая стратегия. Действие иммунотропных препаратов, применяемых для лечения и профилактики ОРИ, направлено на активацию и усиление иммунного ответа организма в борьбе с инфекционными патогенами. Иммунотропные препараты являются важным инструментом в поддержании и укреплении защитных функций организма. Результаты ряда исследований позволяют рассматривать Рафамин в качестве перспективного препарата для лечения пациентов с ОРИ.
Сведения об авторах:
Каннер Екатерина Валерьевна — д.м.н., старший научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0003-3204-1846
Каннер Илья Дмитриевич — аспирант ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0003-4632-0547
Максимов Максим Леонидович — д.м.н., декан факультета профилактической медицины и организации здравоохранения ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1; главный внештатный специалист — клинический фармаколог Министерства здравоохранения Республики Татарстан, заведующий кафедрой клинической фармакологии и фармакотерапии КГМА — филиала ФГБОУ ДПО РМАНПО; 420012, Россия, г. Казань, ул. Бутлерова, д. 36; профессор кафедры фармакологии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-8979-8084
Фарбер Ирина Михайловна — к.м.н., ассистент кафедры детских болезней клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0001-6919-6732
Горелов Александр Васильевич — д.м.н., профессор, академик РАН, заместитель директора по научной работе ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3A; заведующий
кафедрой инфекционных болезней и эпидемиологии ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; ORCID iD 0000-0001-9257-0171
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Контактная информация: Каннер Екатерина Валерьевна, e-mail: ekanner@mail.ru
Конфликт интересов отсутствует.
Статья поступила 04.09.2024.
Поступила после рецензирования 27.09.2024.
Принята в печать 22.10.2024.
About the authors:
Ekaterina V. Kanner — Dr. Sc. (Med.), Senior Researcher of the Clinical Department of Infectious Pathology, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0003-3204-1846
Ilya D. Kanner — post-graduate student of the Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0003-4632-0547
Maxim L. Maximov — Dr. Sc. (Med.), Dean of the Faculty of Preventive Medicine and Health Organization, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; Chief Consultant Specialist — clinical pharmacologist of the Ministry of Health of the Republic of Tatarstan, Head of the Department of Clinical Pharmacology and Pharmacotherapy, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 36, Butlerova str., Kazan, 420012, Russian Federation; Professor of the Department of Pharmacology of the Faculty of Pediatrics, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-8979-8084
Irina M. Farber — C. Sc. (Med.), Associate Professor of the Department of Children’s Diseases, N.F. Filatov Clinical Institute of Children’s Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0001-6919-6732
Alexander V. Gorelov — Dr. Sc. (Med.), Professor, Academician of the Russian Academy of Sciences, Deputy Director for Scientific Work of the Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; Head of the Department of Infectious Diseases and Epidemiology, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; ORCID iD 0000-0001-9257-0171
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Contact information: Ekaterina V. Kanner, e-mail: ekanner@mail.ru
There is no conflict of interest.
Received 04.09.2024.
Revised 27.09.2024.
Accepted 22.10.2024.
1World Health Organization (2020). Severe acute respiratory infections treatment centre: practical manual to set up and manage a SARI treatment centre and a SARI screening facility in health care facilities (No. WHO/2019-nCoV/SARI_treatment_center/2020.1). Geneva: World Health Organization
2Рафамин. Общая характеристика лекарственного препарата. Единый реестр зарегистрированных лекарственных средств Евразийского экономического союза. (Электронный ресурс.) URL: https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/DrugRegistrationDetails.aspx (дата обращения: 11.09.2024).
3Государственная фармакопея Российской Федерации, XV издание.
Информация с rmj.ru



