Введение
За последнее десятилетие отмечается неуклонный рост заболеваемости ЗНО, что, по всей видимости, связано с широким внедрением методов современной диагностики, увеличением продолжительности жизни, воздействием неблагоприятных факторов окружающей среды и т. д. Данная тенденция отчетливо прослеживается также и в динамике показателей заболеваемости населения России ЗНО полости рта и глотки в 2013–2023 гг.: при сравнении «грубых» показателей на 100 тыс. населения прирост заболеваемости составил около 16% при среднем возрасте больных на момент установления диагноза 61 год [1].
Одним из методов лечения больных ЗНО полости рта и глотки остается РТ. В рамках радикальных программ облучения при классическом фракционировании на область первичной опухоли ротоглотки и метастатически пораженные лимфатические узлы подводится суммарная доза до 66–70 Гр, зачастую одновременно с лекарственной противоопухолевой терапией. При местнораспространенных нерезектабельных опухолевых процессах ротоглотки химиолучевое лечение проводится либо последовательно, либо одновременно. Индукционная химиотерапия больных раком ротоглотки с последующей РТ ассоциируется с меньшей частотой и тяжестью токсических реакций, характеризуется высокой комплаентностью, которая достигает 70% [2–4]. Другие режимы фракционирования, как, например, ускоренное фракционирование на фоне химиорадиомодификации, сопровождаются высокой частотой тяжелых ранних токсических реакций (3–4-й степени у 95% больных), что требует назогастрального и парентерального питания, а также интенсивной сопутствующей обезболивающей терапии [5].
Технологическое развитие РТ с внедрением в широкую практику методик облучения модулируемой интенсивности (IMRT) позволило снизить вероятность развития тяжелых токсических реакций в процессе лечения, что повлияло на комплаентность больных при реализации высокодозных программ облучения [6, 7]. Однако обеспечить эффективное и радикальное лучевое или химиолучевое лечение без отрицательного влияния на качество жизни больных раком ротоглотки, а также проведение непрерывного курса облучения зачастую остается актуальной проблемой в современной РТ. Развитие тяжелых токсических реакций в процессе курса облучения в некоторых случаях требует перерыва в лечении, что отрицательно сказывается на его эффективности.
В настоящее время не существует стандартного или даже однозначно эффективного метода профилактики или лечения радиационно-индуцированного мукозита. Поэтому поиск средств, мер профилактики развития тяжелых радиационно-индуцированных мукозитов по сей день остается острой проблемой в современной онкологии. Фиксированная комбинация гиалуроновой кислоты и хондроитина сульфата и биоадгезивного вещества полоксамер 407 в ретроспективном исследовании показала хорошую переносимость и эффективность для облегчения симптомов радиационно-индуцированного эзофагита (РИЭ) [9]. РИЭ изучен значительно меньше, чем оральный мукозит; тем не менее слизистая оболочка и подслизистая основа ротовой полости и ротоглотки очень похожи на слизистую оболочку пищевода вплоть до желудочно-пищеводного соединения [10]. Обе выстланы кератинизированными и некератинизированными плоскими эпителиальными клетками, лежащими над собственной пластинкой и подслизистой оболочкой, которые служат для защиты подлежащих тканей. Пищевод имеет такое же общее строение, но с мышечной оболочкой слизистой между собственной пластинкой и подслизистой оболочкой. Таким образом, патофизиология мукозита как в полости рта, так и в пищеводе в известном смысле одинакова.
В клиническом наблюдении представлен опыт применения медицинского изделия, содержащего гиалуроновую кислоту, хондроитина сульфат и биоадгезивное вещество полоксамер 407, в качестве средства, контролирующего развитие тяжелых реакций со стороны слизистой ротоглотки и полости рта.
Содержание статьи
Клиническое наблюдение
Пациент П., 65 лет, обратился в ФГБУ «РНЦРР» Минздрава России в июне 2023 г. для консультации с клиническим диагнозом: рак ротоглотки сT4acN2cM0. IVA стадия.
Жалобы: на боли в левой половине глотки, усиливающиеся при глотании и приеме твердой пищи; затруднение глотания твердой пищи.
Анамнез заболевания: в апреле 2023 г. пациент отметил появление болей в области горла. Лечился самостоятельно народными средствами, затем в поликлинике по месту жительства, где проводилась антибактериальная, симптоматическая терапия с незначительным эффектом. В конце мая 2023 г. обратился к оториноларингологу, в результате осмотра был заподозрен опухолевый процесс в ротоглотке. 07.06.2023 выполнена биопсия опухолевого образования ротоглотки, при гистологическом исследовании установлен морфологический диагноз: плоскоклеточный рак (малигнизация папилломы либо вирусного поражения слизистой глотки).
Данные магнитно-резонансной томографии (МРТ) шеи от 27.06.2023: в ротоглотке от уровня спинки языка до ямки надгортанника определяется опухоль левой боковой (преимущественно) и задней стенок: гиповаскулярная, суммарными аксиальными размерами 35×27 мм, вертикальным размером 61 мм, неоднородной структуры, с неровным нечетким контуром; инфильтрирует левую небную дужку, левую боковую стенку ротоглотки, левую небную миндалину, левую половину язычной миндалины, левую черпаловидно-надгортанную складку, за срединную линию не переходит; располагается в слизистом пространстве, с вероятными признаками инвазии бокового окологлоточного пространства слева; билатерально, больше слева, определяются множественные неувеличенные лимфатические узлы шеи (поверхностные и глубокие околоушные, подчелюстные, латеральные), наибольший яремно-двубрюшный узел слева размером до 11×9 мм; слизистая гортани на уровне голосовых связок и складок не утолщена, однородной структуры; контуры гортани не деформированы, просвет не сужен; дегенеративные изменения шейного отдела позвоночника. Заключение: МРТ-картина опухоли ротоглотки слева.
При иммуногистохимическом исследовании опухоли для определения экспрессии p16 — результат отрицательный.
Данные позитронно-эмиссионной томографии с 18F-дезоксиглюкозой, совмещенной с компьютерной томографией (ПЭТ-КТ с 18F-ФДГ), от 10.07.2023: в левых отделах ротоглотки и, частично, гортаноглотки, с распространением на мягкое небо, корень языка, диафрагму полости рта, небную миндалину, валекулу гортани, надгортанник слева визуализируется усиливающееся при контрастировании объемное образование с полостью распада, широко сообщающейся с просветом ротоглотки, с выраженной гиперфиксацией радиофармпрепарата, приблизительными размерами 30×31×45 мм, максимальное значение стандартизированного накопления (SUVmax) 23,1, метаболическим объемом около 14 см3. Отмечаются незначительно увеличенные шейные лимфоузлы слева I–IV уровня, околоушные с фоновой и незначительно повышенной метаболической активностью размерами до 8 мм, SUVmax=3,2, контрольный верхний яремный лимфоузел слева, наиболее вероятно, вторичного генеза. Остальные лимфоузлы — без патологических изменений. Заключение: опухолевое образование левых отделов ротоглотки и, частично, гортаноглотки, с распространением на мягкое небо, корень языка, диафрагму полости рта, небную миндалину, валекулу гортани, надгортанник слева, с выраженным гиперметаболизмом 18F-ФДГ; незначительно увеличенные лимфоузлы шеи слева с фоновым и незначительно повышенным метаболизмом 18F-ФДГ, наиболее вероятно, вторичного генеза; значительно увеличенный подключичный лимфоузел слева с выраженным гиперметаболизмом 18F-ФДГ вторичного генеза.
С 11.07.2023 начато проведение программы индукционной противоопухолевой цитотоксической лекарственной терапии по схеме DCF.
Данные ПЭТ-КТ от 15.09.2023: в сравнении с предыдущим исследованием — значительное снижение гиперметаболизма 18F-ФДГ в опухоли левых отделов гортаноглотки с SUVmax=22,8 до фоновых значений SUVmax=2,66; в надключичной области слева ранее выявленное кистозное образование прежними размерами около 39×23×35 мм с умеренным снижением гиперфиксации (снижение SUVmax с 7,6 до 3,79). Заключение: в сравнении с исследованием от 10.07.2023 — полный метаболический ответ. Признаков регионарного метастазирования нет.
23.12.2023 изготовлено индивидуальное фиксирующее устройство (термопластическая плечеголовная маска), выполнена компьютерно-томографическая топометрия. Проведены дозиметрическое планирование (TPS ECLIPSE) с расчетом доз на мишени и ограничением доз на критические органы, верификация дозиметрического плана облучения по программе гарантии качества РНЦРР (рис. 1–3). С 25.10.2023 по 14.12.2023 после предварительной портальной визуализации в условиях индивидуальной фиксации (плечеголовная термпластическая маска) проведен курс ротационной объемно-модулируемой дистанционной лучевой терапии (ДЛТ) на область первичной опухоли ротоглотки с разовой очаговой дозой (РОД) 2 Гр до суммарной очаговой дозы (СОД) 70 Гр, на область регионарных лимфоузлов высокого и промежуточного риска с РОД 2 Гр до СОД 54–60 Гр, на область регионарных лимфоузлов низкого риска с РОД 2 Гр до СОД 50 Гр. Режим фракционирования — 5 раз в неделю. Лечение перенес относительно удовлетворительно. В процессе лечения и по его окончании отмечены лучевые реакции: эпидермит 1-й степени, мукозит 1-й степени, ксеростомия 1-й степени по шкале RTOG.
За 2 дня до начала курса ДЛТ, на протяжении всего курса ДЛТ ежедневно и 2 нед. после завершения программы РТ пациент принимал медицинское изделие, содержащее гиалуроновую кислоту, хондроитина сульфат и биоадгезивное вещество полоксамер 407 (Альфазокс®) внутрь перорально по 10 мл (1 пакетик-саше) после основных приемов пищи и перед сном.
Обсуждение
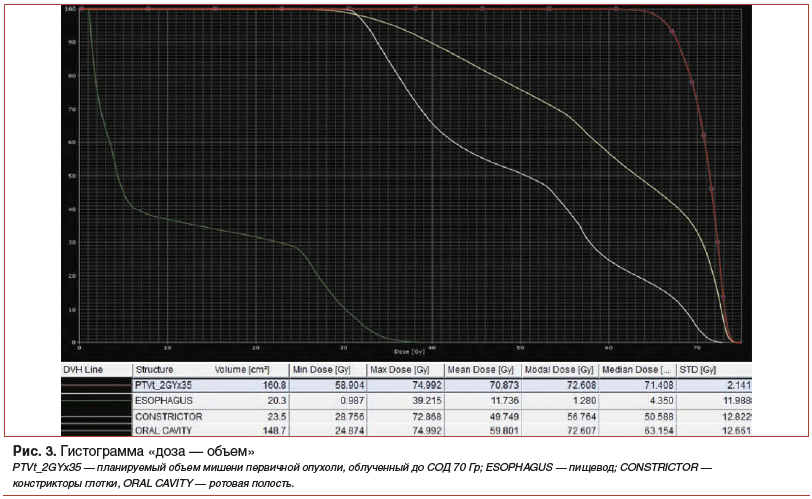
Планируемый объем мишени, получивший суммарную дозу 70 Гр, составил 160,8 см3. Показатель Dmean на пищевод составил 11,7 Гр (при Dmax=9,2 Гр), Dmean на ротовую полость — 59,8 Гр (при Dmax=74,9 Гр), Dmean на констрикторы глотки — 49,7 Гр (при Dmax=72,8 Гр). Несмотря на то, что вышеуказанные показатели не превышают ограничений доз, которые могут привести к тяжелым последствиям, очевидно, что объем облучения и средние дозы на критические органы должны быть сопряжены с высоким риском развития ранних лучевых реакций 2-й степени и, возможно, выше. Однако на фоне приема медицинского изделия Альфазокс® удалось добиться контроля над реакциями со стороны слизистой ротовой полости, глотки, пищевода на уровне не более 1-й степени по шкале RTOG и завершить полный курс РТ без перерывов.
Текущая общепринятая модель описывает 5 стадий мукозита: инициацию, усиление/активацию, усиление сигнала, изъязвление и заживление. Она была предложена S.T. Sonis еt al. и актуальна как для орального мукозита, так и для эзофагита [11–14].
На начальной стадии повреждение эпителиальных клеток происходит в результате лучевой терапии и/или химиотерапии в ходе лечения онкологических заболеваний [12]. Радиация вызывает разрывы двухцепочечной ДНК в результате как прямого повреждения ДНК, так и косвенного повреждения, вызванного генерацией активных форм кислорода (АФК).
На втором этапе высвобождение АФК и других эндогенных молекулярных паттернов, связанных с химиотерапией (CRAMPS), либо молекулярных паттернов, связанных с повреждением (DAMP), из эпителиальных клеток, поврежденных на первом этапе, инициирует первичный ответ, который включает расщепление фибронектина, опосредованную макрофагами активацию металлопротеиназы матрикса, приток воспалительных клеток и высвобождение цитокинов, которые вызывают дальнейшее локальное повреждение тканей.
Затем наступает стадия усиления сигнала, что усиливает повреждение тканей и апоптоз за счет активации ядерного фактора (NF) kB, фактора некроза опухоли α и других цитокинов, что обусловливает формирование петли положительной обратной связи.
Среди клеток, поврежденных во время этих процессов, есть базальные эпителиальные клетки, генерирующие вышележащие зрелые плоские клетки, которые более устойчивы к воздействию лучевой терапии и со временем могут нормально воспроизводиться. Однако повреждение базальных клеток приводит к недостаточному поступлению зрелых плоских клеток, что, в свою очередь, вызывает разрушение поверхности эпителия. Потеря эпителиального слоя зрелых клеток плоского эпителия запускает следующую стадию развития мукозита: изъязвление и потерю целостности эпителия. Эта постепенная потеря вышележащих клеток без доступных замещающих клеток приводит к 2-недельной задержке от начала лучевой терапии до появления клинически выраженного мукозита.
Заключительная стадия мукозита, заживление, происходит спонтанно в результате пролиферации эпителиальных клеток, дифференцировки и миграции от краев раны в ответ на передачу сигналов от внеклеточного матрикса. Во время лучевой терапии повреждающее воздействие осуществляют ежедневно, задерживая стадию заживления до тех пор, пока лучевая терапия не будет завершена, при этом мукозит обычно проходит через 2–3 нед. после прекращения лучевой терапии.
Альфазокс® является медицинским изделием, в котором комбинация гиалуроновой кислоты и хондроитина сульфата обеспечивает защиту слизистой оболочки желудка и пищевода. Наличие в его составе компонента полоксамер 407, обладающего высокой биоадгезивной способностью, обеспечивает надежный контакт комплекса «гиалуроновая кислота — хондроитина сульфат» с поверхностью стенки слизистой пищевода, защищая ее от агрессивного воздействия соляной кислоты желудка. Хондроитина сульфат также участвует в восстановлении слизистой оболочки пищевода и желудка. Альфазокс® способствует уменьшению воспаления и заживлению эрозий слизистой при эзофагитах и гастродуоденитах.
Очевидно, что Альфазокс® в равной степени оказывает протективное воздействие на слизистые ротовой полости и глотки, а также на стенку пищевода.
Заключение
Положительный опыт применения медицинского изделия Альфазокс® у больных местнораспространенным раком ротоглотки в процессе проведения радикального курса РТ, а также удобство его использования заслуживают определенного внимания. Разумеется, для широкого внедрения данного медицинского изделия в общую практику в качестве средства, способствующего контролю над развитием радиационно-индуцированных мукозитов, требуется его дальнейшее изучение в рамках рандомизированных клинических исследований.
Информация с rmj.ru

