Введение
Увеальная меланома (УМ) является наиболее частой первичной внутриглазной злокачественной опухолью, которая локализуется в различных отделах увеального тракта — в хориоидее (90%), цилиарном теле (6%) и радужке (4%), может иметь распространенный характер [1, 2]. Ввиду периферической локализации у 2/3 пациентов опухоль диагностируется поздно — на III–IV стадии заболевания, что в значительной степени ограничивает возможности проведения органосохранного лечения [3, 4]. Для лечения УМ большого размера и при распространенном характере процесса во всем мире, помимо ликвидационного лечения, применяются органосохранные методы: протонная терапия (ПТ), «Гамма-нож», «Кибер-нож», а также комбинированное лечение1[5–7].
В настоящий момент используются две методики ПТ — пассивное рассеивание и сканирование карандашным пучком. Для лечения УМ впервые был применен метод пассивного рассеивания, позволяющий доставлять дозу облучения с высокой точностью. Однако его широкое практическое применение ограничено, так как для защиты окружающих тканей требуется изготовление индивидуальных свинцовых коллиматоров, соответствующих форме мишени [8–11]. Перспективным является метод сканирования карандашным пучком, при котором контролируются положение и глубина проникновения пучка, обеспечивающие высокую конформность облучения. Для данной технологии не требуется изготовление индивидуальных устройств для модификации пучка, что упрощает ее применение и снижает общую стоимость лечения [8–12].
К настоящему времени накоплен достаточный клинический опыт и получены результаты, подтверждающие потенциальную эффективность ПТ при лечении большинства опухолей самых распространенных локализаций, особенно для УМ [13–17]. Несмотря на эффективность лечения, ПТ сопряжена с развитием лучевых осложнений; катаракты, вторичной глаукомы, лучевой ретинопатии, нейропатии, синдрома «сухого глаза» тяжелой степени, гемофтальма, увеита и др. [15, 18–21]. С учетом прогрессирующего течения и сложности терапии неоваскулярной глаукомы (НВГ) ее развитие является основной причиной выполнения вторичной энуклеации [17–21]. По данным литературы, к факторам риска развития НВГ при применении технологии пассивного рассеивания относят размеры опухоли, дозу облучения критических структур глаза, увеличение высоты и протяженности отслойки сетчатки (ОС) после курса ПТ, расстояние от опухоли до макулы или зрительного нерва, кровоизлияния на поверхности опухоли до начала ПТ [19, 21, 23].
Цель исследования: проанализировать возможные предикторы развития НВГ у пациентов с УМ после ПТ с использованием сканирующего карандашного пучка.
Содержание статьи
Материал и методы
С 2021 г. в ООО «ЛДЦ МИБС» методом ПТ с использованием сканирующего карандашного пучка было пролечено 29 пациентов (30 глаз) с УМ в возрасте от 23 до 87 лет, среди них 18 женщин и 11 мужчин. Срок наблюдения варьировал от 1 до 44 мес., все пациенты находились под динамическим наблюдением офтальмоонколога Санкт-Петербургского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» с периодичностью осмотров и клинико-инструментального обследования в 1, 3, 6, 9 и 12 мес.
Диагноз УМ основывался на данных анамнеза, стандартного офтальмологического обследования, а также ультразвукового исследования (УЗИ), в том числе УЗ-допплерографии для оценки характеристики кровоснабжения опухоли. УЗИ выполняли с помощью УЗ-сканера экспертного класса PHILIPS Affinity 50 (Philips Ultrasound, США) линейным высокочастотным широкополосным датчиком L15-7io в рабочем диапазоне частот от 15 до 7 МГц. Исследование осуществляли в соответствии с принципом безопасного применения диагностического УЗ (as low as reasonably achievable (ALARA)) в режиме ограничения интенсивности акустического сигнала, установленном для офтальмологических исследований (механический индекс MI≤0,23, тепловой индекс TI≤1,0, Ispta.3 <50 мВт/см3 согласно руководству пользователя к Affinity 50) с минимальным временем экспозиции. В ходе исследования выполняли серошкальное сканирование (В-режим) глазного яблока и орбиты, с помощью которого можно определить локализацию, форму, эхоструктуру, эхогенность, четкость контуров, размеры опухоли (проминенцию, диаметр основания), наличие или отсутствие экскавации хориоидеи, наличие или отсутствие вторичной ОС, ее высоту и протяженность, наличие или отсутствие признаков экстрабульбарного роста опухоли. В режиме дуплексной допплерографии с применением цветового допплеровского картирования (ЦДК) энергии отраженного допплеровского сигнала и спектрального допплеровского режима устанавливали отсутствие или наличие сосудистой сети в опухоли, при ее обнаружении визуально определяли количество питающих внутриопухолевых сосудов, особенности сосудистого русла опухоли. По наличию и плотности распределения цветовых картограмм потоков крови у пациентов регистрировались следующие варианты кровотока меланомы хориоидеи (МХ): аваскулярный — отсутствие цветовых потоков в проекции МХ, гиповаскулярный— единичные (1–2) цветовые потоки в проекции опухоли и гиперваскулярный— множественные (3 и более) цветовые потоки в проекции опухоли.
Для выявления экстраокулярной распространенности процесса у всех больных проводили исследование органов брюшной полости и головного мозга с помощью магнитно-резонансной томографии (МРТ), мультиспиральной компьютерной томографии легких (признаков метастатического поражения при первичном обращении не выявлено).
В соответствии с общепринятым стадированием онкологического заболевания по классификации TNM, предложенной Американским объединенным комитетом по раку (American Joint Committee on Cancer (AJCC)) [24, 25], распределение пациентов с УМ было следующим: T2аN0M0 — 4 пациента, T3аN0M0 — 6, T3bN0M0 — 11, T4аN0M0 — 3, T4bN0M0 — 6. Распределение больных в зависимости от клинической стадии опухолевого процесса: IIА стадия — 4 пациента, IIB стадия — 7, IIIA стадия — 14, IIIB стадия — 6.
Курс ПТ проводили по ранее описанной нами методике в режиме гипофракционирования в суммарной дозе 49 Гр за 7 фракций (BED0,6=620 Гр; EQD2=143 Гр) [26]. Предварительно каждому пациенту в рамках топометрической разметки выполняли КТ и МРТ в положении лечения (лежа на спине), моделирование КТ и МРТ, оконтуривание мишени и критических структур, планирование и контроль качества лечебного плана вместе занимали 3 дня для каждого пациента. Иммобилизацию пациента осуществляли с помощью модифицированной термопластической маски с возможностью фиксации взгляда пациента на метке, установленной на фокусном расстоянии. Параметры лечебного плана включали робастное планирование с использованием двух или трех полей и дополнительный отступ 1 мм во всех направлениях с целью компенсации возможных спонтанных движений глазного яблока [26].
Полученные данные, представленные в виде медианы, квартилей и разброса Me [Q1; Q3] (min — max) либо Me [Q1; Q3], были подвергнуты статистическому анализу с использованием непараметрических методов для независимых выборок (для количественных критериев использовали критерий Манна — Уитни, для качественных — χ2 Пирсона), статистически значимыми различия считали при р<0,05. Анализ данных проводили с помощью пакета прикладных программ Microsoft Exel 2016, AnalystSoft Inc., StatPlus:mac (версия 8).
Результаты исследования
Эффективность лечения определяли подобно градациям оценки целевых очагов солидных опухолей (Response evaluation criteria in solid tumors (RECIST), 2009) [27]. Уменьшение размеров опухоли проходило медленно — у 18 пациентов к 9-му месяцу наблюдения регресс составил 42,3±17,5%.
Лучевые реакции оценивали в зависимости от усиления распространенности вторичной ОС после завершения курса ПТ как умеренные (наличие субтотальной ОС) и выраженные (наличие тотальной ОС). После лечения у 26 пациентов развились лучевые осложнения в различные сроки, в ряде случаев они имели сочетанный характер. Офтальмогипертензия была зафиксирована у 13 пациентов, из которых у 9 развилась НВГ. Предикторы развития НВГ изучены в группе пациентов с НВГ (исследуемая группа (ИГ) 1) и без НВГ (ИГ 2) при сроке наблюдения от 6 мес. (22 человека) после окончания курса ПТ. Клинико-инструментальная характеристика ИГ по изученным качественным и количественными критериям представлена в таблице 1.
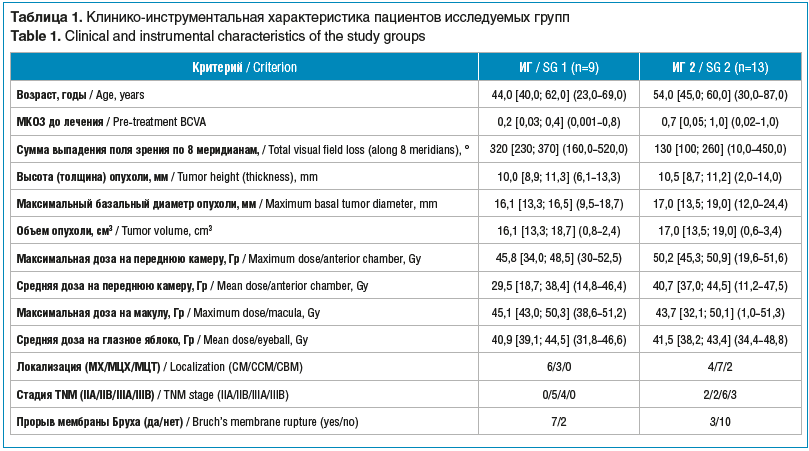
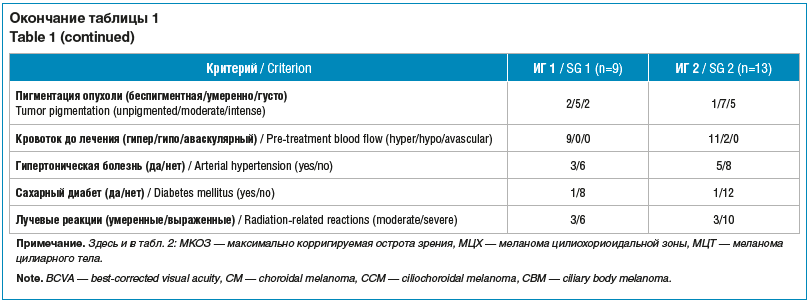
На первом этапе исследования для оценки риска развития НВГ у пациентов с УМ после ПТ с использованием сканирующего карандашного пучка был проведен сравнительный анализ количественных признаков в исследуемых группах. Полученные данные представлены в таблице 2.
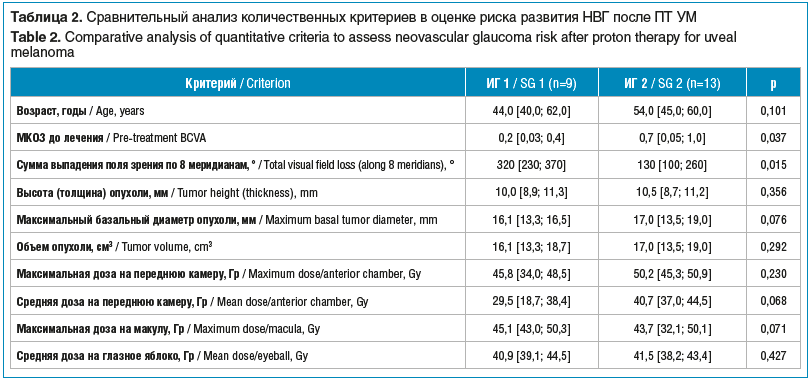
Сравнительный анализ количественных признаков показал, что в группе с НВГ статистически значимо чаще встречались более низкие показатели МКОЗ и суммы выпадения поля зрения по 8 меридианам до начала лечения (p<0,05) в сравнении с группой без НВГ. Между другими изученными количественными признаками статистически значимой разницы выявлено не было (см. табл. 2).
На следующем этапе сравнивали качественные критерии, данные представлены в таблице 3.
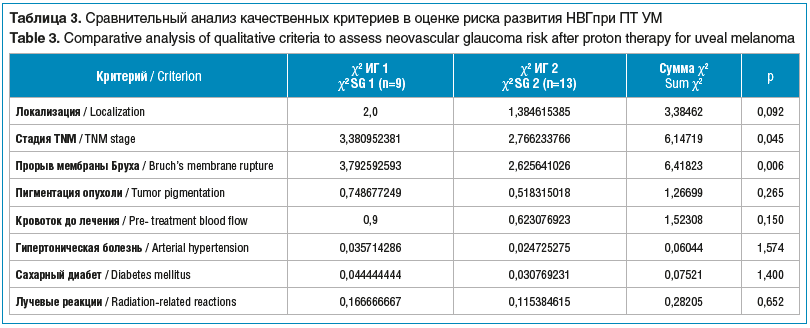
При изучении качественных признаков были выявлены статистически значимо более высокая частота встречаемости прорыва мембраны Бруха и более развитые стадии заболевания в группе пациентов с развившейся НВГ в сравнении с группой без НВГ (p<0,05). По другим изучаемым качественным критериям между ИГ статистически значимой разницы выявлено не было (см. табл. 3).
Полученные результаты демонстрируются следующим клиническим наблюдением.
Клиническое наблюдение
Пациент Б., 44 года, в марте 2023 г. был направлен в Санкт-Петербургский филиал ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» в связи с подозрением на новообразование хориоидеи левого глаза.
По данным исследований: МКОЗ OD: 0,650 Sph +1,50=0,95, OS: движение руки у лица, внутриглазное давление (ВГД) OD=23,0 мм рт. ст., OS=19,0 мм рт. ст. При проведении периметрии определяется сужение границ полей зрения правого глаза во всех сегментах, сумма выпадения поля зрения по 8 меридианам составляет 520° (рис. 1А).
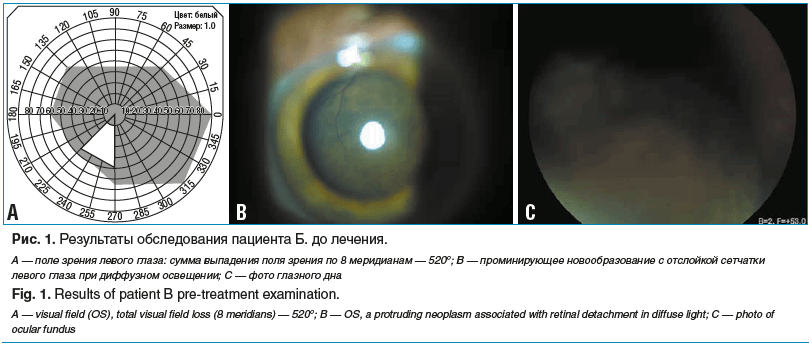
При биомикроофтальмоскопии: OS — передний сегмент глазного яблока без изменений. Хрусталик прозрачный. Диск зрительного нерва (ДЗН) перекрыт высокопроминирующим неравномерно пигментированным новообразованием с собственными сосудами на поверхности, с прорывом мембраны Бруха, с вторичной распространенной ОС в проекции новообразования (рис. 1 B, C). ОD — без патологии.
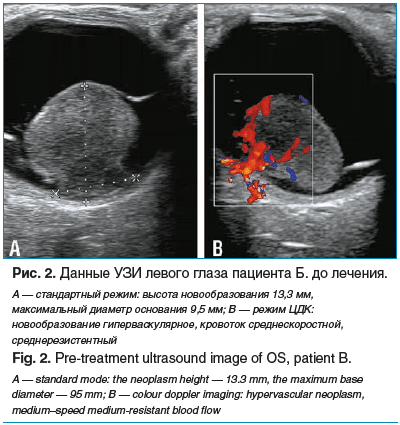
При проведении УЗИ в левом глазу в верхневисочном сегменте визуализируется гиперэхогенное новообразование высотой до 13,3 мм, максимальным диаметром основания до 9,5 мм, с прорывом мембраны Бруха, с ОС в области опухоли и в нижних отделах (рис. 2А). По данным ЦДК новообразование обильно васкуляризовано, кровоток среднескоростной и среднерезистентный (рис. 2В).
При дополнительном обследовании признаков метастатического процесса не выявлено.
На основании данных клинико-инструментального обследования установлен диагноз: меланома хориоидеи левого глаза, T3aN0M0 IIB стадия. Вторичная ОС.
В связи с категорическим отказом пациента от энуклеации рекомендовано проведение ПТ в МИБС им. Сергея Березина. Курс лечения включал 7 фр. по 7 Гр, экв. ≈ 100 Гр, V (gross tumor volume) 1,86 см3. Далее пациент наблюдался через 1, 3, 6, 9 и 12 мес. после проведения ПТ.
Через 1 мес. у пациента наблюдались выраженные лучевые реакции в виде усиления вторичной ОС (до тотальной), развитие гемофтальма. К 3-му месяцу наблюдения было отмечено уменьшение размеров передней камеры, повышение ВГД до 29 мм рт. ст., по поводу чего была назначена гипотензивная терапия и рекомендовано проведение лазерной иридоэктомии. Через 6 мес. от начала лечения было отмечено уменьшение размеров опухоли, ВГД стабилизировалось. К 12-му месяцу наблюдения пациент обратился с жалобами на болевой синдром. При обследовании острота зрения OS — 0, ВГД OS — 49 мм рт. ст., выявлены рубеоз и выраженная неоваскуляризация в углу передней камеры левого глаза (рис. 3А). Несмотря на положительную динамику: уменьшение размеров новообразования (высота 9,5 мм) и отсутствие кровотока внутри опухоли по данным УЗИ в режиме ЦДК (рис. 3, В, С), в связи с развитием НВГ и выраженного болевого синдрома, сохранением гемофтальма, отсутствием эффекта от максимального гипотензивного режима пациенту было рекомендовано проведение вторичной энуклеации.
Данный клинический пример подтверждает значимость установленных предикторов развития НВГ (МКОЗ до лечения, сумма выпадения поля зрения по 8 меридианам, стадия TNM, прорыв мембраны Бруха) в возникновении данного осложнения после ПТ с использованием сканирующего карандашного пучка УМ.
Обсуждение
Неоваскулярная глаукома при ПТ с использованием сканирующего карандашного пучка УМ развивается в 9,1–47,1% случаев [11, 18–21]. Поиск предикторов ее развития является важной задачей, так как имеются данные о том, что офтальмогипертензия и вторичная глаукома повышают риск метастазирования при данном заболевании [28]. Кроме этого, прогрессирующее течение и трудности в лечении НВГ, а также безвозвратная утрата зрения и необходимость выполнения вторичной энуклеации приводят к значительным экономическим потерям [18–21].
В настоящем исследовании установлено, что факторами риска развития НВГ у пациентов с УМ после ПТ с использованием сканирующего карандашного пучка явились такие показатели, как снижение МКОЗ, увеличение суммы выпадения поля зрения по 8 меридианам (в градусах), наличие прорыва мембраны Бруха до лечения, а также более развитая стадия заболевания. Результаты клинико-инструментальных исследований опосредованно отражают далеко зашедшую стадию процесса и полностью совпадают с результатами исследований зарубежных авторов, в которых установлено, что возможными предикторами риска развития НВГ при использовании ПТ с применением технологии пассивного рассеивания являются размеры опухоли [16, 19, 29]. Вместе с тем в настоящем исследовании не получено статистически значимой разницы в размерах опухоли (высоты, диаметра основания и объема) в исследуемых группах, что, вероятно, объясняется малым числом наблюдений.
Особого внимания заслуживает такой критерий, как прорыв мембраны Бруха, диагностируемый офтальмоскопически и подтверждаемый УЗИ. Данный критерий также находится в прямой зависимости от стадии процесса — по мере прогрессирования заболевания увеличивается частота встречаемости прорыва мембраны Бруха. Установленная в данном исследовании взаимосвязь наличия прорыва мембраны Бруха и риска развития НВГ обусловливает клиническую важность оценки данного параметра при планировании ПТ.
Кроме того, среди предикторов развития НВГ у пациентов с УМ после ПТ также выделяются локализация опухоли, доза облучения критических структур глаза, усиление ОС после окончания курса лечения [16, 19, 22, 23, 29]. Отсутствие подобных статистических закономерностей в данном исследовании, вероятнее всего, обусловлено малой выборкой и небольшим сроком наблюдения за пациентами и требует продолжения исследования.
Заключение
В ходе исследования были выявлены некоторые возможные предикторы развития НВГ, которые следует учитывать при отборе пациентов для проведения ПТ с использованием сканирующего карандашного пучка в органосохранном лечении УМ. Дальнейшее изучение данного вопроса на большей когорте пациентов и при более длительном наблюдении за ними позволит определить дополнительные факторы риска возникновения НВГ и разработать математическую прогностическую модель развития данного осложнения.
Сведения об авторах:
Панова Ирина Евгеньевна — д.м.н., профессор, заместитель директора по научной работе Санкт-Петербургского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; профессор кафедры офтальмологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; профессор кафедры оториноларингологии и офтальмологии СПбГУ; 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7–9; ORCID iD 0000-0001-7443-4555
Свистунова Евгения Михайловна — врач-офтальмолог Санкт-Петербургского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0009-0000-2126-4345
Воробьев Николай Андреевич — к.м.н., врач-онколог, врач-радиолог, заведующий отделением протонной лучевой терапии ООО «ЛДЦ МИБС»; 194354, Россия, г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, литера А; доцент кафедры онкологии СПбГУ; 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7–9; ORCID iD 0000-0002-6998-5771
Самкович Елена Владиславовна — к.м.н., заведующая научно-образовательным отделом, врач-офтальмолог, врач-онколог, врач ультразвуковой диагностики Санкт-Петербургского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0002-5573-5712
Мартынова Наталия Игоревна — врач-онколог, радиотерапевт ООО «ЛДЦ МИБС»; 194354, Россия, г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, литера А; ORCID iD 0000-0002-1679-5173
Быховский Арсений Андреевич — врач-офтальмолог Санкт-Петербургского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0003-1559-2793
Контактная информация: Евгения Михайловна Свистунова, e-mail: em.svistunova@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.09.2024.
Поступила после рецензирования 08.10.2024.
Принята в печать 31.10.2024.
About the authors:
Irina E. Panova — Dr. Sc. (Med.), Professor, Deputy Director for Scientific and Research Work, Saint Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; Professor of the Department of Ophthalmology, North West State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; Professor of the Department of Otorhinolaryngology and Ophthalmology, St. Petersburg State University; 7-9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0001-7443-4555
Evgenia M. Svistunova — ophthalmologist, Saint Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; ORCID iD 0009-0000-2126-4345
Nikolay A. Vorobyov — C. Sc. (Med.), oncologist, radiologist, Head of the Department of Proton Radiation Therapy,
Medical and Diagnostic Center of the International Institute of Biological Systems named after Berezin Sergei; 2/3a, Esenin str., St. Petersburg, 194354, Russian Federation; Assistant Professor of the Department of Oncology, St. Petersburg State University; 7-9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0002-6998-5771
Elena V. Samkovich — C. Sc. (Med.), Head of the Scientific and Educational Department, ophthalmologist, oncologist, ultrasound diagnostics doctor, Saint Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; ORCID iD 0000-0002-5573-5712
Natalia I. Martynova — oncologist, radiotherapist, Medical and Diagnostic Center of the International Institute of Biological Systems named after Berezin Sergei; 2/3a, Esenin str., St. Petersburg, 194354, Russian Federation; ORCID iD 0000-0002-1679-5173
Arseny A. Bykhovsky — ophthalmologist, Saint Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; ORCID iD 0000-0003-1559-2793
Contact information: Evgenia M. Svistunova, e-mail: em.svistunova@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 15.09.2024.
Revised 08.10.2024.
Accepted 31.10.2024
1Клинические рекомендации. Увеальная меланома. 2020. (Электронный ресурс.) URL: https://oncologyassociation.ru/wpcontent/uploads/2020/09/uvealnaja_melanoma.pdf (дата обращения: 14.09.2024).
материал rmj.ru
