Содержание статьи
Введение
Распространенность аллергического ринита (АР) в России составляет 10–24% [1], бронхиальной астмы (БА) среди взрослых — 6,9% [2]. По данным эпидемиологических исследований, курение является значительным фактором риска атопии и БА [3], однако неизвестно влияние курения на течение АР [4].
Распространенность курения среди людей, страдающих БА, соответствует распространенности курения в популяции и составляет 25–35% [5]. В последние годы среди молодежи стало популярным курение электронных сигарет. По результатам крупных опросов населения о потреблении табака, в России распространенность курения табака снизилась с 39,1 до 30,3% в период с 2009 по 2016 г. Распространенность курения электронных сигарет в 2016 г. составила 3,5%, т. е. 4,2 млн потребителей, большинство которых были в возрасте 15–24 лет [6].
Описано негативное влияние курения на развитие и течение различных заболеваний дыхательных путей, при этом результаты исследований воздействия курения на течение аллергических болезней и сенсибилизацию к аллергенам довольно противоречивы [7, 8], что требует дальнейшего изучения.
Цель исследования: сравнительный анализ тяжести течения аллергических заболеваний дыхательных путей, сенсибилизации к аллергенам пыльцы и домашней пыли, показателей лабораторно-инструментальных методов обследования у курящих и некурящих молодых мужчин.
Материал и методы
Проанализированы данные медицинских карт (форма № 003/у) 249 пациентов мужского пола в возрасте 16–27 лет с АР и/или БА, обследованных с апреля по август 2022 г. в отделении аллергологии и иммунологии ГБУЗ ПК «Пермская краевая клиническая больница» по направлению призывной комиссии.
Критерии включения: лица мужского пола в возрасте 16–27 лет, установленный диагноз АР и/или аллергической формы БА.
Критерии невключения: лица с хронической обструктивной болезнью легких, неаллергической формой БА, сопутствующей тяжелой соматической патологией.
Критерии исключения: признаки острой респираторной инфекции в период наблюдения.
Обследование для уточнения диагноза БА, согласно стандарту медицинской помощи взрослым при БА1, включало осмотр врачом аллергологом-иммунологом, общий анализ крови с лейкоцитарной формулой, определением скорости оседания эритроцитов и подсчетом абсолютного количества эозинофилов, определение уровня общего иммуноглобулина Е (IgE) в сыворотке крови, исследование функции внешнего дыхания и пробу с бронхолитиком.
Аллергологическое обследование включало два метода исследования: скарификационные кожные пробы (СКП) с микстами пыльцы растений и определение уровня специ-фических IgE (sIgE) к аллергенам пыльцы и домашней пыли. СКП проведены с использованием стандартных наборов серийных иммунобиологических диагностических средств производства Ставропольского НИИ вакцин и сывороток, включающих микст-аллергены из пыльцы деревьев (березы, дуба, клена, ольхи, орешника, ясеня), пыльцы луговых трав (ежи, костры, лисохвоста, мятлика, овсяницы, пырея, райграса, тимофеевки), пыльцы сор-ных трав (амброзии, лебеды, полыни, подсолнечника). Интерпретировали степень выраженности реакции в соответствии с инструкцией. Уровень общего IgE определяли иммунохемилюминисцентным методом на автоматическом анализаторе Immulite 2000 (DPC, США), а содержание sIgE — методом иммуноферментного анализа с помощью фотометра ImmunoChem 2100 (HTI, США) на базе централизованной клинико-диагностической лаборатории ГБУЗ ПК «Пермская краевая клиническая больница». Интерпретировали результаты лабораторной диагностики методом полуколичественной оценки (класс от 0 до 4).
Сведения о курении получали из данных медицинской карты об анамнезе и вредных привычках. Учитывали стаж курения и количество выкуренных сигарет в сутки.
Исследование одобрено локальным этическим комитетом ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России, протокол № 1 от 25.01.2023.
Для статистической обработки полученных данных использовали встроенный пакет анализа табличного процессора Excel 2016 MSO (Microsoft, США), авторский (В.С. Шелудько, 2001–2016) пакет прикладных электронных таблиц (ППЭТ) Stat 2015. Отдельные расчеты проводили с помощью статистической программы MedCalc 15.8 Portable (MedCalc Software, Бельгия, 1993–2014) [9, 10]. Количественные данные представлены в виде M±2m, где М — среднее арифметическое, m — ошибка репрезентативности; при отклонении данных от нормального распределения применялись медиана (Ме) и квартили [Q1; Q3]. Для сравнительного анализа количественных данных использовали U-критерий Манна — Уитни, для анализа качественных данных — критерии согласия Пирсона (χ2) и критерий Фишера. Для определения зависимости между двумя изучаемыми признаками использовали коэффициент парной корреляции признаков (RXY). Различие считали статистически значимым при p<0,05. Размер выборки предварительно не рассчитывали.
Результаты исследования
Среди 249 обследованных пациентов было 62 (24,9%) курящих. Средний возраст курящих составил 19,3±0,5 года, некурящих — 18,6±0,3 года. В группе курящих медиана стажа курения составила 2,0 [1,0; 4,0] года. Среди курящих 29 (46,8%) человек курили только традиционные сигареты (ТС), 23 (37,1%) пациента — только электронные сигареты (ЭС), 10 (16,1%) человек — ТС и ЭС. Среди курящих ТС медиана стажа курения составила 4,0 [3,0; 5,0] года, для ЭС — 1,0 [1,0; 1,0] год, для ТС и ЭС — 2,0 [1,3; 2,8] года. Интенсивность курения ТС составила 3,0 [2,0; 7,0] сигареты в день.
Сравнительный анализ установленных диагнозов аллергических заболеваний показал, что в группе курящих АР диагностирован у 59 (95,2%) пациентов, а в группе некурящих — у 178 (95,2%). Однако БА аллергического генеза преобладала у курящих пациентов по сравнению с некурящими — 58 (93,5%) и 167 (89,3%) соответственно (р=0,043, критерий Фишера). Сравнительный анализ степени тяжести аллергических заболеваний в группах курящих и некурящих не выявил статистически значимых различий по АР (р=0,758, χ2) и БА (р=0,758, χ2).
По данным лабораторного исследования у курящих и некурящих пациентов не установлено значимых различий абсолютного содержания эозинофилов в общем анализе периферической крови (р=0,749, U-критерий Манна — Уитни) и уровней общего IgE в сыворотке крови (р=0,809, U-критерий Манна — Уитни). Корреляционный анализ абсолютного содержания эозинофилов в общем анализе периферической крови и уровня общего IgE в сыворотке крови выявил прямую связь средней силы только в группе курящих пациентов (R=0,396 — умеренная зависимость, р=0,002).
Аллергологическое обследование методом СКП было проведено 42 курящим и 136 некурящим пациентам. Пыльцевая сенсибилизация определялась более чем у 80% курящих и 76–78% некурящих пациентов (рис. 1). Резко положительная реакция чаще встречалась на пыльцу деревьев в обеих группах. Статистически значимых различий по степени выраженности сенсибилизации между группами курящих и некурящих пациентов в пробах с микстами пыльцы деревьев (р=0,573, χ2), пыльцы луговых трав (р=0,743, χ2), пыльцы сорных трав (р=0,584, χ2) не выявлено.
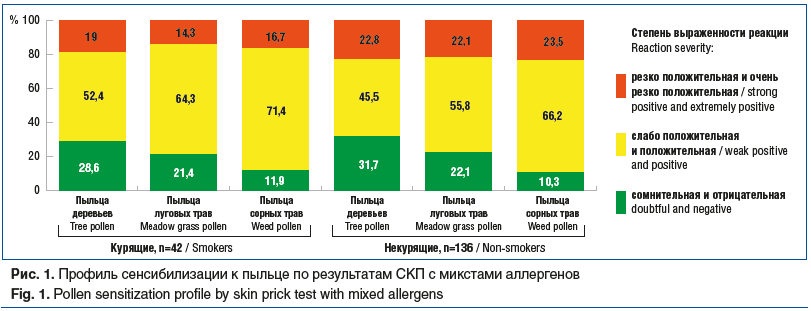
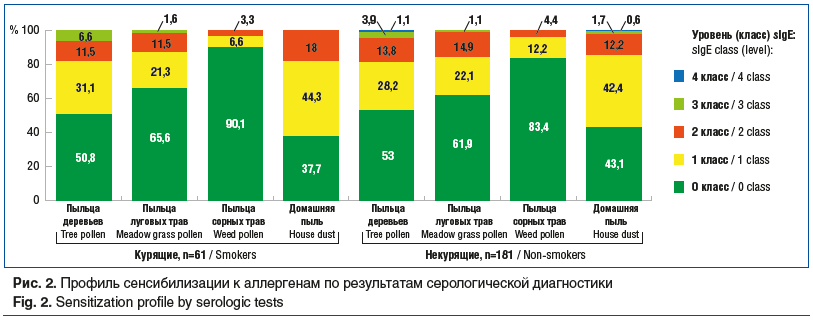
Содержание sIgE в сыворотке крови определяли у 61 курящего и 181 некурящего пациента. В обеих группах концентрация sIgE к пыльце деревьев и домашней пыли оказалась повышена (рис. 2). Не установлено статистически значимых различий между группами курящих и некурящих пациентов по содержанию sIgE к аллергенам пыльцы деревьев (р=0,778, χ2), пыльцы луговых трав (р=0,896, χ2), пыльцы сорных трав (р=0,424, χ2) и домашней пыли (р=0,583, χ2).
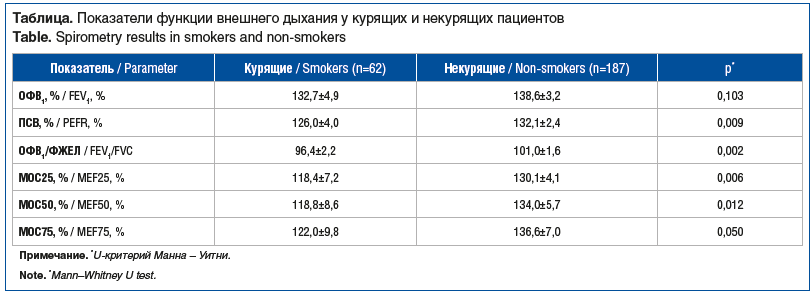
По данным исследования функции внешнего дыхания и пробы с бронхолитиком средние значения показателей спирометрии находились в пределах нормальных величин, но у некурящих пациентов средние значения пиковой скорости выдоха (ПСВ), ОФВ1 / форсированная жизненная емкость легких (ФЖЕЛ), максимальная объемная скорость при выдохе 25% ФЖЕЛ (МОС25), 50% ФЖЕЛ (МОС50), 75% ФЖЕЛ (МОС75) были выше, чем у курящих (см. таблицу). Для определения степени обратимости бронхиальной обструкции рассчитывали коэффициент бронходилатации по ОФВ1, его медиана составила 13% [7; 20] у курящих и 8% [4; 14,5] — у некурящих (р=0,003, U-критерий Манна — Уитни).
При оценке взаимосвязи абсолютного количества эозинофилов периферической крови и показателей функции внешнего дыхания установлена умеренная прямая связь с коэффициентом бронходилатации по ОФВ1 (R=0,346; р=0,0059) и обратная связь умеренной силы с ОФВ1/ФЖЕЛ (R=-0,318; р=0,0117) в группе курящих пациентов.
Обсуждение
Данные в отношении АР, полученные в ходе настоящего исследования, соответствуют результатам у других авторов. Так, в исследовании P.J. Bousquet et al. [11], включающем 1444 пациента, среди которых было 20,8% курящих и 10,9% бывших курильщиков, показано, что курение не влияло на развитие АР, не приводило к различию по степени выраженности назальных симптомов. Существует мнение, что курение связано с большей распространенностью хронического неаллергического ринита и меньшей распространенностью АР, это наблюдение подтверждено только у лиц мужского пола [12]. Однако в исследовании T. Songnuy et al. [13] показано, что воздействие табачного дыма способствует обострению АР. Именно поэтому, помимо оценки динамики выраженности назальных симптомов, необходимо оценивать и объем лечения курящего пациента в период обострения заболевания с учетом воздействия курения как триггера обострения.
В ряде исследований подтверждено, что курение сигарет — фактор риска развития БА у взрослых с АР [14, 15]. В нашем исследовании мы наблюдали преобладание БА среди курящих молодых мужчин (р=0,043). В этой связи может быть полезен анализ частоты, продолжительности обострений и использования медикаментов для купирования симптомов БА у курящих и некурящих пациентов.
Определение sIgE и СКП служат основными диагностическими инструментами для подтверждения сенсибилизации к аллергенам, предоставляя дополнительную, но не идентичную информацию, что мы и наблюдали в нашем исследовании. Результаты аллергологического обследования могут зависеть от пола, возраста и тяжести БА. Так, в работе H.R. Mohammad et al. [16] было продемонстрировано, что сила ассоциации между кожными пробами и клиническими проявлениями БА увеличивается с возрастом, но при этом наблюдается противоположная картина для sIgE. По мнению E.J Kim et al. [17], уровень общего IgE у мужчин выше, чем у женщин. Однако общий IgE нельзя считать надежным маркером аллергического заболевания. Концентрация общего IgE в сыворотке в значительной степени зависит от возраста, имеет тенденцию к нарастанию до 15-летнего возраста, затем снижается со 2-го по 8-е десятилетие жизни. Уровни общего IgE, значительно превышающие референсные значения, обычно связаны с атопическими расстройствами, но могут быть ассоциированы и с другими состояниями. Например, повышение концентрации общего IgE в сыворотке крови отмечается у части курильщиков [18]. Общий IgE следует интерпретировать с осторожностью, так как низкие или нормальные значения не исключают развитие IgE-опосредованных заболеваний [18]. В нашем исследовании стандартизация по полу позволила исключить влияние гендерного фактора на результаты аллергологического обследования. Мы не выявили различий по уровню общего IgE у курящих и некурящих молодых мужчин, но обнаружили связь между концентрацией общего IgE в сыворотке крови и абсолютным содержанием эозинофилов в общем анализе периферической крови у курящих пациентов. В исследовании R.M. Kumar et al. [19] продемонстрировали положительную корреляцию между общим количеством эозинофилов в крови и уровнем общего IgE в сыворотке крови при тяжелой персистирующей астме, но у авторов не было возможности оценить влияние курения на уровень общего IgE в сыворотке крови в разных группах, отличающихся по степени тяжести астмы, из-за недостатка курящих пациентов. В нашем исследовании пациентов с тяжелой персистирующей астмой не было.
В ходе аллергологического обследования курящих и некурящих пациентов различия по уровню сенсибилизации к аллергенам пыльцы и домашней пыли не выявлены. Подобные результаты показали C.E. Ciaccio et al. [20]: при исследовании совместного воздействия табачного дыма и комнатных аллергенов у детей не установлено значимого влияния табака на сенсибилизацию к аллергенам. В работе R.M. Gómez et al. [21] у курящих и некурящих пациентов с АР уровни общего IgE в сыворотке крови и чувствительность к аллергенам, подтвержденная с помощью кожных проб, не отличались. Однако исследование Y.S. Kim et al. [22] продемонстрировало связь между курением и повышенными уровнями общего IgE, sIgE к аллергенам клеща домашней пыли Dermatophagoides farinae, тараканов. Концентрация общего IgE и sIgE к данным аллергенам повышалась пропорционально увеличению количества сигарет, выкуриваемых ежедневно. В исследовании M. Jackson et al. [23] показано, что уровень общего IgE в плазме крови у пользователей ЭС был значительно повышен по сравнению с некурящими.
Количество эозинофилов в периферической крови стало многообещающим и легко измеряемым маркером эозинофильного воспаления дыхательных путей. Эозинофилия может быть важным фактором риска снижения дыхательной функции легких, что мы и наблюдали в нашем исследовании. У курящих молодых людей абсолютное количество эозинофилов периферической крови положительно коррелировало с коэффициентом бронходилатации по ОФВ1 и отрицательно коррелировало с ОФВ1/ФЖЕЛ. Результаты исследования H. Backman et al. [24] показали, что существует независимая связь между увеличением количества эозинофилов крови и снижением ОФВ1 у взрослых с БА. R.J. Hancox et al. [25] обнаружили, что у курильщиков абсолютное количество эозинофилов в крови выше по сравнению с некурящими. Кроме того, повышение количества эозинофилов коррелировало со снижением соотношения ОФВ1/ФЖЕЛ и значений ОФВ1 [25]. Однако в нашем исследовании у курящих и некурящих молодых людей различий по абсолютному количеству эозинофилов в крови не было.
Заключение
В проведенном сравнительном исследовании когорты курящих и некурящих молодых мужчин с АР и БА не было установлено значимых различий по степени тяжести аллергических заболеваний, степени сенсибилизации к аллергенам пыльцы и домашней пыли, количеству эозинофилов в периферической крови и содержанию общего IgE сыворотки крови. БА аллергического генеза преобладала у курящих пациентов. При исходно нормальных показателях спирометрии после проведения пробы с бронхолитиком в группе курящих пациентов установлен скрытый бронхоспазм, в группе некурящих пациентов не отмечалось превышения естественной вариабельности показателя ОФВ1. Только у курящих пациентов обнаружена умеренная прямая связь абсолютного количества эозинофилов в крови с коэффициентом бронходилатации по ОФВ1.
1. Приказ Министерства здравоохранения РФ от 27 мая 2022 г. No 358н «Об утверждении стандарта медицинской помощи взрослым при бронхиальной астме (диагностика и лечение)».
Сведения об авторах:
Девяткова Елизавета Андреевна — аспирант кафедры педиатрии ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России; 614990, Россия, г. Пермь, ул. Петропавловская, д. 26; ORCID iD 0000-0003-4754-2862.
Минаева Наталия Витальевна — д.м.н., профессор кафедры педиатрии с курсом клинической педиатрии ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России; 614990, Россия, г. Пермь, ул. Петропавловская, д. 26; ORCID iD 0000-0002-2573-9173.
Тарасова Мария Васильевна — к.м.н., главный внештатный специалист аллерголог-иммунолог, заведующая отделением аллергологии и иммунологии ГБУЗ ПК «Пермская краевая клиническая больница»; 614006, Россия, г. Пермь, ул. Ленина, д. 51; ORCID iD 0000-0002-5237-9863.
Шелудько Валерий Степанович — к.м.н., ведущий научный сотрудник центральной научно-исследовательской лабораторииФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России; 614990, Россия, г. Пермь, ул. Петропавловская, д. 26; ORCID iD 0000-0002-7080-9142.
Плотникова Екатерина Юрьевна — д.м.н., профессор, профессор кафедры поликлинической терапии, постдипломной подготовки врачей и сестринского дела, руководитель курса клинической гастроэнтерологии ФГБОУ ВО КемГМУ Минздрава России; 650022, Россия, г. Кемерово, ул. Ворошилова, д. 22а; научный руководитель Кузбасского областного гепатологического центра ГАУЗ ККБСМП; 650000, Россия, г. Кемерово, ул. Н. Островского, д. 22; ORCID iD 0000-0002-6150-1808.
Контактная информация: Девяткова Елизавета Андреевна, e-mail: lizadev94@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.04.2023.
Поступила после рецензирования 28.04.2023.
Принята в печать 26.05.2023.
About the authors:
Elizaveta A. Devyatkova — postgraduate student of the Department of Pediatrics with the Course of Polyclinical Pediatrics, Academician E.A. Vagner Perm State Medical University; 26, Petropavlovskaya str., Perm, 614990, Russian Federation; ORCID iD 0000-0003-4754-2862.
Nataliya V. Minaeva — Dr. Sc. (Med.), professor of the Department of Pediatrics with the Course of Polyclinical Pediatrics, Academician E.A. Vagner Perm State Medical University; 26, Petropavlovskaya str., Perm, 614990, Russian Federation; ORCID iD 0000-0002-2573-9173.
Mariya V. Tarasova — C. Sc. (Med.), chief freelance allergist and immunologist, Head of the Department of Allergy and Immunology, Perm Regional City Hospital; 51, Lenin str., Perm, 614006, Russian Federation; ORCID iD 0000-0002-5237-9863.
Valeriy S. Shelud’ko — C. Sc. (Med.), leading researcher of the Central Research Laboratory, Academician E.A. Vagner Perm State Medical University; 26, Petropavlovskaya str., Perm, 614990, Russian Federation; ORCID iD 0000-0002-7080-9142.
Ekaterina Yu. Plotnikova — Dr. Sc. (Med.), Professor, professor of the Department of Polyclinic Therapy, Postgraduate Training for Doctors and Nursing, Head of the Course of Clini-cal Gastroenterology, Kemerovo State Medical University; 22A, Voroshilov str., Kemerovo, 650029, Russian Federation; Scientific Director of the Kuzbass Regional Hepatological Center, M.A. Podgorbunskiy Kuzbass Clinical Hospital for Emergency Medical Aid; 22, N. Ostrovskiy str., Kemerovo, 650000, Russian Federation; ORCID iD 0000-0002-6150-1808.
Contact information: Elizaveta A. Devyatkova, e-mail: lizadev94@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.04.2023.
Revised 28.04.2023.
Accepted 26.05.2023.
Информация с rmj.ru
