Введение
Опухоль Вильмса (нефробластома, НБ) названа по фамилии немецкого хирурга Макса Вильмса, впервые описавшего заболевание в конце XVIII в. Точные причины возникновения НБ не установлены. Большинство исследователей полагают, что опухоль возникает из аномально пролиферирующей метанефрогенной бластемы (персистирующая нефрогенная бластема, нефрогенные остатки, nephrogenic rests) [1, 2]. По частоте встречаемости у детей и подростков ренальные опухоли занимают 4-е место и следуют после гемобластозов, опухолей центральной нервной системы и лимфом, незначительно опережая по частоте опухоли мягких тканей и костей. В целом известно, что злокачественность опухолей почек определяется стремительностью их роста и развития метастазов. НБ — относительно редкая опухоль почки, которая отличается клиническим полиморфизмом. Именно поэтому необходима систематизация различных специфических и неспецифических признаков НБ для оптимизации диагностики. По данным литературы, около 7% всех детских онкологических заболеваний составляют опухоли почек [1–3], при этом почти 90% среди всех ренальных опухолей приходится на НБ [4, 5]. В России, при общей первичной онкологической заболеваемости приблизительно 15 случаев на 100 тыс. детского населения в год, выявляемость ренальных опухолей составляет от 0,4 до 1,0 на 100 тыс. детского населения (в среднем 0,6 на 100 тыс.) [1, 3]. В Европе показатель заболеваемости опухолями почек у детей составляет 0,88 на 100 тыс. детского населения в год. Детский раковый регистр (г. Майнц, Германия) ежегодно регистрирует около 100 новых случаев НБ у детей и подростков в возрасте от 0 до 14 лет. Средний показатель в таких странах, как Финляндия, Швеция, США, Австралия, Италия, Голландия и Великобритания, достигает 0,7 на 100 тыс. детей в год. При этом наибольшее число вновь выявляемых пациентов зарегистрировано в Финляндии (0,95 на 100 тыс.), а наименьшее — в Великобритании (0,51 на 100 тыс.) [6–8]. Наиболее часто НБ диагностируют в возрасте от 2 до 5 лет (75% случаев) [6, 7], редко — у взрослых (0,2 на 1 млн населения в год) [8]. Существенных гендерных различий заболеваемости не установлено, хотя известно, что девочки болеют незначительно чаще, чем мальчики. Как правило, НБ возникает спорадически, но в 2% наблюдений заболевание носит семейный характер. Редко наблюдается двустороннее поражение почек (билатеральная НБ), которое регистрируют в 4–10% всех случаев НБ у детей [3, 7, 9]. В 5–12% случаев НБ сочетается с врожденными аномалиями развития [1, 3, 7, 9].
В детском и подростковом возрасте диагностируют и более редкие и малоизученные опухоли почки. Однако подходы к диагностике и лечению этих опухолей не отличаются от таковых при НБ. Эти случаи также регистрируются в отделе клинических исследований по НБ Международного общества детских онкологов (The International Society of Paediatric Oncology, SIOP) [2, 5, 10], поскольку они предоставляют полезные сведения для понимания природы ренальных опухолей в целом.
В мировой практике накоплен огромный опыт изучения ренальных опухолей у детей в целом и НБ в частности. Результаты лечения опухолей этой локализации во всем мире свидетельствуют о его растущей эффективности и улучшении прогноза, что происходит во многом благодаря тесному сотрудничеству между многопрофильными командами различных стран. На сегодняшний день в мире тактические подходы к изучению и лечению НБ определяют две крупнейшие научные группы: Национальная исследовательская группа по опухоли Вильмса (NWTS) в Северной Америке и SIOP с международным участием [2, 3, 6, 9]. NWTS рекомендует первичную операцию перед любым адъювантным лечением, в то время как лечение, рекомендованное SIOP, основано на использовании предоперационной химиотерапии [9]. В то же время выявление новых молекулярных, гистологических и клинических признаков, поиск биомаркеров для стратификации интенсивности лечения по-прежнему остаются важными задачами, стоящими перед научным сообществом [8, 10]. В настоящее время данные о клинических особенностях опухолей почек многообразны, но не всегда структурированы, не обозначены наиболее частые симптомы, что не позволяет обсуждать симптомокомплексы с учетом современных диагностических подходов к верификации данной патологии.
Диагностика опухолей почек учитывает как клинические критерии, так и данные инструментальных и лабораторных методов исследования. К специфическим клиническим симптомам относят увеличение объема живота и пальпируемую опухоль [11]. Неспецифические клинические признаки более разнообразны. К ним относят боли в животе, запоры, повышение артериального давления, тошноту, рвоту, метеоризм, нарушение аппетита, похудание, задержку физического развития, интоксикацию, гиповитаминоз, лихорадку, дизурию, раздражительность, плаксивость, астению. Возможно сочетание с врожденными пороками развития (ВПР) (аниридия, гемигипертрофия, урогенитальные пороки, аномалии опорно-двигательного аппарата, в том числе косолапость, удвоение ребер, врожденный вывих бедра) [12, 13] и генетическими синдромами (синдром Дениса — Драша, WAGR-синдром или синдром Беквита — Видемана) [6, 14]. Специфические признаки по данным инструментальных и лабораторных методов обследования включают объемные образования и ВПР почек, обнаруженные с помощью различных методов визуализации, микрогематурию; к неспецифическим симптомам относят макрогематурию, лейкоцитурию, протеинурию, бактериурию, анемию, лейкоцитоз, увеличение скорости оседания эритроцитов (СОЭ) [5, 10, 12–14].
По данным европейских центров, 5-летняя выживаемость детей с НБ в 1988–1997 гг. составляла 85% и варьировала от 73 на востоке до 91% на севере Европы. Для пациентов, у которых заболевание было диагностировано в возрасте от 0 до 3 лет, прогноз был более благоприятный (5-летняя выживаемость 87%), чем для пациентов старшего возраста (81%). Пятилетняя выживаемость для светлоклеточной саркомы почек составила 68% [3, 7, 9, 10]. Общая 5-летняя выживаемость пациентов, получавших лечение на основе протокола SIOP 2001/GPOH с начала 2000-х годов до настоящего времени, в группе низкого риска приближается к 100%, в группе среднего риска составляет: при I стадии — 98,4%; при II стадии — 97%; при III стадии — 92%; при IV стадии — 77%; в группе высокого риска: при I стадии — 82%; при II стадии — 72%; при III стадии — 64%; при IV стадии — 33%. Общая выживаемость пациентов с V стадией (билатеральный процесс) составляет около 78% в течение 5 лет при условии, что образование в каждой почке соответствует I или II стадии [3, 14].
Цель исследования: на основе современных диагностических подходов к верификации опухолей почек представить данные об их клинических особенностях и ведущих симптомокомплексах на этапе обследования в специализированном отделении стационара III уровня оказания медицинской помощи.
Содержание статьи
Материал и методы
В исследование включены 57 пациентов с ренальными опухолями, госпитализированных для обследования и лечения в онкогематологическое отделение КГБУЗ КККЦОМД с 2011 по 2021 г. Все пациенты проживали на территории Красноярского края.
Проанализирована медицинская документация и получены сведения в соответствии с протоколом исследования: паспортные данные, анамнез, жалобы, данные физикального осмотра, результаты лабораторных и инструментальных исследований, данные визуализирующих методов обследования (компьютерная томография (КТ), ультразвуковое исследование (УЗИ)), сведения о виде и объеме хирургического вмешательства, гистологические и иммуногистохимические заключения. Диагностические и лечебные методики применяли согласно клиническим рекомендациям и современным международным протоколам ведения пациентов с ренальными опухолями (главным образом, SIOP 2001).
Для статистической обработки данных использовали медиану и квартили (Me [Q1; Q3]), указывали абсолютную (n) и относительную (%) частоту проявления признаков.
Результаты исследования
Обнаружение плотного безболезненного объемного образования с гладкой (иногда с неровной) поверхностью в животе у ребенка родителями или педиатром во время осмотра рассматривается как значимое спе-цифическое клиническое проявление НБ [11]. По нашим данным, увеличение живота и наличие пальпируемой опухоли (специфический симптом) наблюдались у 38 (82%) детей и были наиболее частыми первыми проявлениями заболевания (табл. 1).
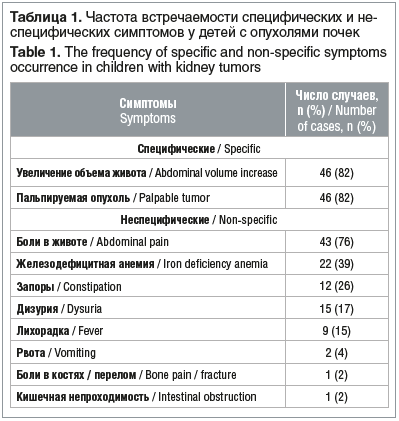
Неспецифические клинические проявления различны, но в комплексной оценке могут приобретать диагностическую значимость. Нередко ребенок жалуется на боли в животе, причиной которых может быть давление опухоли на окружающие органы либо прорастание опухоли в диафрагму, печень или забрюшинную клетчатку [1]. Наряду с этим наблюдаются диспепсия, запоры, тошнота, рвота, снижение аппетита. Возможны гипертермия, связанная с инфекцией мочевыводящих путей, общие симптомы интоксикации, похудание. Достаточно часто можно выявить вторичную артериальную гипертензию, которая развивается вследствие гиперренинемии и вазоконстрикции или распространения опухолевого тромба в нижнюю полую вену вплоть до правого предсердия [1, 6]. Изменяется поведение ребенка, который становится раздражительным, плаксивым, быстро устает, теряет интерес к окружающей жизни. Синдром астении с проявлениями гиподинамии, охватывая не только эмоциональную сферу, но и мышечную систему, сопровождается снижением мышечной силы, двигательной активности [3, 9]. Специфические и неспецифические проявления НБ в нашем исследовании в целом совпадают с данными литературы [1, 3, 4, 6], которые описывают значительное клиническое многообразие неспецифических проявлений НБ. Среди неспецифических начальных проявлений обращает на себя особое внимание значительная частота болей в животе, анемии, запоров, дизурии и лихорадки.
Первичная диагностика опухоли предполагает комплексный подход, направленный, кроме всего прочего, на выявление сопутствующих заболеваний, а также исключение другой патологии почек (пороки развития почки, гидронефроз, нейрогенные опухоли), других опухолей забрюшинного пространства, опухолей печени, гамартом [2, 4]. Сопутствующая патология у пациентов с ренальными опухолями к моменту госпитализации не имела значимых особенностей в сравнении с общепопуляционными данными (табл. 2) [1, 2, 5, 6].
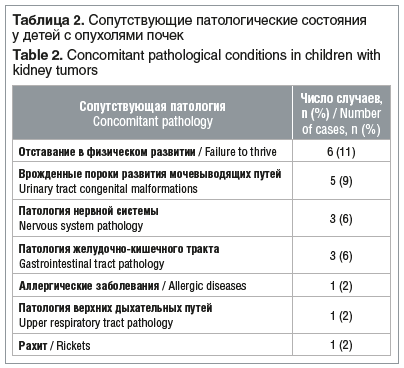
Врожденные пороки развития мочевыводящих путей диагностированы у 5 (9%) пациентов (2 случая аплазии левой почки в сочетании с аплазией матки, придатков, пузырно-мочеточниковый рефлюкс 3–4-й степени, гидронефроз и подковообразная почка). Существенных нарушений соматического статуса детей с НБ не установлено.
Наряду с клиническими особенностями НБ уточнялись признаки опухоли по данным УЗИ, КТ или магнитно-резонансной томографии (МРТ). В настоящем исследовании наличие опухоли подтверждено по данным УЗИ у всех 57 пациентов. Эхографические особенности опухолей представлены в таблице 3.

В последние годы в диагностике НБ широко применяется КТ брюшной полости. МРТ применяется реже, поскольку не превосходит по информативности КТ. В то же время данные КТ или МРТ, с учетом особенностей методов, имеет преимущество перед УЗИ, позволяя с большей информативностью и достоверностью установить степень вовлечения ткани почки, ее капсулы, лимфатических узлов в процесс, прорастание околопочечной клетчатки, сосудов, мочеточников, инфильтрацию смежных органов. В нашем исследовании данные КТ или МРТ о вовлеченности одной или двух почек полностью совпали с оценкой по данным УЗИ. Вместе с тем данные КТ показали более высокую точность по сравнению с УЗИ при оценке объема почки, вовлеченного в опухолевый процесс (распространение опухоли за пределы одного сегмента диагностировано у 42 детей по данным КТ против 37 по данным УЗИ). Кроме того, данные КТ позволили правильно оценить стадию опухолевого поражения для планирования необходимого объема лечения (табл. 4). Именно поэтому обязательным условием современного качественного обследования служит выполнение КТ с контрастным усилением. Накопление специфического контраста подтверждает наличие опухолевой ткани, равномерность накопления указывает на большую плотность сосудов новообразования, а интенсивность — на активность локального кровотока, что косвенно указывает на активность опухоли.

По данным КТ или МРТ до начала специальной терапии медиана объема опухоли в рассматриваемой выборке составила 375 мл. Распределение пациентов с учетом различий объема опухолевой ткани (в заданных интервалах) представлено в таблице 5.
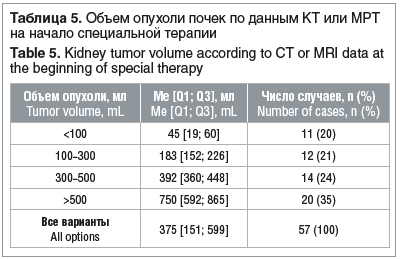
Реже всего обнаруживали опухоли объемом менее 100 мл. Опухоли такого размера чаще всего являются клинической находкой, а пациенты, как правило, не предъявляют значимых жалоб. Наиболее часто диагностировали опухоли объемом свыше 500 мл, что объясняет взаимо-связь опухоли большого размера со специфическими и неспецифическими клиническими проявлениями заболевания и данными лабораторных и инструментальных методов исследования (риск развития инфекций мочевыводящих путей, задержка физического развития, диспепсия, анемия, астенический синдром и т. д.). Нередко опухоль объемом более 500 мл диагностируется как III стадия заболевания с отдаленными метастазами.
Данные о метастазировании, полученные с использованием методов визуализации (сцинтиграфия костей, УЗИ, КТ, МРТ органов брюшной полости и забрюшинного пространства, органов грудной клетки, головного мозга), а также лабораторных исследований цитологии костного мозга, представлены в таблице 6. Метастазы были обнаружены у 24% детей на этапе уточняющей диагностики, при этом у каждого ребенка диагностированы метастазы нескольких локализаций. Наиболее часто отдаленные метастазы обнаруживали в легких.

Обсуждение
Несмотря на значительные достижения в изучении опухолей почек, в том числе НБ, у детей, эта проблема сохраняет актуальность и важность для здравоохранения. Необходимы поиск наиболее достоверных и быстрых путей для своевременной диагностики заболевания, обеспечение оптимальной интенсивности лечения при одновременном снижении токсического действия терапии, определение и минимизация рисков рецидивов и продолженного роста и в конечном счете оптимизация и увеличение сроков бессобытийной выживаемости пациентов.
Ренальные опухоли длительное время могут протекать бессимптомно. Раньше всего родственники ребенка или педиатр во время планового осмотра обнаруживают в животе у ребенка плотное, безболезненное объемное образование с гладкой (иногда с неровной) поверхностью. Таким образом, увеличение объема живота и пальпируемая опухоль, несомненно, наиболее значимые специфические клинические проявления НБ [1, 2, 4, 11, 12].
Начальные неспецифические проявления разнообразны. Особое внимание следует уделить жалобам на частые боли в животе, рвоту, тенденции к задержкам стула, дизурии и лихорадке, а также отставанию в физическом развитии, нарушению эмоциональной сферы, астенизации. Указанные симптомы в совокупности с микро- и макрогематурией, лейкоцитурией, протеинурией, бактериурией, анемией, лейкоцитозом, повышением СОЭ дают значимую диагностическую информацию, которая при наличии специфических симптомов определяет необходимость специфической диагностики. В диагностике следует обращать внимание на анамнез. Пороки развития мочеполового тракта, генетические синдромы, а также множественные стигмы дисэмбриогенеза часто сопровождают НБ. Учитывая полученные нами данные, считаем целесообразным выделение клинического симптомокомплекса, который должен стать тревожным сигналом на этапе догоспитального обследования, а в сочетании со специфическими симптомами (увеличение живота и пальпируемое опухолевидное образование) рассматриваться как указание на высокую вероятность ренальной опухоли, что важно для последующей оптимизации специализированной диагностики, в первую очередь для использования визуализирующих методов и сокращения сроков до начала специализированного лечения.
Для визуализации опухоли на скрининговом этапе необходимо проведение УЗИ. Этот доступный и в то же время высокоинформативный метод позволяет достоверно подтвердить факт наличия опухолевой массы и уточнить локализацию образования. УЗИ органов брюшной полости и забрюшинного пространства — первоочередное и необходимое исследование во всех случаях подозрения на наличие объемного образования в животе у детей. КТ или, реже, МРТ брюшной полости и забрюшинного пространства с контрастным усилением или без такового — следующий, детализирующий шаг для определения характеристик опухолевого процесса и вовлечения структур почки, прилежащих и удаленных тканей и органов. Для детальной диагностики при необходимости используют сцинтиграфию костей с технецием, позитронно-эмиссионную КТ, МРТ головного мозга, костей, трепанобиопсию костей, цитологическое исследование. Таким образом возможно оценить поражение не только органов брюшной полости и забрюшинного пространства, но и органов грудной клетки, головного мозга, костей, а также костного мозга. Указанный объем обследования необходим в целях дооперационной диагностики первичной опухоли и метастатических очагов.
Выводы
-
Специфические симптомы (пальпируемая опухоль и увеличение объема живота) в комбинации с неспецифическими проявлениями (боли в животе, анемия, запоры, дизурия и лихорадка) позволяют обозначить ведущий клинический симптомокомплекс, который определяет необходимость дообследования в специализированном онкогематологическом отделении.
-
Из сопутствующих состояний на этапе предоперационной диагностики наиболее часто встречаются задержка физического развития (11%) и врожденные пороки развития мочевыводящих путей (9%).
-
Среди методов визуализации УЗИ обязательно для первичной диагностики; на этапе специализированного обследования КТ или МРТ с контрастным усилением расширяют диагностические возможности, позволяют уточнить объем тканей, вовлеченной в опухолевый процесс, оценить стадию опухолевого поражения, а также наличие отдаленных метастазов и планировать необходимый объем лечебной программы.
-
Чаще всего обнаруживали опухоли объемом свыше 500 мл (35% всех случаев); важно, что опухоли небольшого размера (до 100 мл) регистрировались лишь у 20% детей (у каждого 5-го пациента). Средний объем опухолевой массы к моменту операции составил 375 [151; 599] мл.
-
Отдаленные метастазы обнаружены у 14 (24%) пациентов. Самая частая органная принадлежность метастазов — легкие (7 (13%) случаев).
Сведения об авторах:
Карваева Елена Александровна — детский онколог, гематолог отделения онкологии и гематологии КГБУЗ КККЦОМД; 660074, Россия, г. Красноярск, ул. Академика Киренского, д. 2А; ORCID iD 0000-0002-8835-2806.
Таранушенко Татьяна Евгеньевна — д.м.н., заслуженный врач РФ, главный детский эндокринолог Минздрава Красноярского края; профессор, заведующая кафедрой педиатрии Института постдипломного образования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ведущий консультант, член общественного совета КГБУЗ КККЦОМД; 660074, Россия, г. Красноярск, ул. Академика Киренского, д. 2А; ORCID iD 0000-0003-2500-8001.
Борисова Марина Васильевна — к.м.н., главный внештатный детский онколог-гематолог Минздрава Красноярского края, заведующая отделением онкологии и гематологии КГБУЗ КККЦОМД; 660074, Россия, г. Красноярск, ул. Академика Киренского, д. 2А; доцент кафедры детских болезней ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660074, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0003-4338-4940.
Контактная информация: Караваева Елена Александровна, е-mail: pasharina@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 25.04.2023.
Поступила после рецензирования 23.05.2023.
Принята в печать 16.06.2023.
About the authors:
Elena A. Karavaeva — pediatric oncologist, hematologist, Department of Oncology and Hematology, Krasnoyarsk Regional Clinical Center for Maternal and Child Welfare; 2А, Akademika Kirenskogo str., Krasnoyarsk, 660074, Russian Federation; ORCID iD 0000-0002-8835-2806.
Tatyana E. Taranushenko — Dr. Sc. (Med.), Honored Doctor of the Russian Federation, Chief Pediatric Endocrinologist of the Ministry of Health of the Krasnoyarsk Territory; Professor, Head of the Department of Pediatrics of the Institute of Postgraduate Education, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; Lead Consultant, Member of the Public Council of the Krasnoyarsk Regional Clinical Center for Maternal and Child Welfare; 2А, Akademika Kirenskogo str., Krasnoyarsk, 660074, Russian Federation; ORCID iD 0000-0003-2500-8001.
Marina V. Borisova — C. Sc. (Med.), Chief Consultant pediatric oncologist-hematologist of the Ministry of Health of the Krasnoyarsk Territory, Head of the Department of Oncology and Hematology, Krasnoyarsk Regional Clinical Center for Maternal and Child Welfare; 2А, Akademika Kirenskogo str., Krasnoyarsk, 660074, Russian Federation; Associate Professor of the Department of Children’s Diseases, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0003-4338-4940.
Contact information: Elena A. Karavaeva, e-mail: pasharina@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 25.04.2023.
Revised 23.05.2023.
Accepted 16.06.2023.
Информация с rmj.ru





