Введение
Дивертикулярная болезнь (ДБ) рассматривается сегодня как одна из болезней цивилизации, ассоциированных с западным стилем питания, дефицитом потребления пищевых волокон, модуляцией микробиома пищеварительного тракта, ожирением, низким уровнем физической активности, курением. Широкое распространение факторов риска и накопление в популяции генетических мутаций, способствующих формированию ДБ, обеспечили неуклонный рост частоты встречаемости заболевания среди населения.
Термин ДБ рекомендуется использовать как обобщающий для различных клинических форм заболевания.
Дивертикулярная болезнь толстой кишки — обобщающий термин, включающий в себя такие понятия, как дивертикулез, симптоматическая неосложненная ДБ (СНДБ), симптоматическая осложненная ДБ (СОДБ) и дивертикулярное кровотечение.
Дивертикулез характеризуется наличием дивертикулитов и сопутствием каких-либо симптомов, причиной которых могут быть дивертикулы.
Симптоматическая неосложненная ДБ характеризуется наличием дивертикулов, клинической симптоматики, которая может быть связана с наличием дивертикулов в кишке и отсутствием макроскопических признаков воспалительного процесса или кровотечений.
Симптоматическая осложненная ДБ характеризуется наличием дивертикулов, клинической симптоматики, которая может быть связана с наличием дивертикулов в кишке, и макроскопических признаков воспалительного процесса — дивертикулита (воспаление одного или нескольких дивертикулов) или кровотечения.
Сообщается, что самые высокие показатели заболеваемости дивертикулезом регистрируются в США и Канаде, достигая 50% среди лиц в возрасте 60 лет и старше [1]. В западных странах дивертикулез в 90% случаев выявляется в сигмовидной или левой ободочной кишке («западный» тип дивертикулеза), тогда как в Японии и Южной Корее дивертикулез в 75–85% случаев диагностируется в восходящей или правой ободочной кишке («восточный» тип дивертикулеза). По данным отдельных эпидемиологических наблюдений, СНДБ развивается примерно у 25% пациентов с дивертикулезом [2], а у 12% пациентов с СОДБ наблюдается прогрессирование заболевания с развитием острых и хронических осложнений дивертикулита. Абсцесс и флегмона являются наиболее частыми осложнениями, на их долю приходится до 70% всех осложнений при СОДБ. Реже развиваются перфорации, перитонит, свищи и стриктуры [3]. Частота выявления ДБ на территории Российской Федерации, согласно обновленным российским клиническим рекомендациям по диагностике и лечению ДБ (2023 г.) [4], также увеличивается в последние десятилетия. В частности, в 2002–2004 гг. частота выявления ДБ составляла 15,7% (по данным Центрального научно-исследовательского института гастроэнтерологии), а в 2008–2013 гг. уже достигала 17,6–22,6% (по данным НМИЦ колопроктологии им. А.Н. Рыжих). Наблюдаемая тенденция к росту числа новых случаев ДБ подчеркивает актуальность изучения методов диагностики, лечения и мер профилактики развития осложнений заболевания.
Содержание статьи
Эпигенетические факторы риска ДБ
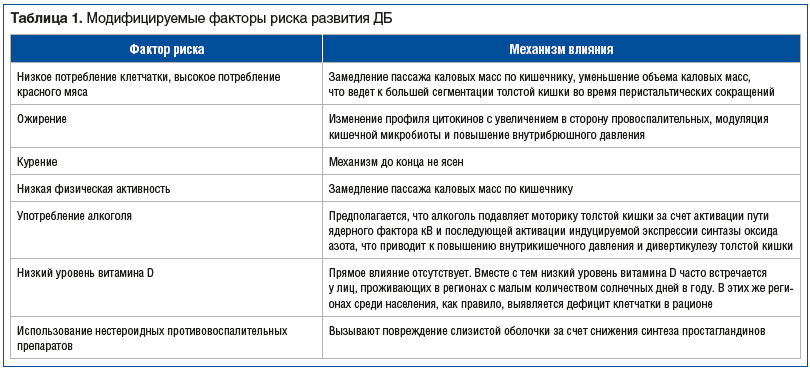
Среди факторов риска, предрасполагающих к формированию ДБ, выделяют модифицируемые: низкое потребление клетчатки, избыточная масса тела, гиподинамия, курение и др. (табл. 1) [3, 5, 6], а также немодифицируемые: мужской пол и возраст. Как правило, распространенность дивертикулеза очень низкая у лиц <40 лет и высокая у лиц >65 лет, хотя в настоящее время наблюдается рост заболеваемости и среди молодых людей [2].
Генетические факторы риска ДБ
В последние годы большое внимание отводится изучению генетических факторов и условий их реализации при ДБ. На сегодняшний день известно 48 локусов, ассоциированных с развитием заболевания [7], при этом 4 гена показали наиболее сильное влияние на развитие дивертикулита (PHGR1, FAM155A-2, CALCB и S100A10). Предполагается, что ген PHGR1 способен увеличивать риск дивертикулита за счет повышения эпителиальной проницаемости с последующей транслокацией условно-патогенных и патогенных бактерий, способных вызывать воспаление слизистой оболочки толстой кишки. Ген CALCB опосредует развитие нарушений моторики кишечника, а ген S100A10 — ремоделирование внеклеточного матрикса и структурную слабость дивертикула [8].
Патогенез ДБ: от формирования дивертикулов до осложненного течения заболевания. Роль кишечной микробиоты
Существует ряд патогенетических механизмов, обусловленных взаимодействием факторов внешней среды и генетической предрасположенности, которые приводят к развитию ДБ (рис. 1). Значимым механизмом патогенеза является изменение механических свойств соединительной ткани, а именно нарушение синтеза эластина (его повышение), что приводит к усилению гаустрации и повышению спастической готовности толстой кишки, и, как следствие, к увеличению внутрипросветного давления [2, 9]. Помимо изменения механических свойств соединительной ткани у пациентов с дивертикулезом наблюдаются нарушение регуляции перистальтической активности толстой кишки, снижение способности продольных мышц расслабляться после сокращения. В таких условиях даже в ответ на незначительное раздражение толстая кишка реагирует хаотичными сокращениями перемешивающего типа, в результате чего формируются короткие замкнутые сегменты с повышенным внутрипросветным давлением. Дополнительным механизмом формирования нарушения двигательной моторики толстой кишки является снижение числа клеток Кахаля (основных пейсмейкеров моторики) и уменьшение количества нейронов в интрамуральных ганглиях, что, в свою очередь, усиливает выраженность двигательных нарушений, замыкая порочный круг [10]. Так, установлено, что число клеток Кахаля в толстой кишке уменьшается с возрастом со скоростью 13% за десятилетие жизни [11], вероятно, это и объясняет риск максимальной распространенности ДБ в возрасте >65 лет. Описанные механизмы, приводящие в конечном итоге к повышению внутрипросветного давления, обусловливают пролапс слизистой оболочки через слабые участки кишечной стенки (места прохождения сквозь нее сосудов) с формированием мешотчатого образования — дивертикула, который образован слизистой оболочкой, тонким слоем соединительной ткани из дегенерированных мышечного и подслизистого слоев. Как правило, это форма ДБ протекает бессимптомно [2, 12].
![Рис. 1. Патогенетические механизмы ДБ (адаптировано по [2]) Рис. 1. Патогенетические механизмы ДБ (адаптировано по [2])](https://medblog.su/wp-content/uploads/2023/07/1689255719_41_Divertikulyarnaya-bolezn-mikrobiota-v-fokuse-vnimaniya-klinitsista-Livzan-MA.png)
Микробиота кишечника представляет собой совокупность комменсальных микроорганизмов, способствующих поддержанию гомеостаза и правильному функционированию пищеварительного тракта. Состав микробиоты кишечника представлен семью основными филотипами (Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Verrucomicrobia, Fusobacteria, Euryarchaeota), основными представителями которых являются Bifidobacteria, Atopobium, Lactobacillus, Bacteroides spp., в том числе Bacteroides fragilis, Bacteroides thetaiotaomicron, Parabacteroides, Prevotella, Alistipes spp., Faecalibacterium prausnitzii, Blautia, Dorea, Ruminococcus, Roseburia, Coprococcus, Clostridium spp. (кроме C. perfringens, C. botulinum), Enterococcus, Escherichia coli, Akkermansia spp., Methanobrevibacter smithii [13–16].
Микробиота кишечника выполняет важные для организма функции, такие как пищеварительная (ферментация пищевых волокон, обмен желчных кислот), иммунная (формирование лимфоидного аппарата кишечника, предотвращение повреждения эпителия и бактериальной транслокации), метаболическая (эндогенный синтез витаминов группы В, К, короткоцепочечных жирных кислот) и дезинтоксикационная (инактивация токсинов, чужеродных химических веществ) [17, 18].
Нарушение разнообразия и количественного состава популяций кишечной микробиоты может играть роль в формировании и персистенции симптомов ДБ вследствие уменьшения продукции короткоцепочечных жирных кислот, обеспечивающих трофику эпителиоцитов, что способствует повышению эпителиальной проницаемости кишечника с формированием воспаления низкой степени градации и, как следствие, формированию дистрофии и дисмоторики мышечной стенки толстой кишки. Параллельно возникает дисрегуляция активности тучных клеток с высвобождением гистамина, протеаз, серотонина, которые вызывают спазм гладкой мускулатуры кишечника и усугубляют течение заболевания. О роли микробиоты в патогенезе ДБ говорит и тот факт, что большинство осложнений имеют бактериальное происхождение и, как правило, хорошо отвечают на терапию, направленную на подавление роста патогенной и условно-патогенной микрофлоры. Имеются данные, свидетельствующие об уменьшении представительства Bacteroidetes, Clostridium cluster IV и IX, Fusobacterium, Lactobacillaceae и других бактериальных штаммов с потенциальными противовоспалительными свойствами или продуцентов короткоцепочечных жирных кислот при всех формах ДБ [19], а также увеличении численности Roseburia hominis и Akkermansia muciniphil [20]. Кроме того, при осложненном течении ДБ отмечается увеличение количества всех типов кишечных бактерий, в том числе Firmicutes при СНДБ, Proteobacteria при остром дивертикулите [21, 22]. Стоит отметить, что роль микробиоты по-прежнему считается актуальной и требует активного изучения.
Симптоматически неосложненная ДБ возникает из-за изменения состава кишечной микробиоты, ведущего к хроническому воспалению низкой степени активности в слизистой оболочке. Так, у пациентов с СНДБ наблюдается повышенная экспрессия маркеров воспаления, включая основной фактор роста фибробластов-b и синдекан-1 [23], а также значительная активация нейропептида нейрокинина-1 [24] по сравнению с пациентами с дивертикулезом. Описанные изменения приводят к прорастанию нервных окончаний с формированием феномена висцеральной гиперчувствительности, схожей с таковой при синдроме раздраженного кишечника [1].
В основе развития дивертикулита лежат воспалительные изменения в стенке дивертикула, вызванные застоем кишечного содержимого в дивертикуле. При этом задержка эвакуации содержимого из тела дивертикула через его узкую шейку приводит к образованию плотного комка, называемого фекалитом, который усугубляет микробный дисбиоз, ведет к локальной ишемии тканей и повышает риск микроперфорации [3, 10]. Клинически острый дивертикулит проявляется основной триадой симптомов: усилением боли в животе, лихорадкой и повышением уровня сывороточных маркеров воспаления (лейкоциты, С-реактивный белок) [25–27]. Хронические формы дивертикулита проявляются в виде вялотекущего процесса с образованием или без образования фибростенотических стриктур [25]. Считается, что у пациентов, перенесших эпизод дивертикулита, увеличивается риск развития синдрома раздраженного кишечника [19] и сегментарного колита (рис. 2), гистологически имитирующего воспалительные заболевания кишечника. Данный факт затрудняет дифференциальную диагностику, поскольку сегментарный колит после дивертикулита может накладываться на уже имеющийся язвенный колит или болезнь Крона или предшествовать их формированию [28].
![Рис. 2. Спектр клинических проявлений ДБ (адаптировано по [19]) Рис. 2. Спектр клинических проявлений ДБ (адаптировано по [19])](https://medblog.su/wp-content/uploads/2023/07/1689255720_834_Divertikulyarnaya-bolezn-mikrobiota-v-fokuse-vnimaniya-klinitsista-Livzan-MA.png)
Коррекция нарушения микробиоты при ДБ
Основными целями терапии ДБ являются купирование симптомов, профилактика прогрессирования заболевания и развития осложнений [29, 30]. Всем пациентам с ДБ рекомендуется обогащение рациона пищевыми волокнами (25–30 г в день), регулярная физическая активность, снижение избыточной массы тела при ее наличии, а также отказ от курения [31]. Важной частью лечебной стратегии при ДБ представляется модуляция кишечной микробиоты, которая относится к ключевым факторам прогрессирования дивертикулеза до СНДБ и осложненных форм заболевания.
На сегодняшний день существует несколько методов коррекции кишечной микробиоты: назначение пре-, пробиотиков и антибактериальных препаратов, фекальная трансплантация, терапия сигнальными молекулами [32]. Следует отметить, что фекальная трансплантация и терапия малыми молекулами представляются перспективными и высокоэффективными методами в будущем, однако в настоящее время они недоступны для применения в реальной клинической практике.
Среди пищевых волокон оптимальным считается назначение растворимых пищевых волокон, которые удерживают воду в просвете кишки, увеличивая объем кишечного содержимого, в результате чего снижается внутрипросветное давление и ускоряется транзит по кишечнику. Среди растворимых пищевых волокон заслуживает внимания арабиногалактан, входящий в состав БАД Фибраксин.
Арабиногалактан — пищевое волокно, одобренное FDA, получаемое методом экстрагирования паром из коры лиственницы западной. Конечным продуктом его ферментации по всей длине толстой кишки являются основные короткоцепочечные жирные кислоты: пропионовая, уксусная и масляная. Механизм действия короткоцепочечных жирных кислот на функции и структуру эпителия слизистой оболочки ЖКТ в настоящее время очень хорошо известен и связан с их противовоспалительным действием. За счет обеспечения достаточного запаса энергии для клеток эпителия слизистой оболочки достигается улучшение целостности и герметичности кишечного барьера, оптимизация продукции слизи (как по количеству, так и по качеству), а также стимуляция регенеративных процессов. Согласно результатам рандомизированного клинического исследования [33] комбинированное применение пребиотика арабиногалактана и лактоферина (БАД Фибраксин) в составе комплексной профилактической терапии у пациентов с симптоматической неосложненной ДБ обеспечивает снижение риска обострений и осложнений и сопровождается нормализацией частоты дефекации, снижением выраженности боли и улучшением качества жизни.
В настоящее время все больше внимания уделяется применению пробиотиков в лечении многих заболеваний пищеварительного тракта, в том числе ДБ, за счет широкого профиля воздействия на организм [34]. Основные механизмы действия и свойства пробиотиков представлены на рисунке 3.
![Рис. 3. Механизмы действия и свойства пробиотиков (адаптировано по [33]) Рис. 3. Механизмы действия и свойства пробиотиков (адаптировано по [33])](https://medblog.su/wp-content/uploads/2023/07/1689255720_419_Divertikulyarnaya-bolezn-mikrobiota-v-fokuse-vnimaniya-klinitsista-Livzan-MA.png)
Lactobacilli spp. являются наиболее часто используемыми пробиотиками в лечении гастроэнтерологических заболеваний. К этому роду принадлежат многочисленные виды, включая L. acidophilus, L. rhamnosus, L. bulgaricus, L. casei, L. paracasei и L. reuteri. Данные штаммы (табл. 2) показали свою эффективность во многих клинических исследованиях [35-47].
![Таблица 2. Исследуемые микробиотические штаммы Lactobacilli spp. и их влияние на организм [34–46] Таблица 2. Исследуемые микробиотические штаммы Lactobacilli spp. и их влияние на организм [34–46]](https://medblog.su/wp-content/uploads/2023/07/1689255720_700_Divertikulyarnaya-bolezn-mikrobiota-v-fokuse-vnimaniya-klinitsista-Livzan-MA.png)
В группе антибактериальных препаратов особый интерес представляет неабсорбируемый в кишечнике рифаксимин-α — структурный аналог рифампицина, который оказывает свое антибиотическое действие за счет ингибирования синтеза бактериальной РНК путем связывания с β-субъединицей бактериальной ДНК-зависимой РНК-полимеразы [48]. Благодаря своим эффектам [49], способствующим модуляции физиологической микробиоты и множественным механизмам действия, рифаксимин-α с успехом используется для лечения СНДБ (рис. 4). Рифаксимин-α обладает широким спектром действия в отношении грамположительных и грамотрицательных микроорганизмов, при этом оказывает минимальное негативное влияние на полезную микробиоту кишечника [50]. Кроме того, препарат продемонстрировал свое эубиотическое действие, заключающееся в стимуляции роста полезных бактерий, включая Lactobacillus и Bifidobacterium [51, 52]. Рифаксимин-α обладает хорошими противовоспалительными и стабилизирующими свойствами по отношению к эпителиоцитам. В частности, он подавляет кишечное и системное воспаление благодаря прямой противовоспалительной активности [53] посредством активации в кишечнике ядерных рецепторов PXR (Pregnane X receptor), основная функция которых заключается в обнаружении ксенобиотиков, а также путем повышения экспрессии белков, ответственных за детоксикацию и клиренс [50, 54]. Рекомендуется назначение рифаксимина-α в дополнение к растворимым волокнам с целью подавления избыточного бактериального роста, устранения бактериальной транслокации и воспаления и, как следствие, профилактики развития дивертикулита. Эффективность и безопасность циклического применения рифаксимина-α у пациентов с ДБ (кроме дивертикулеза) подтверждены в большом количестве клинических исследований [55, 57]. Вместе с тем стоит подчеркнуть, что все исследования проведены на оригинальной молекуле рифаксимина-α.
![Рис. 4. Модуляция микробиоты при использовании рифаксимина-α (адаптировано по [49]) Рис. 4. Модуляция микробиоты при использовании рифаксимина-α (адаптировано по [49])](https://medblog.su/wp-content/uploads/2023/07/1689255720_340_Divertikulyarnaya-bolezn-mikrobiota-v-fokuse-vnimaniya-klinitsista-Livzan-MA.png)
Терапевтический подход к ведению пациентов с ДБ зависит от формы заболевания. Так, при дивертикулезе лечебные мероприятия ограничиваются коррекцией образа жизни, дополнительным введением в рацион пищевых волокон. Обсуждается вопрос о целесообразности курсового назначения пробиотиков с целью профилактики развития СНДБ и осложненных форм ДБ.
При СНДБ дополнительно к модификации образа жизни и обогащению рациона пищевыми волокнами с целью устранения сопутствующего кишечного дисбиоза в качестве меры профилактики развития дивертикулита и других осложнений показано курсовое назначение неабсорбируемого кишечного антибиотика (рифаксимин-α 800 мг/сут 7–10 дней курсами ежемесячно) с последующим курсовым приемом пробиотических препаратов для предупреждения избытка активации условно-патогенных представителей кишечной микробиоты. Длительность терапии определяется индивидуально, в зависимости от клинической ситуации. С целью купирования абдоминальной боли рекомендовано назначение селективных спазмолитиков [58].
При наличии осложнений ДБ (дивертикулит) в состав комплексной терапии наряду с растворимыми пищевыми волокнами, антибактериальными препаратами (рифаксимин-α) и пробиотиками необходимо добавление курсового лечения месалазином, оказывающим противовоспалительное действие. Кроме того, месалазин способен модулировать ноцицепцию, способствует заживлению слизистой оболочки и подавляет метаболизм бактерий, уменьшая их инвазивные свойства [59]. С целью лечения и профилактики рецидивов первой атаки дивертикулита месалазин применяется в дозе 3 г/сут в течение 1-го месяца на фоне терапии антибиотиками и спазмолитиками, далее 1,5–2 г/сут по 7–10 дней ежемесячно в течение 1 года [4].
С практической точки зрения особый интерес представляет вопрос выбора эффективного и безопасного пробиотического штамма для терапии пациентов. Высокую эффективность в лечении ДБ показал пробиотический штамм Lactobacillus casei DG (Lacticaseibacillus paracasei DG I-1572 DSM-34154), зарегистрированный Институтом Пастера в Париже и являющийся запатентованным пробиотиком компании «Альфасигма» под торговым названием Энтеролактис®. Согласно клиническим рекомендациям по диагностике и лечению ДБ с целью модуляции физиологической микробиоты рекомендуется циклическое применение L. casei DG по 1 капсуле 24 млрд КОЕ/сут в течение 10 дней каждый месяц [4]. В исследованиях на здоровых добровольцах было отмечено, что максимальная концентрация жизнеспособных бактерий в кишечнике отмечается уже на 4-й день приема пробиотика, а способность этого штамма задерживаться в пищеварительном тракте после окончания приема составляет от 7 до 14 дней [60].
В двойном слепом рандомизированном плацебо-контролируемом исследовании установлено, что комбинированная циклическая терапия месалазином в сочетании с пробиотиком Энтеролактис® была более эффективной в устранении клинических проявлений по сравнению с монотерапией либо месалазином, либо пробиотиком с целью достижения ремиссии СНДБ и профилактики рецидива острого дивертикулита в будущем [61]. Эксперименты in vivo и in vitro продемонстрировали, что L. casei DG продуцирует уникальные, богатые рамнозой соединения, называемые экзополисахаридами (EPS), которые могут играть роль как в вытеснении патогенной бактериальной флоры, так и в стимуляции иммунной системы. Установлено, что EPS проявляют иммуностимулирующие свойства за счет усиления экспрессии генов провоспалительных цитокинов — фактора некроза опухоли α, интерлейкина 6, интерлейкина 8, хемокинов [62–64]. Последующее исследование подтвердило противовоспалительные эффекты пробиотика Энтеролактис® при ДБ [65]. Кроме того, для EPS установлены противоопухолевый, противоязвенный, противовирусный и гиполипидемический эффекты [66, 67].
В клинических исследованиях in vitro продемонстрирован бактерицидный эффект L. casei DG по отношению к Staphylococcus, Streptococcus, Pasteurella и Neisseria [68], значимое увеличение концентрации ацетата и бутирата, а также уменьшение концентрации мРНК провоспалительных цитокинов и рецепторов распознавания образов TLR-4 [69, 70]. Однако модуляция микробиоты и увеличение содержания короткоцепочечных жирных кислот при этом зависят от исходных характеристик микробного пейзажа пищеварительного тракта [71].
На сегодняшний день Энтеролактис® показал свою эффективность в купировании клинических проявлений язвенного колита и постинфекционного синдрома раздраженного кишечника [70, 72], уменьшении побочных эффектов антибактериальных препаратов на фоне проводимой эрадикационной терапии Helicobacter pylori [73] и устранении избыточного бактериального роста в тонкой кишке [74], что показывает его преимущества перед другими пробиотиками, в том числе в условиях коморбидности.
Заключение
Дивертикулярная болезнь представляет собой актуальную проблему в клинической практике ввиду широкой распространенности. Одним из факторов, способствующих развитию и прогрессированию заболевания, является модуляция кишечной микробиоты. Методы коррекции кишечной микробиоты включают в себя назначение рифаксимина-α, пре- и пробиотиков, трансплантацию фекальной микробиоты и применение малых молекул. Среди доступных в реальной клинической практике методов, способствующих купированию симптомов и снижению риска развития осложнений ДБ, следует отметить пребиотик арабиногалактан и пробиотические штаммы, в частности L. casei DG (L. paracasei DG I-1572 DSM-34154), продемонстрировавший свою эффективность и безопасность в целом ряде клинических исследований. Список литературы Вы можете найти на сайте http://www.rmj.ru
Информация с rmj.ru