Содержание статьи
Применение симптоматических препаратов медленного действия
при остеоартрозе суставов кистей
Е. А. Леушина
О. В. Симонова, доктор медицинских наук, профессор
ГБОУ ВПО Кировская ГМА МЗ РФ, Киров
С современных позиций остеоартроз (ОА) является одним из наиболее
распространенных заболеваний опорно-двигательного аппарата и рассматривается как
гетерогенная группа заболеваний, имеющих различную этиологию, но сходные
биологические и морфологические черты [1]. Число пациентов с ОА постоянно
растет, что связано с увеличением продолжительности жизни населения и
накоплением факторов риска заболевания [2]. Это заболевание характеризуется
неуклонно прогрессирующим течением, приводит к ухудшению качества жизни
пациентов, ограничивает их физические возможности и социальные функции,
становясь причиной инвалидности, что определяет актуальность поиска эффективной
терапии [3]. Хроническая боль приводит к уменьшению продолжительности жизни в
среднем на 10–12 лет [4]. Проблема боли при ОА носит не только медицинский, но и
социальный характер и отражается на функциональной, социальной активности и
продолжительности жизни [5]. Использование нестероидных противовоспалительных
препаратов (НПВП) при ОА сопряжено с развитием НПВП-индуцированных гастропатий,
особенно у пожилых людей. По данным рандомизированных клинических исследований,
язвенные поражения желудочно-кишечного тракта выявляются у 15–40% и более
пациентов, регулярно принимающих неселективные НПВП в течение 6 месяцев [6].
Прием НПВП усугубляет течение артериальной гипертензии, уменьшает эффективность
антигипертензивной терапии, может усугубить застойную сердечную недостаточность
[7, 8]. Считается, что большинство НПВП усиливает дегенерацию хряща при
длительном применении [9–11]. Проблема уменьшения боли при ОА очевидна.
Назначение симптоматических препаратов медленного действия способно уменьшить
выраженность основных симптомов заболевания и потребность в анальгетической
терапии [12].
В настоящее время малоизученным с точки зрения эффективности применяемых
препаратов остается ОА суставов кистей. Распространенность этой разновидности ОА
в европейских странах увеличивается от 10% в возрасте 40–49 лет, до 92% — в
возрасте старше 70 лет [3]. У большинства людей в возрасте 55 лет и старше
обнаруживаются рентгенологические признаки ОА, по меньшей мере одного из
суставов кисти, а 20% из них имеют клинические признаки этого заболевания. EULAR
разработаны рекомендации по ведению больных с ОА суставов кистей, согласно
имеющимся исследованиям. Ряд рекомендаций связан с применением местных
медикаментозных и немедикаментозных локальных методов лечения, применением НПВП.
Немногочисленные исследования проведены с применением медленнодействующих
препаратов, а, в частности, только хондроитина сульфат (ХС) исследован в аспекте
структурно-модифицирующего эффекта при ОА суставов кистей [13]. Влияние
глюкозамина и диацереина на симптомы и функцию суставов кистей не изучалось.
Целью исследования было провести сравнительный анализ клинической
эффективности диацереина, глюкозамина и хондроитина сульфата у больных ОА
суставов кистей.
Материалы и методы исследования
В открытое сравнительное контролируемое рандомизированное 18-месячное
исследование было включено 120 женщин, соответствующих клиническим критериям
диагностики остеоартроза суставов кистей [14]. Исследование проводили в
соответствии с основными принципами Good Clinical Practice и Хельсинкской
декларацией. Все больные подписали добровольное информированное согласие, было
принято положительное решение локального этического комитета. Методом адаптивной
рандомизации все пациенты были распределены на группы: 30 больных (1-я группа)
принимали диацереин в дозе 50 мг 2 раза в сутки в течение 4 месяцев, 30 больных
(2-я группа) — ХС 500 мг 2 раза в сутки в течение 6 месяцев, 30 больных (3-я
группа) принимали глюкозамина сульфат (ГС) 1500 мг в сутки в течение 3 месяцев.
Все пациенты получили 2 курса терапии с периодичностью в 6 месяцев.
Сравнительная группа (4-я группа) 30 больных принимали ацеклофенак (Ац) в
требуемой дозе. Больным 1–3 групп разрешалось принимать ацеклофенак по
потребности. Группы больных до начала исследования были сопоставимы по основным
клиническим и демографическим показателям (р > 0,05) (табл. 1).
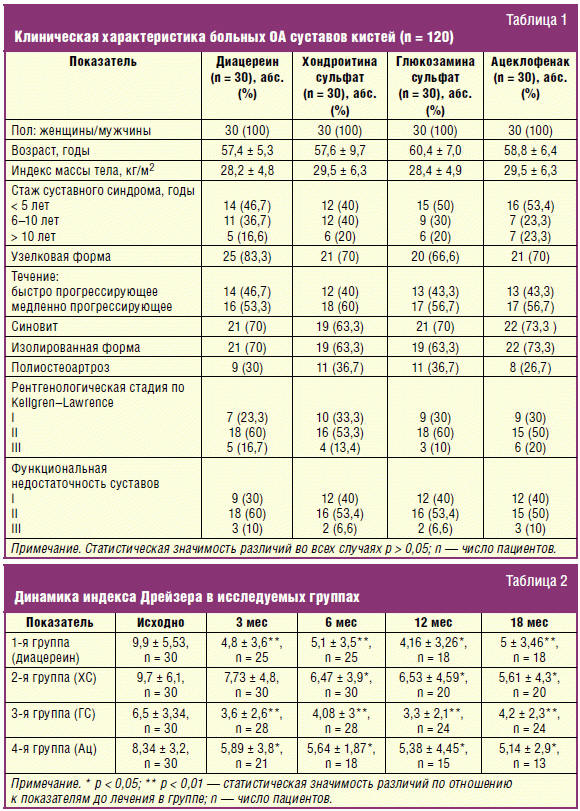
Все пациенты были женщины. Средний возраст, стаж болезни не отличались
значительной вариабельностью. Большинство больных в группах имели узелковую
форму ОА с явлениями синовита. Во всех группах преобладала изолированная форма
ОА мелких суставов кистей, преимущественно II рентгенологическая стадия. У всех
пациентов была выявлена клиническая активность заболевания и снижение
функциональных возможностей суставов. Критериями включения являлись: достоверный
диагноз ОА суставов кистей, интенсивность боли в суставах > 40 мм по визуальной
аналоговой шкале (ВАШ), необходимость приема НПВП, отсутствие клинически
значимых нарушений функции печени и почек, подписанное информированное согласие.
В исследование не включали пациентов с сердечной, почечной и печеночной
недостаточностью, сахарным диабетом 1-го типа, обострением язвенной болезни
желудка и 12-перстной кишки, а также больных, получавших на момент включения в
исследование или за 6 месяцев до этого симптоматические лекарственные средства
медленного действия.
Для оценки эффективности терапии проводили исследование выраженности боли,
скованности, нарушение функции в суставах по ВАШ, оценивали функциональные
индексы Дрейзера и AUSCAN. Потребность в НПВП определяли для оценки влияния
терапии на течение заболевания. Динамику показателей оценивали через 1 месяц,
затем каждые 3 месяца, рентгенографию суставов проводили исходно и через 18
месяцев.
Статистическая обработка материала проводилась с использованием
специализированного статистического пакета SPSS 17.0. В группах вычисляли
среднее арифметическое (М), среднеквадратическое отклонение (σ), среднюю ошибку
среднего арифметического (m), доверительный интервал. При сравнении показателей
в группах пользовались t-критерием Стьюдента, χ2. Изучение динамики
исследуемых показателей в процессе лечения проводили с помощью парного критерия
Стьюдента, χ2. Во всех случаях нулевую гипотезу отвергали при p <
0,05.
Результаты и их обсуждение
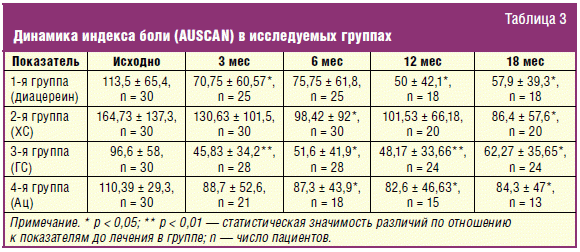
Положительное влияние терапии на симптомы заболевания было отмечено во всех
группах: уменьшились боль, скованность и улучшилась функция суставов (табл.
2–5). Однако время наступления клинического эффекта и его выраженность в группах
были различными. Применение диацереина и ГС приводило к статистически значимому
улучшению изучаемых показателей к 3-му месяцу наблюдения (p < 0,05–0,01) (табл.
2–5). Применение ХС статистически значимо (p < 0,05) улучшало клинические
показатели лишь к 6-му месяцу приема препарата.
Уменьшение индекса Дрейзера к 18-му месяцу отмечено в 1-й группе на 49%, во
2-й группе на 42%, в 3-й группе на 35%, в 4-й — на 38% (p < 0,05–0,01).
Уменьшение боли по шкале AUSCAN к 18-му месяцу отмечено во всех группах: в 1-й и
2-й группах уменьшение боли составило 49% и 47,5% соответственно, в 3-й группе —
36%, а в 4-й группе 23,5% (p < 0,05). Индекс скованности по шкале AUSCAN к 18-му
месяцу уменьшился на 51% в группе диацереина и ХС (p < 0,05), а в группе ГС на
35% (p < 0,05). Функциональная активность суставов улучшалась к окончанию
наблюдения в группе диацереина на 53%, в группе ХС на 50%, в группе ГС на 41% (p
< 0,05–0,01). Эффект у диацереина и ХС сохранялся в течение 6 месяцев, у ГС
наблюдалось «ускользание» эффекта через 3 месяца после терапии. Во всех группах
достоверно уменьшалась потребность в НПВП (p < 0,05–0,01). К 18-му месяцу в
группе диацереина доза ацеклофенака уменьшилась на 87,4%, во 2-й группе на 86%,
в 3-й группе на 78,5%. В 4-й группе отмечено постепенное уменьшение потребляемой
дозы на 54,2%. Проводимая терапия позволила отменить ацеклофенак у 23% больных
1-й группы, у 25% 2-й группы, у 16,6% 3-й группы. Уменьшить прием НПВП ≥ 50%
удалось 77% пациентам 1-й группы, 75% — 2-й группы, 83,3% — 3-й группы и 38% —
4-й группы. 62% больных 4-й группы к 18-му месяцу принимали прежнюю дозу
ацеклофенака. Оценивая переносимость исследуемых препаратов, отмечено, что чаще
нежелательные явления регистрировались при приеме ацеклофенака — в 53% случаев:
у 26,6% больных наблюдались боли в эпигастрии, у 16,6% — диспепсия, у 10%
повышение трансаминаз. Побочные явления в группе ХС и ГС встречались в равной
степени одинаково (20%), в группе диацереина — 30% случаев. При приеме
диацереина в равной степени (у 6,6% больных) встречались боли в эпигастрии и
повышение трансаминаз, у 16,6% больных наблюдалась диарея. При приеме ХС у 13,3%
больных встречались боли в эпигастрии и у 6,6% диспепсия. При терапии ГС в
равной степени (10%) встречалась диарея и диспепсия. Во всех случаях проявления
побочных действий препараты отменялись.
Заключение
Полученные нами данные в отношении ГС и диацереина подтверждают данные
литературы. Хотя их эффективность не оценивалась при ОА суставов кистей, но их
эффективность в отношении уменьшения боли при ОА коленных и тазобедренных
суставов показана во многих клинических исследованиях [15, 16]. ХС исследовался
в 2 клинических исследованиях при ОА кистей, которые показали эффективность
препарата по предотвращению рентгенологического прогрессирования. Но эти данные
противоречивы. О влиянии на симптомы болезни и функциональную недостаточность
суставов не сообщалось [17].
Таким образом, терапия повторными курсами диацереина, ГС и ХС при ОА суставов
кистей оказывает симптоматический эффект: уменьшает боль, скованность, улучшает
функцию суставов, снижает потребность в НПВП. Диацереин и ХС, по сравнению с ГС,
оказывают более стойкий и выраженный эффект. ХС и ГС, в сравнении с диацереином,
реже вызывают побочные действия.
Литература
-
Балабанова Р. М., Каптаева А. К. Артродарин — новый препарат для
патогенетической терапии остеоартроза // Научно-практическая ревматология.
2009. № 2. С. 49–53. -
Алексеева Л. И. Симптоматические препараты замедленного действия
при лечении остеоартроза // Consilium medicum. 2009. № 11 (9). С. 100–104. -
Алексеева Л. И., Чичасова Н. В. Применение пиаскледина при
остеоартрозе кистей // Фарматека. 2010. № 10. C. 48–55. -
Мозговая Е. Э., Зборовская И. А. Остеоартроз — самое частое
заболевание суставов // Лекарственный вестник.
2012. № 7. C. 33–40. -
Чичасова Н. В. Проблема боли при остеоартрозе // Лечащий Врач.
2007. № 2. С. 50–56. -
Насонов Е. Л., Каратеев А. Е. Применение нестероидных
противовоспалительных препаратов. Клинические рекомендации // Русский
медицинский журнал. 2006. № 25. С. 1769–1778. -
Савенков М. П., Бродская С. А. и др. Влияние нестероидных средств
на антигипертензивный эффект ингибиторов АПФ // Русский медицинский журнал.
2003. № 19. С. 56–59. -
Warksman J. C. Nonselective nonsteroidal anti-inflammatory drugs
and cardiovascular risk: are they safe? // Ann Rharmacother. 2007. Vol. 41. P.
63–73. -
Бадокин В. В. Нестероидные противовоспалительные препараты в
терапии остеоартроза // Современная ревматология. 2009. № 1. С. 33–35. -
Чичасова Н. В. Лечение остеоартроза: влияние на хрящевую ткань
различных противовоспалительных препаратов // Русский медицинский журнал.
2005. № 8. С. 539–543. -
Чичасова Н. В., Имаметдинова Г. Р., Иголкина Е. В. Подходы к
лечению боли с учетом механизмов ее развития // Современная ревматология.
2013. № 1. С. 59–66. -
Лыгина Е. В. Хондропротекторы в лечении остеоартроза //
Современная ревматология. 2012. № 2. С. 59–65. -
Rovetta G., Monteforte P., Molfetta G. A two — years study of
chondroitin sulfate in erosive osteoarthritis of the hand behavior of erosions
osteophytes pain and hand dysfunction // Drug. Exp. Clin. Res. 2004. Vol. 30
(1). P. 11–16. - Основные положения рекомендаций EULAR по ведению пациентов с остеоартрозом
кисти. 2010. -
Bartels E. M., Bliddal H., Schondorff P. K. et al. Symptomatic
efficacy and safety of diacerein in the treatment of osteoarthritis: a
meta-analysis of randomized placebo-controlled trials // Osteoarthritis
Cartilage. 2010. Vol. 18. № 3. Р. 289–296. -
McAlindon T. E. et al. Glucosamine and chondroitin for treating
symptoms of osteoarthritis. A systematic quality asses // JAMA. 2000. Vol.
283. P. 1469–1475. -
Leeb B. F., Schweizer M. A meta-analysis of chondroitin sulphate
in treatment of osteoarthritis // J. Rheumarol. 2006. Vol. 27. P. 205.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru