Введение
Известно, что нарушения репродуктивных функций связаны с метаболическими нарушениями, особенностями питания и образа жизни, в связи с чем в последнее время активно изучается применение различных витаминов и витаминоподобных веществ, в том числе инозитола. Молекула инозитола имеет 9 стереоизомеров, каждый из которых обладает собственным фармакологическим профилем и является вторичным мессенджером сигналов гормонов. При участии акушеров-гинекологов, клинических фармакологов, эндокринологов рассмотрим особенности применения стереоизомеров инозитола в различных клинических ситуациях и в комбинации с различными лекарственными средствами или витаминами.
О.А. Громова «Клиническая фармакология. Синергизм D-хироинозитола и миоинозитола»
Инозитол (инозит, «витамин юности», витамин B8) открыл в 1848 г. немецкий химик Юстус фон Либих, выделивший инозитол из проростков пшеницы. Миоинозитол (МИ) и D-хироинозитол (ДХИ) — это 2 из 9 изомеров инозитола, которые образуются после эпимеризации гидроксильных групп инозитола. Только этим 2 изомерам из 9 уделяется наибольшее внимание, поскольку они проявляют максимальную метаболическую активность. Фермент эпимераза конвертирует МИ в ДХИ и обратно. На сегодняшний день МИ гораздо более изучен (более 40 000 публикаций), чем ДХИ (322 публикации).
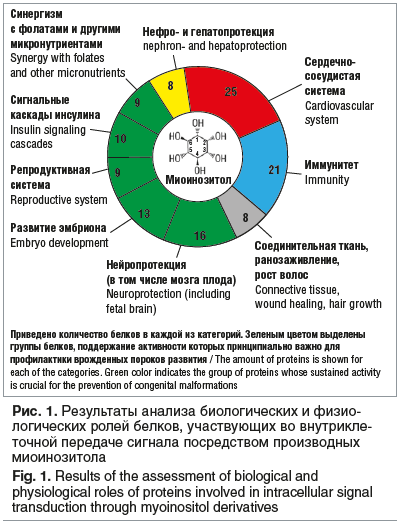
Анализ 120 миоинозитол-зависимых белков протеома человека показал, что более половины этих белков участвуют в работе сердечно-сосудистой системы, системы иммунитета, в поддержании структуры соединительной ткани, в метаболизме сахаров и в поддержании функционирования центральной нервной системы (включая нейротрофические и нейропротективные эффекты). Белки, участвующие во внутриклеточной передаче сигнала посредством производных миоинозитола, играют важную роль в различных физиологических процессах [1].
Миоинозитол влияет на процессы роста эмбриона. Фермент инозитол 1,3,4-трифосфат 5/6-киназа (ген Itpk1) является ключевым регуляторным ферментом синтеза сигнальной молекулы инозитол гексакисфосфата (IP6) — внутриклеточной сигнальной молекулы, участвующей в регуляции ионных каналов, транспорте нутриентов и строительных материалов через клеточную мембрану (эндоцитоз, экзоцитоз), транскрипции и репарации ДНК [2]. При делеции/инактивации гена Itpk1 в эмбрионах животных часто обнаруживали дефекты нервной трубки (ДНТ), осевые дефекты скелета, замедленный рост и повышенную гибель нейронов. Миоинозитол-зависимый фермент Itpk1 необходим для адекватного развития нервной трубки и профилактики ДНТ [3]. В эксперименте ДХИ был более эффективен, чем МИ в профилактике фолат-резистентных ДНТ у мышей. ДХИ уменьшал риск развития spina bifida у мышей на 73–86%, а МИ — только на 53–56% [4]. МИ защищает нейроциты от глутамата [1].
Миоинозитол и ДХИ оказывают положительное действие на состояние кожи, волос и ногтей за счет нормализации передачи «инсулиновых» сигналов и поддержки процессов дифференцировки и роста различных типов клеток кожи (кератиноцитов, фибробластов, эпителиоцитов и т. д.). Воздействие МИ и ДХИ на кожу и ее придатки, в том числе при ранозаживлении, может быть усилено марганцем, который обеспечивает антиоксидантный эффект и улучшает состояние соединительнотканной основы кожи [5]. В области раны электротаксис кератиноцитов осуществляется через миоинозитол-зависимый белок PI3Kγ. Делеция гена PI3Kγ уменьшает способность кератиноцитов передвигаться под воздействием электрического поля и нарушает процесс заживления ран [6].
По нашим данным, в плазме крови МИ обнаруживается в концентрации 0,37–0,76 мг/дл (20,6–42,2 мкмоль/л, в среднем 28 мкмоль/л). Выведение МИ с мочой резко возрастает при нарушениях обмена сахаров и при патологии почек. По нашим предварительным данным, пищевая обеспеченность россиянок МИ крайне низка (не более 300 мг/сут). Так, при преимущественном питании фастфудом человек потребляет в среднем около 300 мг/сут инозитола. В то же время по нормам, принятым в РФ, МИ должен поступать в организм взрослого человека в количествах от 500 до 1000 мг/сут (от 225 до 1500 мг/сут на 1800 ккал).
У пациенток 8–30 лет с проблемами репродуктивного здоровья на фоне избыточной массы тела (ИМТ>26 кг/м2) и высокого уровня стресса по шкале ИДИКС уровни МИ в крови значительно ниже (менее 24 мкмоль/л, в среднем 16 мкмоль/л) [7].
За последние годы отмечен рост количества исследований ДХИ (в 2016 г. — 20 исследований, в 2022 г. — 322 исследования). Был проведен систематический компьютерный анализ 45 00 публикаций о биологической роли инозитолов методами топологической теории распознавания и системно-биологического анализа белков протеома человека. В ходе систематического анализа литературы выделены 45 информативных биомедицинских терминов, характерных для публикаций по ДХИ (запрос D-chiroinositol OR D-chiroinositol OR 1D-chiroinositol в базе данных PubMed) по сравнению с публикациями по МИ (статьи, найденные по запросу myoinositol NOT D-chiroinositol NOT D-chiroinositol NOT 1D-chiroinositol). Обмен ДХИ тесно взаимосвязан с такими процессами, как инсулино- и глюкозорезистентность, воспаление, метаболизм андрогенов и эстрогенов, созревание ооцитов, нарушения обмена нейротрансмиттеров. Обмен ДХИ и МИ нарушается на фоне инсулинорезистентности (ИР), в том числе у пациенток с синдромом поликистозных яичников (СПЯ) [8].
Показано, что ДХИ значительно улучшал метаболизм глюкозы у мышей линии Db/Db с диабетом [9]. У пациентов с инсулинозависимым сахарным диабетом (СД) существенно увеличивалась суточная экскреция ДХИ с мочой [10]. Важной особенностью ДХИ является его участие в реализации терапевтических эффектов метформина [8].
Дотации ДХИ у пациенток с СПЯ приводят к снижению уровней антимюллерова гормона (АМГ) в сыворотке и улучшению показателей обмена инсулина [11]. Дотации ДХИ (600 мг/сут в течение 6–8 нед.) у женщин с СПЯ и нормальным ИМТ улучшали результаты нагрузочного теста глюкозой (p=0,03), снижали уровень сывороточного тестостерона и способствовали восстановлению овуляции [12]. Дотация ДХИ в большей дозе (1200 мг/сут, 6–8 нед.) усиливала действие инсулина у пациенток с СПЯ [13]. Показан синергизм ДХИ с различными микронутриентами, в том числе с фолиевой кислотой и марганцем [8, 14, 15]. Дополнение комбинации МИ + ДХИ фолиевой кислотой и марганцем может повысить эффективность коррекции ИР (в частности, достичь более выраженного снижения повышенного уровня глюкозы) и профилактики пороков развития плода [8]. ДХИ обладает гепатопротективными свойствами [16]: он улучшал секрецию желчных кислот и ослаблял холестаз после перевязки желчных протоков у крыс в исследовании [17].
Дотации ДХИ и МИ способствуют повышению чувствительности клеток к инсулину и нормализации метаболизма андрогенов [8]. ДХИ является важным синергистом МИ в 6 функциональных группах генов. Нутрицевтическая поддержка беременных с ИР, дислипидемией, избыточной массой тела будет наиболее эффективной именно при совместном использовании дотаций МИ и ДХИ [18].
Целесообразно использование препаратов инозитола с определенными соотношениями МИ и ДХИ [8]. В России зарегистрирован витаминно-минеральный комплекс Дикироген (Pizeta Pharma SpA, Италия), включающий 1000 мг МИ и 200 мг ДХИ (т. е. в соотношении 5:1), фолиевую кислоту (200 мкг) и марганец (5 мг). Важно отметить, что марганец в составе Дикирогена представлен в виде органической соли пироглутамата марганца, характеризующейся хорошими органолептическими свойствами, высокой биодоступностью марганца и низкой токсичностью. С приемом Дикирогена не ассоциировано серьезных нежелательных реакций [8].
Содержание статьи
- 1 А.С. Духанин «Инозитолы: по законам фармакологии»
- 2 З.Х. Кумыкова «Перспективы применения инозитолов у детей и подростков»
- 3 Е.В. Шереметьева «Место инозитолов в комплексной коррекции метаболического синдрома в репродуктивном периоде женщины»
- 4 Г.И. Табеева «Перспективы применения инозитолов у пациенток в перименопаузе»
А.С. Духанин «Инозитолы: по законам фармакологии»
Различают эндогенные инозитолы, которые образуются внутри клетки из глюкозы, и экзогенные инозитолы, т. е. поступающие извне. Принимаемые перорально экзогенные инозитолы, прежде чем проявить свои фармакологические свойства, должны достичь своего места действия внутри клетки.
Физико-химические и фармакокинетические свойства инозитола представлены в базе данных Drugbank. Инозитол обладает очень хорошей растворимостью в воде; logP -2,6 (практические не проникает в клетки без переносчика). Инозитол всасывается в тонкой кишке [19]. Абсорбция инозитолов опосредована транспортерами/переносчиками, расположенными в апикальной мембране эпителиоцитов; SLC5A3 и SLC5A11, иначе обозначаемыми как SMIT1 и SMIT2 (sodium-myo-inositol co-transporters 1 and 2), SLC2A13 [20, 21]. SMIT1 транспортирует МИ (К0,5=0,05 мМ), аффинность переносчика к глюкозе на 3 порядка (т. е. в 1000 раз) меньше; SMIT2 транспортирует ДХИ и МИ (K0,5≈0,5 мМ), но не глюкозу. Таким образом, МИ может поступать в клетку с помощью обоих транспортеров (SMIT1 и SMIT2), ДХИ — только с помощью одного транспортера (SMIT2). Инозитолы — это вторичные мессенджеры гормонального сигнала. Их эффекты реализуются внутри клетки. Вход инозитолов в клетку опосредован всегда транспортером. Для каждого типа клетки характерен свой набор транспортеров: SLC5A11 (SMIT2), SLC5A3 (SMIT1), SLC2A13 или HMIT (H+/инозитол симпорт). Для клеток репродуктивных органов транспортером инозитола преимущественно является SLC2A13.
Внутриклеточное содержание МИ определяется синтезом de novo из глюкозо-6-фосфата, активностью фосфоинозитидного обмена, метаболизмом (перечисленные факторы не зависят от переносчиков), а также поступлением МИ извне с пищей или в составе БАД, выходом (efflux) из клетки, почечной экскрецией/реабсорбцией (факторы зависят от переносчиков).
В продуктах питания инозитол представлен в форме фосфат-производного (инозитол-гексакисфосфат, InsP6, фитиновая кислота), который плохо всасывается. Отщепление фосфатов происходит при участии микробиоты кишечника, однако при ее нарушениях, например после применения антибиотиков, возможно снижение превращения фосфат-производного в инозитол и нарушение его всасывания, что ведет к снижению содержания инозитола [22]. Кроме того, по мнению некоторых авторов, к снижению содержания инозитола приводят нарушения его биосинтеза и всасывания, возникающие при конкуренции со структурно схожими молекулами, такими как глюкоза. ДХИ может оказывать ингибирующий эффект в отношении абсорбции МИ: при использовании в высоких дозах (6000 мг МИ + 1000 мг ДХИ) ДХИ мог конкурировать с МИ за всасывание с помощью транспортера SMIT2 [23, 24]. Следует обратить внимание на то, что дозы, использованные авторами, были очень высоки; кроме того, существует второй транспортер — SMIT1, с помощью которого осуществляется всасывание МИ. В исследованиях [23, 25] in vitro было показано, что глюкоза в концентрации 20 ммоль/л существенно ингибировала поступление инозитола в культуральные клетки, однако в реальной клинической практике такие концентрации глюкозы в крови встречаются только при декомпенсации СД.
Изучены различные пропорции МИ с ДХИ: МИ 1127,5 мг/сут + ДХИ 27,5 мг/сут (40:1), МИ 550 мг/сут + ДХИ 27,5 мг/сут (20:1), МИ 1100 мг/сут + ДХИ 100 мг/сут (10:1), МИ 1000 мг/сут + ДХИ 200 мг/сут (5:1), фолиевая кислота 200 мкг и марганец 5 мг, МИ 1100 мг/сут + ДХИ 300 мг/сут (3:1) [26, 27]. Выбор наиболее эффективной комбинации определяется результатами клинических исследований. Так, соотношение МИ и ДХИ 40:1 принято считать физиологическим [28], однако вывод был сделан на основании результатов фармакокинетических исследований, в которых участвовали здоровые добровольцы, в течение 15 дней находившиеся на диете, обедненной инозитолом [29]. Таким образом, обоснованием для назначения препарата инозитолов является клиническая база исследований конкретных средств Не может служить обоснованием для назначения препарата «правильное» соотношение МИ и ДХИ. Наличие в фармацевтическом продукте фолиевой кислоты и микроминералов, например марганца, обусловливает новые свойства фармацевтического препарата и переводит его в новый ранг за счет явления синергизма. Механизмы реализации эффектов комбинированного препарата отличаются от препарата «чистых инозитолов». Важно учитывать общее количество инозитолов — разовую и суточную дозы, кратность приема, связь с приемом пищи (натощак, во время или сразу после еды); наличие дополнительных нутриентов в препарате (микроэлементы, витамины) и возможность дополнительного приема микронутриентов (например, железа), сочетанной лекарственной терапии. Только в клинических исследованиях с участием пациентов с различной сопутствующей патологией можно установить оптимальное соотношение МИ и ДХИ в препарате.
З.Х. Кумыкова «Перспективы применения инозитолов у детей и подростков»
Интерес научного сообщества к применению инозитола, особенно в области гинекологии и эндокринологии, возник только в последние 20 лет. Внутриклеточные эффекты МИ и ДХИ хорошо изучены. МИ активирует внутриклеточное перемещение транспортера глюкозы GLUT4 к клеточной мембране, обеспечивая поступление глюкозы внутрь клетки, и ингибирует аденилатциклазу, снижая образование свободных жирных кислот из жировой ткани. Ткани с высоким уровнем потребления глюкозы (мозг, сердце и яичники) содержат большое количество МИ. При стимуляции инсулином тканеспецифичного фермента эпимеразы МИ конвертируется в ДХИ. Эта реакция позволяет каждому органу и каждому виду ткани регулировать физиологическое соотношение между МИ и ДХИ для обеспечения нормальных метаболических процессов и физиологического состояния. ДХИ стимулирует гликогенсинтазу, поэтому его концентрация высока в тканях, депонирующих гликоген (печень и скелетные мышцы) [30, 31].
Яичники характеризуются определенным соотношением МИ и ДХИ, поддерживающим их нормальное функциональное состояние. Концентрации МИ в репродуктивных органах женщины значительно выше концентраций ДХИ и имеют ключевое значение для здоровья яичников. В то же время высокая концентрация ДХИ у здоровых женщин, наоборот, способна негативно влиять на качество ооцитов и бластоцист [32]. МИ и ДХИ оказывают непосредственное, но противоположное влияние на уровень андрогенов и эстрогенов в организме. ДХИ дозозависимо уменьшает экспрессию гена ароматазы, участвующей в стероидогенезе в клетках гранулезы яичников, а также снижает экспрессию генов расщепления боковой цепи цитохрома P450. МИ является вторичным мессенджером фолликулостимулирующего гормона (ФСГ), который напрямую стимулирует ароматазу, индуцируя конвертацию андрогенов в эстрогены, и созревание фолликулов, непосредственно участвует в фолликуло- и оогенезе, регулирует пролиферацию и созревание гранулезных клеток в яичниках, опосредует ФСГ-индуцированную выработку АМГ, играет ключевую роль в развитии и транспортировке зрелых ооцитов, а также положительно влияет на качество эмбрионов. Нарушение физиологического соотношения МИ и ДХИ может возникнуть вторично на фоне применения некоторых лекарственных препаратов (противосудорожные средства, препараты лития) в результате нарушения абсорбции в кишечнике.
В отличие от большинства тканей яичники могут сохранять нормальную чувствительность к инсулину, даже несмотря на наличие системной ИР. Яичники никогда не становятся инсулинорезистентными, и поэтому компенсаторная гиперинсулинемия чрезмерно стимулирует активность эпимеразы яичников, вызывая избыточный синтез ДХИ за счет конвертации из МИ. Только в яичниках при ИР происходит увеличение содержания ДХИ и снижение МИ [22]. В результате возникающее нарушение соотношения МИ и ДХИ в яичниках может участвовать в патогенезе СПЯ у пациенток с ИР. Было показано, что в яичниках здоровых женщин количество МИ существенно превышает количество ДХИ, достигая соотношения примерно 70–100:1 в нормальных гомеостатических условиях, в то время как у больных СПЯ это соотношение характеризуется специфическим истощением МИ и перегрузкой ДХИ и снижается до значения 0,2:1. Теория «парадокса яичников» объясняет, почему употребление ДХИ в высоких дозах (>1200 мг) и в течение длительного времени (более 3 мес.) не дает выраженных результатов в лечении СПЯ.
В сравнительном исследовании применение комбинации МИ и ДХИ в сравнении с метформином показало лучшие результаты в отношении длительности менструального цикла, появления регулярных менструаций и выраженности гирсутизма у женщин с СПЯ. Эффекты метформина в улучшении действия инсулина у пациенток этой категории достигаются именно благодаря высвобождению ДХИ-содержащего инозитолфосфогликана [33]. В открытом проспективном исследовании действия комбинированных оральных контрацептивов (КОК) (этинилэстрадиол 30 мкг + дроспиренон 3 мг), МИ (4 г МИ, 400 мкг фолиевой кислоты) или их сочетанного приема у девочек-подростков было показано, что у получавших КОК масса тела и ИМТ увеличивались, у получавших МИ эти показатели уменьшались, а у пациенток, принимавших КОК и МИ, масса тела и ИМТ существенно не изменялись. У пациенток, получавших КОК, не было выявлено существенных изменений концентраций С-пептида, инсулина и HOMA-IR, у пациенток из групп МИ и МИ+КОК было выявлено существенное снижение указанных параметров [34]. Для лечения СПЯ у более молодых пациенток (от 13 до 16 лет) следует оценить применение МИ вместо КОК. Такой подход способствует поддержанию нормальной массы тела, ИМТ, обеспечивает улучшение метаболических параметров и помогает избежать или отложить терапию в подростковом возрасте и у молодых женщин. МИ может представлять собой безопасный и функциональный метод ведения младших подростков с СПЯ с помощью немедикаментозного подхода. Подростки старшего возраста (от 17 до 19 лет) чаще всего получают КОК как для предотвращения нежелательной беременности, так и для противодействия симптомам СПЯ. В этом контексте введение МИ в сочетании с КОК препятствует увеличению массы тела и ИМТ, вызванному приемом КОК.
Инозитолы являются одними из передовых средств, которые применяются у девочек-подростков с ожирением, поскольку инозитолы оказывают антиоксидантный эффект, снижают оксидативный стресс, стимулируют клетки поджелудочной железы, активируют транспортер глюкозы GLUT4, увеличивают чувствительность к инсулину, снижают запас жира в адипоцитах, что в итоге приводит к нормализации уровня глюкозы [35].
Важную проблему представляет собой прежде-временная недостаточность яичников (ПНЯ). Распространенность ПНЯ в популяции составляет от 1 до 4%. Наиболее часто диагностируется в 3-й или 4-й декадах жизни. Частота выявления у девочек-подростков выражается соотношением 1:10 000. Наиболее частая причина ПНЯ в этой возрастной группе — генетические аномалии. Вирусные заболевания и факторы окружающей среды могут влиять на функцию фолликулов и вызывать скрытую ПНЯ. Рост частоты ятрогенной ПНЯ у детей наблюдается в связи с ростом выживаемости после лечения онкологических заболеваний. Согласно рекомендациям ESHRE (2016) нет никаких вмешательств, которые бы достоверно повышали активность яичников, и не существует превентивных мер в отношении развития ПНЯ. Особенностями клинических проявлений ПНЯ в подростковом возрасте являются отсутствие у большинства девочек вазомоторных симптомов и вульвовагинальной атрофии. Отмечаются задержка полового развития, вторичная аменорея, рецидивирующие функциональные кисты, аномальные маточные крово-течения. Критически важным является понимание механизмов активации и начального фолликулярного роста, когда количество и качество ооцитов еще не определены окончательно. При снижении количества примордиальных фолликулов менее 1000 регулярной активации фолликулов и их рекрутирования далее не происходит, что приводит к ановуляции и аменорее, делая пациенток с ПНЯ резистентными к стимуляции яичников. В настоящее время предложено 2 пути возможного решения проблемы ПНЯ: овариальная фрагментация, при которой подавляется сигнальный Hippo-путь и рост остаточных, «спящих» фолликулов, и стимуляция фосфатидил-инозитол-3-киназного пути (PI3K-akt-FOXO3), которая активирует «спящие» фолликулы. Комбинация указанных методов в активации яичников in vitro посредством аутотрансплантации овариальной ткани приводит к успешному росту фолликулов. Применение инозитола может служить дополнительным вариантом в попытках сохранения фертильности и активации овариальной функции у юных пациенток со сниженным овариальным резервом.
Таким образом, установлены существенные функциональные различия у стереоизомеров инозитола, несмотря на схожесть химической структуры. Назначение ДХИ в клинической практике должно осуществляться с учетом особенностей пациентки. Правильное соотношение МИ и ДХИ определяет здоровое состояние органов или тканей, в то время как дисбаланс уровней инозитола или его истощение могут стать причиной различных заболеваний. Восстановление физиологического соотношения инозитола или строго контролируемое изменение этого соотношения можно считать разумными подходами к достижению терапевтического эффекта при различных патологических состояниях.
Е.В. Шереметьева «Место инозитолов в комплексной коррекции метаболического синдрома в репродуктивном периоде женщины»
С глобальным распространением ожирения метаболический синдром (МС) стал одной из основных проблем общественного здравоохранения [36]. МС характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гипер-инсулинемией, которые вызывают нарушения углеводного, липидного, пуринового обмена и артериальную гипертензию (АГ). Основной признак МС — центральный (абдоминальный) тип ожирения: окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин. Дополнительными критериями являются: АГ (АД≥140/90 мм рт. ст.), повышение уровня триглицеридов (ТГ) (≥1,7 ммоль/л), снижение уровня ХС ЛПВП, нарушенная гликемия натощак (НГН) — повышенный уровень глюкозы плазмы натощак ≥6,1 и <7 ммоль/л при условии, что глюкоза плазмы через 2 ч при пероральном глюкозотолерантном тесте составляет менее 7,8 ммоль/л, комбинированное НГН / нарушение толерантности к глюкозе (НТГ) — повышенный уровень глюкозы плазмы натощак ≥6,1 и <7 ммоль/л в сочетании с глюкозой плазмы через 2 ч при пероральном глюкозотолерантном тесте ≥7,8 и <11,1 ммоль/л.
На протяжении всей жизни женщины МС влияет на гипоталамо-гипофизарную ось. При МС наблюдается повышение уровня инсулина в крови, что ведет к подавлению синтеза глобулина, связывающего половые гормоны в печени, и повышению выработки яичниковых андрогенов; отмечается усиление ароматизации андрогенов в периферической жировой ткани, которое ведет к повышению уровней эстрогенов в крови; гиперандрогения приводит к апоптозу клеток гранулезы яичников; периферическая конверсия андрогенов в эстрогены подавляет секрецию гонадотропинов [37, 38]. МС с ожирением ассоциируется со снижением уровня АМГ, повышением уровня СРБ в фолликулярной жидкости, что указывает на наличие прямого эффекта МС у женщин в отношении микросреды овариальных фолликулов и является маркером воспаления и оксидативного стресса [39].
У каждой 5-й женщины репродуктивного возраста при повышенных значениях ИМТ/ОТ/ИР встречается олигоменорея. Самая значимая взаимосвязь с олигоменореей была установлена для ОТ [40]. Относительный риск хронической ановуляции, ведущей к бесплодию, был значимо выше у женщин с ИМТ>23,9 кг/м2. Повышенный ИМТ у пациенток в возрасте 18 лет является прогностическим фактором ановуляторного бесплодия вне зависимости от наличия СПЯ.
Главными целями лечения больных с МС следует считать: снижение массы тела, достижение хорошего метаболического контроля, оптимальный уровень АД, предупреждение острых и отдаленных сердечно-сосудистых осложнений. МС должен рассматриваться как преморбидное состояние [41].
Краеугольным камнем лечения МС являются: немедикаментозные мероприятия, направленные на снижение массы тела; изменение стереотипов питания; отказ от вредных привычек; повышение физической активности — т. е. формирование здорового образа жизни.
Последние годы активно изучается роль инозитолов в борьбе с метаболическим «нездоровьем» человека, в том числе у женщин репродуктивного возраста.
Инозитолы рассматриваются в литературе последних десятилетий как один из возможных терапевтических компонентов. Основной функцией инозитолов (особенно МИ и ДХИ) является участие во внутриклеточной передаче сигнала и обеспечении функционирования таких важнейших рецепторов, как рецепторы инсулина, репродуктивных гормонов, факторов роста, катехоламинов и др. МИ является важным синергистом фолатов и других витаминов (В5, РР) и минералов (кальций, магний). МИ участвует в экспрессии переносчиков глюкозы и поглощении глюкозы клетками, тогда как ДХИ в основном участвует в синтезе и хранении гликогена. Производные МИ (такие как фосфатидилинозитолфосфаты) совместно с ионами кальция и магния осуществляют передачу сигнала от инсулинового рецептора внутрь клеток различных тканей (что приводит к повышению экспрессии транспортера глюкозы), инициируют процессы абсорбции рецептора инсулина, стимулируют переработку углеводов и жиров для поддержания энергетического метаболизма клетки, они также необходимы для снижения риска ИР, СД, избыточной массы тела и ожирения.
Миоинозитол и ДХИ присутствуют в яичниках и фолликулярной жидкости и играют роль в передаче сигналов инсулина и развитии фолликулов. В здоровом яичнике баланс между этими двумя изомерами поддерживает нормальную гормональную секрецию и функцию яичников. Эффективность ДХИ в лечении женщин с СПЯ и ожирением связана с улучшением чувствительности тканей к инсулину и улучшением овуляторной функции, снижением концентрации андрогенов в сыворотке крови, снижением АД и концентраций ТГ [13, 42].
Терапия инозитолом (либо МИ + фолиевая кислота, либо МИ + ДХИ + фолиевая кислота) значительно улучшала чувствительность тканей к инсулину, снижала уровни гликозилированного гемоглобина, ХС и ТГ, а также АД (при использовании более 3 мес.).
Инозитолы в комбинации с метформином могут работать как синергисты, что позволяет использовать снижение дозы метформина, особенно у пациенток с плохой его переносимостью. Комбинация метформина и инозитолов показала более выраженное снижение HOMA-IR через 3 мес. лечения (p=0,03), чем монотерапия метформином. Комбинированное лечение также привело к нормализации менструального цикла, ИМТ, купированию акне и гирсутизма, гормональные параметры улучшились в обеих группах, и уровни были сопоставимы через 3 мес. [44].
С позиции метаболического контроля комбинация МИ и ДХИ более эффективна, чем применение одного МИ, в отношении снижения уровня ХС, ЛПНП, ТГ и индекса HOMA [45, 46].
В исследовании М. Januszewski et al. [26] применение МИ и ДХИ в течение 6 мес. приводило к снижению массы тела, а также к снижению уровня тестостерона в сыворотке крови, ФСГ, ЛГ, инсулина и значительному увеличению концентрации глобулина, связывающего половые гормоны (ГСПГ).
При использовании инозитолов показана значительно более высокая частота наступления овуляции в сравнении с плацебо. В исследовании M. Le Donne et al. [47], а также E. Raffone et al. [48] у 65% пациенток, получавших инозитолы, восстановилась спонтанная овуляция по сравнению с 50% пациенток, получавших метформин.
Необходимо подчеркнуть, что не следует использовать высокие дозы ДХИ из-за возможной конкуренции при всасывании в кишечнике и из-за способности ДХИ ингибировать ароматазу, что может иметь негативные последствия для овуляторной функции [49]. ДХИ важен и нужен, поскольку установлено, что малые дозы ДХИ (300–600 мг/сут) способствуют восстановлению овуляции, улучшению либидо и повышению чувствительности тканей к инсулину [50].
Применение МИ в исследованиях [51–53] способствовало снижению риска гестационного диабета на 50–67% у женщин с отягощенным семейным анамнезом по СД 2 типа, а также у женщин с избыточной массой тела и ожирением.
В последние годы активно обсуждается вопрос резистентности к инозитолам. От 25 до 75% женщин могут быть резистентными к лечению инозитолами, причина этого до сих пор не ясна, но может быть связана со степенью выраженности ожирения, ИР и гиперандрогении [54].
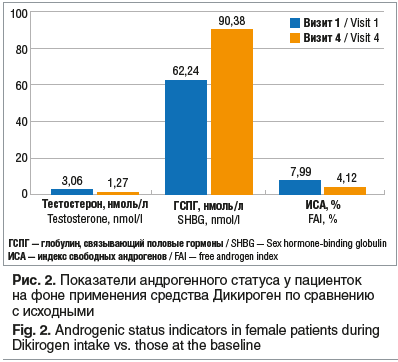
В исследовании Т.А. Обоскаловой и соавт. [55] было изучено влияние комбинации МИ и ДХИ в соотношении 5:1 на показатели андрогенного статуса (рис. 2). Применение Дикирогена в рамках нутрицевтической поддержки у пациенток с СПЯ значимо снижало уровень общего тестостерона и индекса свободных андрогенов (ИСА), способствовало повышению уровня ГСПГ. Было отмечено статистически значимое снижение уровня общего тестостерона и ИСА у женщин при всех фенотипах СПЯ. В исследовании Ю.Э. Доброхотовой и соавт. [56] добавление средства, содержащего МИ и ДХИ в соотношении 5:1, к КОК у пациенток с СПЯ и избыточной массой тела или ожирением способствовало статистически значимому (p<0,05) улучшению показателей липидограммы: снижению уровня общего ХС на 16,9%, ТГ на 15,7%, ХС ЛПНП на 17,8% и увеличению содержания ХС ЛПВП на 28,5%.
В исследовании А.В. Соловьевой и соавт. [57] применение комбинации МИ и ДХИ в соотношении 5:1 у пациенток с аномальными маточными кровотечениями и овуляторной дисфункцией способствовало нормализации продолжительности и регулярности менструального цикла.
Комбинация МИ и ДХИ в соотношении 5:1, марганца и фолиевой кислоты улучшала гликемические и липидные параметры, а также достоверно снижала уровень систолического АД у женщин во II триместре беременности с гестационным СД через 60 дней применения в рамках двойного слепого плацебо-контролируемого исследования [15].
Выбор тактики ведения больных с МС должен быть индивидуальным — в зависимости от степени и типа ожирения, наличия или отсутствия АГ и других проявлений МС. Основа всего — это персонализированная медицина. Применение инозитолов у женщин репродуктивного возраста с МС является рациональным и может быть рекомендовано в рамках добавления к основной патогенетической терапии.
Г.И. Табеева «Перспективы применения инозитолов у пациенток в перименопаузе»
Перименопауза представляет собой период, включающий фазу менопаузального перехода и 1 год после последней менструации (согласно STRAW+10). Гормональные нарушения и менопаузальные симптомы связаны с изменениями сердечно-сосудистой системы независимо от хронологического возраста. Период менопаузального перехода является фактором риска кардиометаболических нарушений (субклинический атеросклероз, увеличение доли висцерального жира, снижение безжировой массы тела, дислипидемия, АГ, ИР). При подозрении на наличие МС или нарушение углеводного обмена (НТГ, СД 2 типа) рекомендуется проведение 2-часового глюкозотолерантного теста [58]. По данным исследования SWAN (Study of Women’s Health Across the Nation) [59], среди 2512 женщин в перименопаузе МС развивался в 12,8% случаев в течение 5 лет наблюдения, его независимым предиктором был уровень образования. Согласно результатам одноцентрового перекрестного ретроспективного анализа у женщин в перименопаузе существенно чаще встречаются висцеральное ожирение, МС и неалкогольная жировая болезнь печени [60]. Гормональные изменения, снижение физической активности и основного обмена, генетическая предрасположенность способствуют изменениям композиционного состава тела в фазе менопаузального перехода независимо от хронологического старения. Именно за 2 года до последней менструации начинается ускоренное накопление жировой ткани и снижение мышечной массы, которое продолжается в течение 2 лет в ранней постменопаузе, после чего наступает стадия плато [59, 61]. Висцеральная жировая ткань является источником проатерогенных факторов, увеличивает уровень ангиотензина II, факторов свертывания и воспалительных цитокинов, способствуя развитию хронического воспаления и ИР, что является факторами риска СД 2 типа и ССЗ. Кроме этого, висцеральное ожирение у женщин в постменопаузе увеличивает риск смерти от ССЗ и рака. Женщины с нормальной массой тела и висцеральным ожирением имеют более высокий риск смерти от ССЗ и рака по сравнению с женщинами с нормальной массой тела и без висцерального ожирения, т. е. важен не ИМТ, а количество висцерального жира. Кроме ИМТ, используются следующие методы оценки композиционного состава тела: измерение ОТ, двухэнергетическая рентгеновская абсорбциометрия (ДРЭА) и биоимпедансометрия. ОТ≥80 см — диагностический критерий абдоминального ожирения. ДРЭА позволяет определить количество общей жировой ткани и мышечной ткани и их распределение, а также количество висцерального жира. Метод обладает большей прогностической ценностью в отношении риска кардиометаболических заболеваний, чем антропометрические показатели. В настоящее время нет общепринятых референсных значений параметров ДРЭА. Согласно рекомендациям Ассоциации клинических эндокринологов и Американского колледжа эндокринологии (1998) содержание общей жировой ткани более 35% считается критерием ожирения у женщин независимо от возраста [62].
Стратегии ведения женщин с МС в периоде перименопаузы включают изменение образа жизни (коррекция питания и физические нагрузки); гормональную контрацепцию (желательно включающую эстрогены, приближенные к натуральным), при необходимости — предохранение от нежелательной беременности; лечение климактерического синдрома (менопаузальная гормональная терапия — стандартная или низкая доза эстрогенов, альтернативные методы лечения); нутрицевтики (БАД, фитоэстрогены, витамины); при необходимости — лечение ожирения (медикаментозное, хирургическое); гиполипидемическую терапию; антигипертензивную терапию; сахароснижающие препараты [58, 63].
В настоящее время обсуждается роль дефицита инозитолов в развитии МС. Известно, что МИ и ДХИ синергично участвуют в метаболизме глюкозы. Влияние МИ на показатели МС у женщин в постменопаузе было продемонстрировано в ряде клинических исследований, срок применения МИ составлял от 6 до 12 мес. [64–66]. В исследовании D. Giordano et al. [64] с участием 80 женщин прием МИ в течение 6 мес. способствовал существенному снижению диастолического АД (-11%), HOMA-индекса (-75%), уровня ТГ (-20%) и повышению уровня ХС ЛПВП (22%) по сравнению с показателями у женщин из группы плацебо.
Комбинация МИ и ДХИ в соотношении 5:1 с марганцем и фолиевой кислотой (Дикироген) представляет собой оригинальное негормональное средство для улучшения функционального состояния женской репродуктивной системы и углеводного и липидного обмена. Преимуществом данной комбинации является наличие марганца, дефицит которого может наблюдаться у женщин в период менопаузы.
Таким образом, перименопауза является особым периодом в жизни женщины, который сопровождается кардиометаболическими нарушениями, повышенным риском ССЗ, СД и онкопатологии. При подозрении на МС необходимо рекомендовать обследование, включающее оценку композиционного состава тела, АД, липидного профиля, гликемии, и проведение 2-часового глюкозотолерантного теста. С целью устранения проявлений МС следует рекомендовать коррекцию образа жизни, повышение физической активности, при необходимости — консультацию смежных специалистов: кардиолога, эндокринолога или терапевта. Применение комбинации МИ и ДХИ в соотношении 5:1 с фолиевой кислотой и марганцем следует рассматривать в качестве перспективной альтернативы коррекции метаболических нарушений у женщин в перименопаузе.
Сведения об авторах:
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Громова Ольга Алексеевна — д.м.н., профессор, научный руководитель ФИЦ ИУ РАН; 119333, Россия, г. Москва, ул. Вавилова, д. 42; ORCID iD 0000-0002-7663-710X.
Духанин Александр Сергеевич — д.м.н., профессор кафед-ры молекулярной фармакологии и радиобиологии РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2433-7727.
Кумыкова Заира Хасановна — к.м.н., с.н.с. 2-го гинекологического отделения (гинекологии детского и юношеского возраста) ФГБУ «НМИЦ АГП им. В.И. Кулакова» Мин-здрава России; 117997, Россия, г. Москва, ул. Академика Опарина, д. 4; ORCID iD 0000-0001-7511-1432.
Шереметьева Екатерина Викторовна — к.м.н., в.н.с. ФГБУ «НМИЦ эндокринологии» Минздрава России; 117292, Россия, г. Москва, ул. Дм. Ульянова, д. 11; ORCID iD 0000-0001-7177-0254.
Табеева Гюзаль Искандеровна — к.м.н., с.н.с. ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России; 117997, Россия, г. Москва, ул. Академика Опарина, д. 4; ORCID iD 0000-0003-1498-6520.
Контактная информация: Доброхотова Юлия Эдуардовна, e-mail: pr.dobrohotova@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.10.2022.
Поступила после рецензирования 01.11.2022.
Принята в печать 25.11.2022.
About the authors:
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Head of the Department of Obstetrics and Gynecology, Faculty of Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-7830-2290.
Olga A. Gromova — Dr. Sc. (Med.), Professor, Research Director, Federal Research Center «Informatics and Management» of the Russian Academy of Sciences; 42, Vavilov str., Moscow, 119333, Russian Federation; ORCID iD 0000-0002-7663-710X.
Aleksandr S. Dukhanin — Dr. Sc. (Med.), Professor of the Department of Molecular Pharmacology and Radiobiology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-2433-7727.
Zaira Kh. Kumykova — C. Sc. (Med.), senior researcher of the Gynecological Department (Pediatric and Adolescent Gynecology), V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology; 4, Academician Oparin str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-7511-1432.
Ekaterina V. Sheremetyeva — C. Sc. (Med.), leading researcher, National Medical Research Center of Endocrinology; 11, Dmitriy Ul’yanov str., Moscow, 117036, Russian Federation; ORCID iD 0000-0001-7177-0254.
Gyuzal I. Tabeeva — C. Sc. (Med.), senior researcher, V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology; 4, Academician Oparin str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-1498-6520.
Contact information: Yulia E. Dobrokhotova, e-mail: pr.dobrohotova@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 07.10.2022.
Revised 01.11.2022.
Accepted 25.11.2022.
Информация с rmj.ru