Содержание статьи
Введение
Сахарный диабет 1 типа (СД1) — это тяжелое хроническое аутоиммунное заболевание, требующее постоянной инсулинотерапии для поддержания показателей гликемического контроля в диапазонах, снижающих риски развития и прогрессирования специфических осложнений [1]. Прогресс в области медицинских технологий в значительной мере изменил прогноз течения многих тяжелых заболеваний. Так, в свое время открытие инсулина Ф. Бантингом и Ч. Бестом полностью перевернуло существовавшие представления и подходы к лечению сахарного диабета. Однако полный химический синтез человеческого инсулина был осуществлен только в 1974 г., а первые генно-инженерные человеческие инсулины получили одобрение на клиническое использование в 1982 г. [2]. Современные инсулины относятся к классу лекарственных средств, производимых с помощью биотехнологий.
Истечение срока патентной защиты оригинального биопрепарата открывает возможность для создания его версии, или биосимиляра (англ.: biological drug — биологический препарат и similar — похожий). Стремительное появление биосимиляров инсулина вызывает значительный научный и клинический интерес отчасти потому, что в отличие от типичного низкомолекулярного продукта инсулин имеет четко определенные первичную, вторичную и третичную структуры, которые оказывают решающее влияние на его биологическое действие [3]. Вариации в процессе производства могут оказывать заметное влияние как на безопасность, так и на эффективность инсулина [4, 5], и различия в его составе могут привести к изменениям фармакокинетики и фармакодинамики [6].
Биосимиляр инсулина является биоэквивалентным, если доказана сопоставимость с референтным инсулином на всех этапах доклинических и клинических исследований. Клинические исследования биосимиляров у детей не проводятся ни в Российской Федерации, ни в странах с высоким уровнем регулирования. Такой подход к исследованиям биосимиляров инсулина закреплен в международных руководствах Европейского медицинского агентства (EMEA, Европейский союз) [7] и Комиссии по контролю за качеством пищевых и лекарственных средств (FDA, США) [8]. Российское законодательство полностью синхронизировано с европейскими стандартами в отношении подходов к оценке биоэквивалентности биоподобных препаратов [9].
Под биоэквивалентностью лекарственного препарата понимается достижение сопоставимых показателей скорости всасывания, степени поступления к месту действия и скорости выведения одного или нескольких обладающих фармакологической активностью действующих веществ при использовании лекарственного препарата для медицинского применения, имеющих одно международное непатентованное (или химическое, или группировочное) наименование, в эквивалентных дозировках и при одинаковом способе введения [3]. Однако нужно учитывать и тот факт, что клинические эффекты, индуцированные одной и той же дозой одного и того же инсулина, имеют различия не только у разных людей (межиндивидуальная вариабельность действия), но и у одного человека (интраиндивидуальная вариабельность действия). Эти различия могут быть связаны со скоростью абсорбции, метаболизма (фармакокинетический аспект вариабельности) и действия инсулина (фармакодинамический аспект).
Высокая вариабельность кинетики и действия инсулина может затруднять подбор доз и повышать риски развития гипогликемий [10]. Поэтому при сравнении биосимиляра с оригинальным инсулином EMA требует приводить результаты эугликемического гиперинсулинемического клэмпа [7].
В течение последних лет в некоторых регионах Российской Федерации происходит замена оригинальных препаратов инсулина на биосимиляры, что сопровождается возрастающим числом родительских страхов и тревог, касающихся эффективности и безопасности такой смены инсулинотерапии.
Успешное внедрение биосимиляров зачастую зависит от согласия пациента. Исследования [11–13] показывают, что некоторые пациенты негативно относятся к биоаналогам и не желают отказываться от оригинальных препаратов. Негативное восприятие основано на убеждении, что биоаналоги не соответствуют стандартам качества, безопасности и эффективности [11, 13]. Пациенты также сообщают об опасениях по поводу перехода на биосимиляр без предварительного обсуждения с лечащим врачом [12] и считают, что более низкая стоимость связана с более низким качеством [11]. Негативное восприятие способно вызывать реакцию ноцебо и усиливать преднамеренное несоблюдение режима лечения, что в итоге приводит к напрасной трате ресурсов здравоохранения [14]. В другом, уже маркетинговом исследовании [15] среди пациентов с сахарным диабетом 1 и 2 типа примерно 66% респондентов сообщили, что они согласны перейти на гипотетический менее дорогой биоаналог инсулина, рекомендованный их лечащим врачом, если он будет таким же безопасным и эффективным, как и оригинальный препарат.
Исследований, описывающих применение биосимиляров инсулина у детей, в настоящее время критически мало не только в отечественных, но и в зарубежных источниках, поэтому описание реального клинического опыта является остроактуальным.
Цель исследования: изучить возможное влияние смены терапии оригинальными препаратами инсулина на терапию с использованием отечественных биосимиляров аналога инсулина гларгин (баиГ) и лизпро (баиЛ) на показатели гликемического контроля у подростков с СД1.
Материал и методы
Проведено 24-недельное обсервационное клиническое исследование на базе Городского детского эндокринологического центра Санкт-Петербурга. В исследование были включены подростки с СД1, получающие инсулинотерапию в режиме многократных ежедневных инъекций (МЕИ), со стажем заболевания более 1 года, использующие для контроля гликемии систему флэш-мониторирования гликемии (ФМГ). Критерии исключения: нарушения функции печени, почек, надпочечниковая недостаточность, целиакия, нарушение функции щитовидной железы, наличие анемии, эпизода диабетического кетоацидоза или тяжелой гипогликемии в течение последнего года. Обследовано 24 подростка с СД1 в возрасте от 12 до 15 лет (средний возраст 13,4±1,1 года) — 13 мальчиков (54,2%, средний возраст 13,1±1,1 года) и 11 девочек (45,8%, средний возраст 13,0±0,9 года). Длительность заболевания составляла 4,0±1,1 года у мальчиков и 4,3±1,8 года у девочек. Инсулинотерапия проводилась оригинальными препаратами инсулина баиЛ и баиГ в режиме МЕИ. Перевод на инсулинотерапию биосимилярами осуществлялся в соотношении 1:1, корректировали дозу пациенты самостоятельно. Контроль показателей гликемии осуществлялся системой ФМГ. Оценивалось время в целевом диапазоне (TIR) 3,9–10,0 ммоль/л, время выше целевого диапазона (TAR) >10,0 ммоль/л, время ниже целевого диапазона (TBR) <3,9 ммоль/л и уровень гликированного гемоглобина (HbA1c) на фоне терапии оригинальными препаратами инсулина и через 3 и 6 мес. после перевода на терапию отечественными биосимилярами инсулина баиЛ (РинЛиз®) и баиГ (РинГлар®).
Уровень HbA1c оценивался иммунохимическим методом. Параметры TIR, TAR и TBR рассчитывались автоматически и оценивались согласно Международному консенсусу по использованию систем непрерывного мониторирования гликемии и времени в целевом диапазоне по отчетам стандартного амбулаторного профиля глюкозы [16].
Дополнительного структурированного обучения в специализированных школах диабета не проводилось.
Статистический анализ проводился с использованием программы StatTech v. 2.6.5. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка (при числе исследуемых менее 50) или критерия Колмогорова — Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента.
Результаты исследования
По результатам отчетов системы ФМГ подростки c СД1 имели следующие исходные показатели гликемического контроля: TIR 64,7±11,1%, TAR 26,3±12,2%, TBR 8,9±4,8%, HbA1c 7,7±1,1%. Гендерных различий в исследуемых показателях не отмечалось: уровень HbA1c у мальчиков — 7,78±1,39%, у девочек — 7,70±0,76% (p>0,05); TIR у мальчиков — 65,8±13,1%, у девочек — 63,5±8,6% (р>0,05); TAR у мальчиков — 24,8±13,8%, у девочек — 28,0±10,3% (p>0,05); TBR у мальчиков — 9,3±5,4%, у девочек — 8,4±4,2% (p>0,05). Суточная доза инсулина (СДИ) составила у мальчиков 1,2±0,4 ед/кг, у девочек 1,4±0,3 ед/кг (р>0,05).
Через 3 и 6 мес. после перевода на терапию с использованием отечественных биосимиляров баиЛ и баиГ у детей не отмечалось статистически значимых различий в исследуемых показателях гликемического контроля (табл. 1). СДИ значимо не изменилась. Гендерных различий в исследуемых показателях также не отмечено.
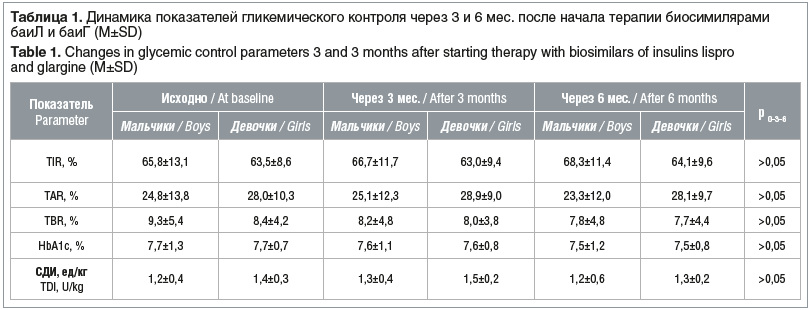
За период наблюдения количество пациентов, достигающих оптимальных показателей гликемического контроля (уровень HbA1c <7,0%, TIR>70%), оставалось без достоверных изменений (табл. 2).
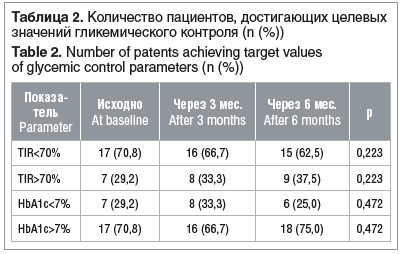
Полученные данные указывают на отсутствие клинически значимого ухудшения показателей гликемического контроля после перевода подростков с СД1 на терапию отечественными биосимилярами баиЛ и баиГ.
Обсуждение
Существует четкое различие между биоподобностью и взаимозаменяемостью — подтверждение биоподобности не означает полной взаимозаменяемости. Биоподобный продукт может иметь такую же эффективность, переносимость и безопасность, что и оригинальный препарат, но для перехода терапии с одного препарата на другой может потребоваться участие врача. Клиницисты, назначающие инсулин, обычно избегают перевода пациентов с одной формы инсулина на другую без веской причины, так как смена инсулинов, как правило, сопровождается необходимостью коррекции дозы базального и прандиального инсулинов, что в ряде случаев приводит к увеличению частоты эпизодов гипогликемии [17].
У некоторых пациентов с СД1 часто развивается психологическая зависимость от конкретного типа инсулина, обусловленная страхом возможной нестабильности уровня глюкозы при смене препарата инсулина [18]. Часть из них убеждена, что смена режима терапии может привести к заметному ухудшению контроля уровня глюкозы, что сопровождается ухудшением качества жизни и увеличением потребности в медицинской помощи в долгосрочной перспективе [19].
Таким образом, пациенты обычно не желают переходить на другую форму инсулина без веской причины. Обозначение взаимозаменяемости (гарантия того, что действие инсулина идентично, а не просто похоже на действие исходного инсулина) делает взгляд на такие изменения более позитивным.
Результатом нашего исследования стали сопоставимые с исходным уровни HbA1c через 3 и 6 мес. после начала терапии биосимилярами. Схожие результаты получены в исследовании T.C. Blevins et al. [20], в котором была продемонстрирована одинаковая эффективность на фоне применения оригинального гларгина и при переводе пациентов на биоаналог (биосимиляр) LY IGlar (24 нед. наблюдения) по показателям HbA1c.
Проведенные исследования [21–23] подтвердили, что не отмечалось статистически значимых различий в частоте гипогликемий между группой пациентов, получавших биоаналог (биосимиляр) гларгина MYL-1501D, и контрольной группой, находящейся на терапии оригинальным гларгином. C. Kapitza et al. [21] продемонстрировали, что участники, несколько раз переключавшиеся между эталонным гларгином и его биоаналогом (биосимиляром) MYL-1501D, достигали аналогичного контроля уровня глюкозы с аналогичным профилем безопасности.
В исследовании SORELLA 1 [22] показана не меньшая эффективность биосимиляра лизпро SAR342434 (SA-Lis) в снижении уровня HbA1c по сравнению с оригинальным препаратом. Кроме того, было проведено исследование [23] по безопасности и совместимости SAR342434 (SA-Lis) у взрослых, получающих инсулинотерапию методом постоянной подкожной инфузии. По его результатам в 2017 г. Комитет EMA по медицинским продуктам для человека вынес положительное заключение и разрешил продажу SA-Lis в Европе.
Все эти исследования продемонстрировали одинаковую эффективность и безопасность терапии при переходе с оригинального инсулина на биоаналог (биосимиляр).
Поскольку показатели HbA1c не отражают краткосрочных колебаний гликемии, данные непрерывного мониторирования гликемии и ФМГ в дополнение к показателям HbA1c могут предоставить более полную картину гликемии и ее вариабельности при попытках понять гликемические паттерны и в итоге оптимизировать контроль. Поэтому одной из целей нашего исследования была оценка влияния терапии биосимилярами баиЛ и баиГ на показатели TIR, TAR и TBR, величина которых коррелирует с уровнем HbA1c [24]. Полученные результаты продемонстрировали достижение не худших показателей TIR, TAR и TBR при использовании биосимиляров баиЛ и баиГ по сравнению с терапией оригинальными препаратами.
Заключение
Несмотря на бурный прогресс в области диабетологических технологий, достижение оптимальных показателей гликемического контроля остается серьезным вызовом не только для пациентов с СД1 и их семей, но и для специалистов здравоохранения [25]. Известно, что наиболее уязвимым с точки зрения компенсации нарушений углеводного обмена является подростковый возраст — возраст когнитивного, психосоциального и физического созревания, с началом которого гликемический контроль часто значимо ухудшается, несмотря на сопутствующее увеличение доз инсулина [26]. Поэтому любые изменения инсулинотерапии, будь то смена метода введения (режим МЕИ или постоянная подкожная инфузия) или замена препарата, должны быть максимально деликатными и щадящими.
Полученные нами данные указывают на отсутствие клинически значимого ухудшения показателей гликемического контроля после перевода подростков с СД1 на терапию отечественными биосимилярами баиЛ и баиГ, что предполагает возможность их безопасного и эффективного применения у данной категории пациентов.
Сведения об авторах:
Платонов Вадим Валерьевич — к.м.н., врач — детский эндокринолог Городского детского эндокринологического центра СПб ГБУЗ ДГМКЦ ВМТ им. К.А. Раухфуса; 191036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8; ассистент кафедры детских болезней им. И.М. Воронцова ФПВ и ДПО ФГБОУ ВО СПбГПМУ Минздрава России;
194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0003-0923-6223.
Дубинина Татьяна Александровна — главный внештатный детский эндокринолог г. Санкт-Петербурга, заведующая Городским детским эндокринологическим центром СПб ГБУЗ ДГМКЦ ВМТ им. К.А. Раухфуса; 191036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8.
Патракеева Евгения Михайловна — главный врач ООО КДФ-СПб (Клиника Доктора Фомина Санкт-Петербург); 191014, Россия, г. Санкт-Петербург, пер. Басков, д. 2, стр. 1; ORCID iD 0000-0003-0903-6395.
Резвых Анастасия Михайловна — врач-педиатр, клинический ординатор ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2.
Казаченко Наталья Васильевна — к.м.н., врач — детский эндокринолог Городского детского эндокринологического центра СПб ГБУЗ ДГМКЦ ВМТ им. К.А. Раухфуса; 191036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8; ORCID iD 0000-0002-1079-6378.
Контактная информация: Платонов Вадим Валерьевич, e-mail: v_platonov@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 06.02.2022.
Поступила после рецензирования 02.03.2022.
Принята в печать 29.03.2022.
About the authors:
Vadim V. Platonov — C. Sc. (Med.), pediatric endocrinologist, City Children Endocrinological Center of the K.A. Raukhfus Children’s City Multidisciplinary Clinical Center of High Medical Technologies; 8, Ligovskiy av., St. Peterburg, 191036, Russian Federation; assistant of the I.M. Vorontsov Department of Children’s Diseases of the Faculty of Post-Institute and Additional Professional Education, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Peterburg, 194100, Russian Federation; ORCID iD 0000-0003-0923-6223.
Tatyana A. Dubinina — Chief Visiting Pediatric Endocrinologist of St. Petersburg, Head of the City Children Endocrinological Center of the K.A. Raukhfus Children’s City Multidisciplinary Clinical Center of High Medical Technologies; 8, Ligovskiy av., St. Peterburg, 191036, Russian Federation.
Evgeniya M. Patrakeeva — Head Doctor, Dr. Fomin’s Clinics in St. Petersburg; 2 build. 1, Baskov lane, St. Petersburg, 191014, Russian Federation; ORCID iD 0000-0003-0903-6395.
Anastasiya M. Rezvykh — pediatrician, clinical resident, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation.
Natalya V. Kazachenko — C. Sc. (Med.), pediatric endocrinologist, City Children Endocrinological Center of the K.A. Raukhfus Children’s City Multidisciplinary Clinical Center of High Medical Technologies; 8, Ligovskiy av., St. Peterburg, 191036, Russian Federation; ORCID iD 0000-0002-1079-6378.
Contact information: Vadim V. Platonov, e-mail: v_platonov@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 06.02.2022.
Revised 02.03.2022.
Accepted 29.03.2022.
.
Информация с rmj.ru





