Содержание статьи
Введение
Гастроинтестинальные стромальные опухоли (ГИСО) считаются редкими мезенхимальными новообразованиями, первичная заболеваемость оценивается от 7 до 20 слу-чаев на 1 млн человек в год. Однако среди злокачественных подслизистых образований желудочно-кишечного тракта именно ГИСО являются наиболее распространенными. Диагностируют заболевание, как правило, у пациентов старше 60 лет, без выраженного полового диморфизма. ГИСО могут обнаруживаться на всем протяжении пищеварительной трубки, чаще всего они локализуются в желудке (50–60%) или в тонкой кишке (25–35%), также могут встречаться в толстой (<7%) или прямой (<5%) кишке, очень редко в пищеводе (1%). Встречаются первичные ГИСО, локализующиеся вне полых органов, например в сальнике или забрюшинном пространстве [1, 2].
Гистологическими вариантами ГИСО являются веретеноклеточный (70%), эпителиоидноклеточный (20%) или смешанный типы (10%). Могут присутствовать клеточноядерный полиморфизм, участки склероза и гиалиноза (склерозирующий тип), миксоидной трансформации стромы. Встречаются палисадоподобные и гиперклеточные субтипы; первый, как правило, выявляется в ГИСО по ходу тонкой кишки, последний нередко сопровождается высокой митотической активностью [3].
Ранее считалось, что ГИСО происходят из гастроинтестинальных стромальных клеток, однако в настоящее время установлено, что ГИСО развиваются из интерстициальных клеток Кахаля, в результате онкогенных мутаций в рецепторе тирозинкиназы (KIT) или в α-рецепторе фактора роста тромбоцитов (Platelet Derived Growth Factor Receptor α, PDGFR-α). Мутации KIT имеют 56–92% больных ГИСО, у 5–10% пациентов обнаруживают мутации PDGFR-α, при этом мутации KIT и PDGFR-α являются взаимоисключающими. Мутации KIT чаще локализуются в 11 (70%) и 9 (10%) экзонах, реже в экзонах 13 (1%) или 17 (1%). Мутации PDGFR-α локализуются в экзонах 18 (5%), 12 (1%), или 14 (<1%). ГИСО с мутациями PDGFR-α чаще всего исходят из желудка (90–93%). Выделяют также дикий тип ГИСО (12–15%), без мутаций в рецепторах KIT и PDGFR-α, который может быть классифицирован на группы в зависимости от наличия или отсутствия дефицита сукцинатдегидрогеназы (СДГ). Группа дефицита СДГ включает триаду Carney и синдром Carney — Stratakis, группа без дефицита СДГ включает нейрофиброматоз 1 типа и ГИСО с BRAF-, KRAS-, PIK3CA-мутациями. Считается, что дикий тип ГИСО обладает более низким потенциалом малигнизации [4–6].
Клиническая картина, диагностика и дифференциальная диагностика ГИСО
Особенностью ГИСО является бессимптомное течение на ранней стадии заболевания и отсутствие специфических клинических признаков. По данным литературы, от 15% до 30% ГИСО протекают бессимптомно и диагностируются случайно — во время обследований или хирургических вмешательств по поводу других заболеваний или на аутопсии (10%). По мере роста опухоли появляются неспе-цифические симптомы, такие как боль в эпигастрии, утомляемость, тошнота, анорексия, потеря массы тела и др. Изъязвление слизистой оболочки может привести к развитию желудочно-кишечного кровотечения с последующей анемией, что требует тщательной дифференциальной диагностики с пептическими язвами желудка и двенадцатиперстной кишки. Также могут наблюдаться симптомы, обусловленные сдавлением/стенозированием просвета определенного участка пищеварительной трубки: описаны случаи билиарной обструкции на фоне ГИСО ампулы фатерова соска, дисфагии при поражении пищевода, констипации, обусловленной ГИСО прямой кишки [7, 8].
Алгоритм обследования больных с подозрением на ГИСО включает в себя эндоскопические и лучевые методы диагностики. Эндоскопическая картина довольно вариабельна: образования могут иметь размеры от 1–2 до 20–30 см. При небольшом размере опухолевого узла эндоскопическая картина может соответствовать, в зависимости от характера роста, неизмененному органу (при экстраорганной форме), сдавлению извне (при смешанной форме) или подслизистому образованию (при эндоорганной форме). Дифференциальная диагностика включает в себя широкий круг нозологических единиц: экзоорганные компрессии, подслизистые варикозные узлы, аберрантную поджелудочную железу, инфильтративный рак, лейомиому, шванному, липому и др. Получить достаточный гистологический материал для диагностики ГИСО при стандартной эндоскопии очень сложно, так как опухоль покрыта нормальной слизистой [9–11].
Ключевым методом дифференциальной диагностики является эндоскопическая ультрасонография (ЭУС), которая позволяет с высокой точностью отличить ГИСО (гипоэхогенные солидные массы) от других подслизистых образований, а при выполнении ЭУС-ассистированной тонкоигольной биопсии возможен забор материала из подслизистого образования для последующего морфологического и иммуногистохимического (ИГХ) исследования [12, 13].
Компьютерная томография (КТ) используется в качестве уточняющего метода диагностики, так как дает более четкое представление о размере, характере роста опухоли, инвазии соседних органов и структур, а также наличии метастазов. На компьютерной томограмме ГИСО выглядят как образования с неоднородной внутренней структурой и четкими контурами, при внутривенном контрастировании отмечается выраженное неравномерное «усиление» опухолевых масс в ранние фазы исследования [14, 15].
Основным методом верификации ГИСО является ИГХ-исследование с определением специфических маркеров. Для ИГХ-картины ГИСО характерна экспрессия CD117 (KIT, экспрессируется до 95% всех ГИСО), аноктамина 1 (DOG1, определяется в 87% случаев), CD34 (обнаруживают в 60–70% опухолей) и ряда других маркеров (гладкомышечный актин, десмин, S-100, общий кератин). Согласно рекомендациям ведущих онкологических сообществ диагноз ГИСО устанавливают на основании морфологического исследования биоптатов с обязательным проведением ИГХ-исследования на выявление вышеуказанных маркеров [7, 11, 16–18].
Лечение и прогноз
Хирургическое вмешательство в настоящее время применяется как основной метод лечения больных с локализованными и местно-распространенными формами ГИСО. При нерезектабельных опухолях, наличии метастазов или при рецидиве ГИСО лечение заключается в назначении ингибиторов тирозинкиназы (иматиниб) [17, 19]. По различным данным, от 10% до 30% ГИСО имеют злокачественный потенциал. ГИСО принято классифицировать по риску малигнизации: очень низкий, низкий, умеренный, высокий. Основными прогностическими факторами для ГИСО, согласно современным международным консенсусам, являются митотический индекс (количество митозов на площади 5 мм2 опухоли при увеличении 400), размер и локализация опухоли. При этом риск метастазирования ГИСО увеличивается в зависимости от размера первичной опухоли, независимо от митотического индекса. Также необходимо отметить значение маркера пролиферативной активности Ki-67, уровень экспрессии которого достоверно повышается с ростом риска агрессивности ГИСО, что используют для оценки степени злокачественности и прогноза. Принято считать, что ГИСО желудка при прочих равных характеристиках имеют более благоприятный прогноз [18, 20, 21].
Определение типов мутаций в различных экзонах KIT и PDGFR-α также является важным прогностическим маркером, который позволяет судить как о клиническом течении заболевания, так и о предполагаемом ответе опухоли на терапию ингибиторами тирозинкиназы [22]. По данным метаанализа L. Yan et al. [23]
(20 исследований, 3780 пациентов), выживаемость без прогрессирования ГИСО была значительно хуже у пациентов с мутациями экзона 9 KIT, чем у пациентов с мутациями экзона 11 KIT (отношение шансов [ОШ] 3,60, 95% доверительный интервал [ДИ] 2,17–5,98, z=4,96, p<0,00001, гетерогенность I2=0%). Мутации KIT значительно чаще наблюдались у пациентов с большим размером (≥5 см) ГИСО (ОШ 1,51, 95% ДИ 1,05–2,17, z=2,22, p=0,03, гетерогенность I2=0%, p=0,97), а также у пациентов с более высоким (≥5/50 HPFs) митотическим индексом (ОШ 1,76, 95% ДИ 1,05–2,95, z=2,15, p=0,03, гетерогенность I2=57%, p=0,03).
Собственное клиническое наблюдение ГИСО
Пациентка Б., 67 лет, в марте 2019 г. обратилась к терапевту по месту жительства с жалобами на боли слабой интенсивности в эпигастрии, эпизоды головокружения на фоне болевого синдрома, тошноту после приема пищи, изжогу, а также боли в гипогастрии, не связанные с актом дефекации и мочеиспусканием. Стул ежедневный, тип 4 по Бристольской шкале, без патологических примесей. Ухудшение самочувствия отмечает в последние 2 мес. В течение длительного времени страдает хроническим гастритом, хроническим некалькулезным холециститом. При физикальном обследовании состояние удовлетворительное; патологических изменений со стороны сердечно-сосудистой и дыхательной систем не выявлено; живот не вздут, мягкий, болезненный при пальпации в эпигастрии, в проекции поперечно-ободочной кишки. Анализы крови в пределах референсных значений. По данным УЗИ органов брюшной полости от 08.04.2019 печень не увеличена, эхогенность ее не изменена, диаметр воротной вены 10 мм, диаметр холедоха 4 мм; желчный пузырь с перегибами, стенки 2 мм, не утолщены, в просвете эхопозитивный подвижный осадок; поджелудочная железа размерами 16×10×14 мм, в области тела лоцируется гипоэхогенное образование 21×20 мм. Для уточнения характера выявленных изменений 23.04.2019 пациентке выполнена КТ органов грудной клетки и брюшной полости с внутривенным контрастированием (йопамидол). На серии снимков легких с двух сторон выявлены очаги с четкими, неровными, бугристыми контурами, накапливающие контрастный препарат с повышением плотности
от 13 HU до 93 HU (справа в S3 размерами 8×10 мм, в аксиллярном субсегменте — до 7 мм, слева в S5 — до 3 мм), небольшие участки уплотнения легочной ткани в S6 слева и S9 справа. Увеличенных внутригрудных лимфатических узлов не выявлено. На серии снимков органов брюшной полости по заднемедиальной стенке верхней трети желудка выявлено образование, расположенное кнаружи от желудка, размерами 18×21×13 мм, с четкими контурами, накапливающее контрастный препарат с повышением плотности от 41 HU
до 71 HU (рис. 1).
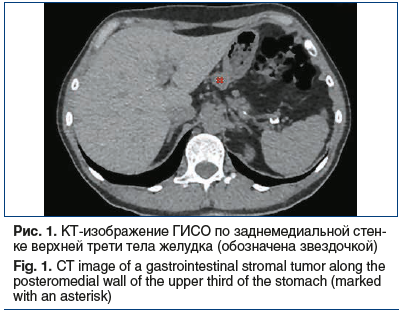
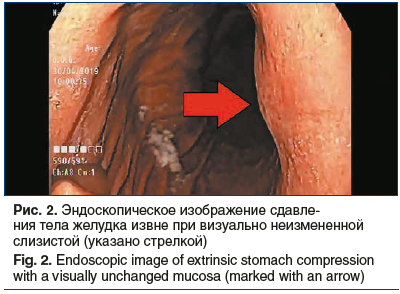
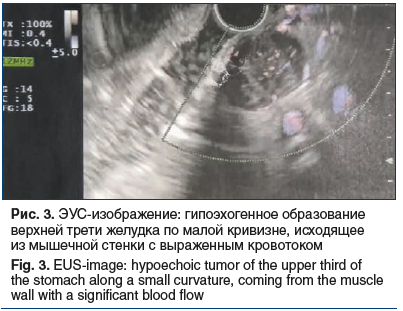
Образование прилежит к стенке желудка на протяжении около 10 мм. Структура паренхимы печени однородная, равномерно накапливает контрастный препарат. Внутри- и внепеченочные желчные протоки не расширены. Желчный пузырь не увеличен, содержимое его однородное, рентгеноконтрастных конкрементов не выявлено, утолщения стенки нет. Воротная и селезеночная вены не расширены, селезенка не увеличена, однородной структуры. Поджелудочная железа не увеличена, однородной структуры, очагов патологического накопления контрастного препарата не выявлено, парапанкреатическая клетчатка не инфильтрирована. Грудной и поясничный отделы позвоночника с дегенеративно-дистрофическими изменениями. Структура тел грудных и поясничных позвонков, а также подвздошных костей неоднородная за счет множественных зон разрежения костной структуры с четкими контурами. Выявляются зоны остеосклероза в теле L4 (4 мм) и в теле левой подвздошной кости (4×6 мм), гемангиома в теле Th9. Для уточнения характера костных изменений выполнена остеосцинтиграфия, убедительных данных за специфическое поражение скелета не получено. С учетом выявленного экзофитного образования, исходящего из желудка, 30.04.2019 пациентке выполнено стандартное эндоскопическое исследование: пищевод свободно проходим, слизистая гиперемирована, на всем протяжении определяется творожистый несмещаемый белесоватый налет. Розетка кардии зияет. Слизистая оболочка желудка пролабирует в пищевод, в области пищеводно-желудочного перехода — кольцо Шацкого с ранимой слизистой в этой области. Форма желудка не изменена. Слизистая диффузно гиперемирована, в антральном отделе 4 острые эрозии под фибрином размерами до 3 мм. По задней стенке желудка визуализируется незначительное сдавление просвета желудка извне на фоне неизмененной слизистой (рис. 2). Для уточнения характера новообразования 17.06.2019 пациентке выполнена ЭУС: в верхней трети тела желудка по малой кривизне, ближе к задней стенке определяется подслизистое образование размером до 15 мм, округлой формы, умеренно выступающее в просвет желудка без его деформации, покрытое неизмененной слизистой. Образование плотное при инструментальной пальпации. При сканировании стенки желудка с частотой 7,5–12 МГц определяется округлой формы, негомогенное, преимущественно гипоэхогенное образование размером до 20 мм, исходящее из мышечной стенки, с преимущественным экстраорганным ростом, с выраженным кровотоком (рис. 3).
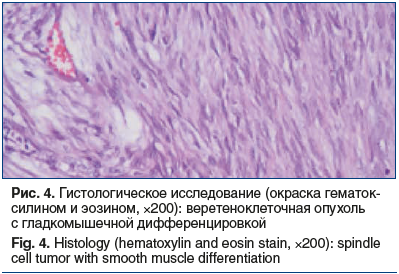
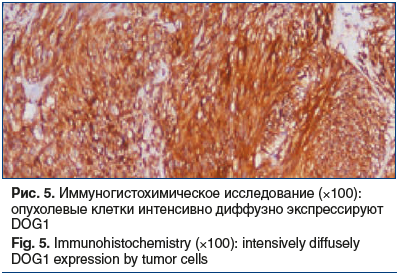
После проведения антимикотической терапии (флуконазол 150 мг/сут 14 дней) 10.07.2019 пациентке выполнена энуклеация экстраорганного образования тела желудка с применением эндоскопической видеоассистенции. Гистологическое исследование удаленного образования: округлое, четко инкапсулированное мезенхимальное, диаметром 2,7 см, представлено веретеновидными клетками без клеточного полиморфизма с обильным коллагеновым матриксом. Картина наиболее характерна для склерозирующего варианта ГИСО. Материал был отправлен на дополнительное исследование в ООО «Национальный центр клинической морфологической диагностики», где 10.07.2019 выполнено патогистологическое исследование удаленного образования. Макроописание: округлый плотный узел диаметром 2,7 см с крупнобугристой поверхностью, на разрезе серый, волокнистый, с множественными точечными кровоизлияниями. Микроописание: четко отграниченное мезенхимальное новообразование диаметром 2,7 см представлено веретеновидными клетками с гладкомышечной дифференцировкой, с минимальным клеточно-ядерным полиморфизмом, участками обильной коллагенизации. Картина наиболее характерна для склерозирующего варианта ГИСО (рис. 4). При ИГХ-исследовании в материале определяются структуры веретеноклеточной опухоли, местами с муаровым паттерном, очаговым фиброзом и гиалинозом. Митотическая активность низкая — менее 5 митозов на 5 мм2 при увеличении 400. Опухолевые клетки интенсивно экспрессируют CD34, DOG1, очагово экспрессируют десмин и не экспрессируют S-100 протеин (рис. 5). Индекс пролиферативной активности Ki-67 в пределах 2–5%. Заключение: гистологическая картина и иммунофенотип опухоли соответствуют гастроинтестинальной стромальной опухоли, GIST, 2-я группа. Пациентка была направлена на оперативное лечение.
Заключение
Гастроинтестинальные стромальные опухоли являются редкими мезенхимальными подслизистыми новообразованиями органов пищеварения, не имеют характерных симптомов, сложны в диагностике, и, как следствие, около 50% образований к моменту постановки диагноза успевают метастазировать. Основная стратегия лечения заключается в радикальном хирургическом лечении локализованных и местно-распространенных форм ГИСО, что позволяет добиться общей 5-летней выживаемости у 54–65% больных [2, 19].
Приведенное клиническое наблюдение представляет типичную клинико-морфологическую картину ГИСО. Заболевание дебютировало у пациентки в возрасте старше 60 лет, протекало под маской органической диспепсии. Только привлечение дорогостоящих высокотехнологичных методов — КТ, ЭУС, ИГХ-исследования позволило верифицировать диагноз ГИСО и направить пациентку на оперативное лечение.
Сведения об авторах:
Скворцова Татьяна Эдуардовна — к.м.н., доцент, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО
СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-9362-9961.
Оганезова Инна Андреевна — д.м.н., профессор, профессор кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0003-0844-4469.
Медведева Ольга Ивановна — к.м.н., доцент, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-9730-7361.
Жорина Ольга Михайловна — к.м.н., заведующая отделением компьютерной томографии Клиники имени
Петра Великого, доцент кафедры лучевой диагностики и лучевой терапии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-9116-737X.
Беляков Илья Александрович — заведующий патологоанатомическим отделением ООО «Национальный центр клинической морфологической диагностики»; 192283, Россия, г. Санкт-Петербург, ул. О. Дундича, д. 8, корп. 2, лит. А, пом. 6Н; ORCID iD 0000-0002-9100-7608.
Воробьев Сергей Леонидович — к.м.н., директор ООО «Национальный центр клинической морфологической диагностики»; 192283, Россия, г. Санкт-Петербург,
ул. О. Дундича, д. 8, корп. 2, лит. А, пом. 6Н; ORCID iD 000-0002-7817-9069.
Контактная информация: Оганезова Инна Андреевна, e-mail: oganezova@rambler.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 14.07.2021.
Поступила после рецензирования 06.08.2021.
Принята в печать 31.08.2021.
About the authors:
Tatyana E. Skvortsova — C. Sc. (Med.), Associate Professor, Associate Professor of the Department of Propaedeutics of Internal Diseases, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-9362-9961.
Inna A. Oganezova — Dr. Sc. (Med.), Professor, Professor of the Department of Propaedeutics of Internal Diseases, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0003-0844-4469.
Olga I. Medvedeva — C. Sc. (Med.), Associate Professor, Associate Professor of the Department of Propaedeutics of Internal Diseases, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-9730-7361.
Olga M. Zhorina — C. Sc. (Med.), Head of the Department of Computed Tomography at the Clinic named after Peter the Great, Associate Professor of the Department of Radiation Diagnostics and Therapy, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-9116-737X.
Ilya A. Belyakov — Head of the Department of Autopsy, National Center for Clinical Morphological Diagnostics LLC; 8 bld. 2A, O. Dundich str., St. Petersburg, 192283, Russian Federation; ORCID iD 0000-0002-9100-7608.
Sergey L. Vorobiev — C. Sc., Director, National Center for Clinical Morphological Diagnostics LLC; 8 bld. 2A, O. Dundich str., St. Petersburg, 192283, Russian Federation; ORCID iD 000-0002-7817-9069.
Contact information: Inna A. Oganezova, e-mail: oganezova@rambler.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 14.07.2021.
Revised 06.08.2021.
Accepted 31.08.2021.
.
Информация с rmj.ru



