Лечение болевого синдрома грудного отдела позвоночника у детей и подростков с применением ботулотоксина под контролем оптической топографии и электрон
Д. А. Красавина*, кандидат медицинских наук
З. И. Федотова*
О. Р. Орлова**, доктор медицинских наук, профессор
* ГБОУ ВПО СПбГМПУ МЗ РФ, Санкт-Петербург
** ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Боль в спине — это яркий пример патологии, истоки которой зачастую лежат в детском возрасте, «вырастая» в серьезную медико-социальную проблему по мере взросления ребенка. Данные о распространенности болей в спине у детей и подростков варьируют в очень широком диапазоне (от 20–30% до 85%). Причины болей в спине можно разделить на:
- первичные, обусловленные аномалиями развития позвоночника, дизонтогенетическими и нейромышечными поражениями опорно-двигательного аппарата;
- вторичные, возникшие в подростковом возрасте как дегенеративно-дистрофические поражения позвоночного столба на фоне постурального дисбаланса, возникшего на основе аномалий развития позвоночника.
Проблема находится на стыке интересов врачей различных специальностей — неврологов, вертебрологов, мануальных терапевтов.
Спинальная боль чаще всего сопровождается наличием какой-либо деформации позвоночника (сколиоза, кифоза, кифосколиоза, спондилеза, спондилолистеза, дегенеративно-дистрофическими заболеваниями позвоночника). Корешковые боли, возникающие вследствие перечисленной выше патологии, чрезвычайно разнообразны и приводят пациента на прием к различным специалистам (неврологам, вертебрологам, мануальным терапевтам, ортопедам). Боль по ходу позвоночника также может быть отражением патологии различных внутренних органов, системных заболеваний (остеопороз), доброкачественных или злокачественных процессов, неспецифических воспалительных заболеваний, инициироваться травмами. Перечисленные типы болей характерны больше для взрослых людей, но такая же боль может возникать и у детей и подростков.
В нашей работе нас интересовала боль, потенцирующим фактором которой является патология опорно-двигательного аппарата. Процент детей, обращающихся с жалобами на боли в шее, в межлопаточной области, в поясничном отделе, растет с каждым годом. Однако зачастую диагностика сводится к минимуму с постановкой тривиального диагноза — остеохондроз, без проведения даже минимальных диагностических мероприятий.
Было обследовано 500 человек (дети и подростки в возрасте от 5 до 18 лет) с болями в грудном отделе позвоночника. Дизайн обследования включал сбор жалоб, антропометрическое обследование, компьютерно-оптическую топографию (КОМОТ) осанки, рентгенологическое обследование, электронейромиографию (ЭНМГ).
Из 500 обследованных пациентов количество больных с острым болевым синдромом составило 79 детей, из которых у 70 человек была травма грудного отдела позвоночника (компрессионный перелом), 9 человек страдали от межреберной невралгии; 421 ребенок — с хроническим болевым синдромом на фоне остеохондропатии (192 чел.) и 229 человек имели дегенеративно-дистрофические заболевания позвоночника (ДДЗП) (рис. 1).

Среди исследуемых пациентов болевой синдром в грудном отделе позвоночника был связан с изменением биомеханики на фоне наличия синдрома «плоской спины», наследственной остеохондропатии, а также компрессионной деформации тел позвонков травматического генеза. Все перечисленные факторы ухудшали амортизацию позвоночника из-за нарушения его физиологических изгибов.
У ряда пациентов это приводило к увеличению тонического компонента в мышцах спины на уровне различных сегментов (чаще — Th3–Th9). При обследовании нас интересовали следующие параметры электронейромиографических показателей:
- наличие спонтанной тонической активности;
- величина мышечной амплитуды (мкВ);
- симметричность параметров амплитуды;
- частота мышечного сокращения.
Зависимость и изменение этих параметров от типа осанки и этиологии болевого синдрома указаны в таблице.
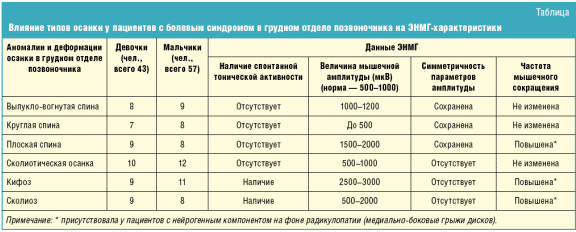
В силу анатомического строения грудного отдела позвоночника, кифоз, выполняющий амортизационную функцию, создает нагрузку, неоднородно распределяющуюся на передний и задний отдел тела позвонка. Условия данной нагрузки способствуют развитию изменения формы тела позвонка и играют важную роль в патогенезе дегенеративных изменений с болевым синдромом. Болевой синдром отчетливо формируется в результате раздражения симпатических стволов и их поперечных анастомозов.
Патологию грудного отдела позвоночника условно можно подразделить на врожденную и приобретенную. Независимо от причины возникновения патогенез этих процессов имеет ряд общих черт:
1) мышечно-тонический синдром на фоне дисплазии определенных групп мышц, а также на фоне постурального дисбаланса;
2) выраженный нейрогенный компонент;
3) деформация врожденного или приобретенного характера (дисплазия грудного отдела, спондилоартроз на фоне ДДЗП);
4) выраженный связочный компонент с развитием вторичных остеофитов (спондилез);
5) нарушение биомеханики грудного отдела позвоночника на фоне постурального дисбаланса (укорочение нижней конечности, синдром косого таза);
6) остеохондропатия;
7) компрессионные переломы позвоночника на фоне системных заболеваний (остеопороз, наследственные нарушения соединительной ткани (ННСТ)).
Все эти процессы могут лежать в основе болевого синдрома грудного отдела позвоночника (рис. 2).

На сегодняшний момент у больных боли в грудном отделе позвоночника, возникшие после травмы, имеют отсроченный характер в связи с возросшим процентом в популяции дизонтогенетических и диспластических проявлений в позвоночнике, что соответствует данным современной литературы [1].
Для детей исследуемой нами группы с болевым синдромом были характерны хронические боли. В двух случаях вызванный болевой синдром грудного отдела позвоночника (спондилит, болезнь Бехтерева) не провоцировал острый болевой синдром.
Поражение грудного отдела позвоночника, вызванное болезнью Шейермана–Мау (остеохондропатией), в ряде случаев провоцировало обострение болевого синдрома при увеличении физических нагрузок.
Нами также выявлено, что для детей ноцециптивный механизм боли не может в достаточной степени объяснить все виды боли. Для детей необходимо рассматривать хроническую боль с компонентом биопсихосоциального явления. Даже при купировании болевого синдрома у юношества с дегенеративно-дистрофическим процессом сохраняется болевой синдром в спине, в связи с перестройкой приема и передачи сигналов в ЦНС, что является неотъемлемой чертой формирования хронических болей. Возникающие синаптические изменения, приводящие к развитию нейрональной гиперактивности, требуют нового подхода к коррекции, что подтвердили работы, связанные с применением ботулинического токсина типа А (БТА) [2].
Нарушение осанки является провокатором для возникновения болевого синдрома, так как нормальная осанка удерживает величины изгибов позвоночного столба в пределах средних значений [3].
Осанка — это расположение туловища и головы при стоянии, сидении и ходьбе. Она определяется физиологическими изгибами позвоночника, положением головы относительно туловища, положением таза, длиной нижних конечностей и положением стоп. В современной терминологии и литературе взаимотождественным является термин «постура». Широко развитая наука, постурология, мало представлена в российской литературе.
С учетом выраженности физиологических изгибов в зависимости от способа фиксирования суставов и положения сегментов положения нижних конечностей, в норме предлагается различать четыре типа осанки [3]:
- симметричный активный сгибательный тип (характерен для детей младшего возраста);
- симметричный активно-пассивный тип с вертикальным расположением туловища и нижних конечностей (мышцы в данном случае находятся в состоянии постоянного тонического напряжения);
- симметричный разгибательный, преимущественно пассивный тип (напряжение связочного аппарата, голеностопных суставов);
- асимметричный тип (опорная нога располагается в положение разгибания).
Отклонения от нормальной осанки обозначают как нарушение осанки, если по результатам углубленного обследования не выявлены заболевания позвоночного столба или других отделов опорно-двигательного аппарата. Следовательно, нарушение осанки занимает промежуточное положение между нормой и патологией. Ранее считалось, что это функциональное нарушение. Анализируя классификацию зависимости осанки и способов фиксирования суставов (следовательно, напряжение связочного аппарата), это может считаться неблагоприятным фоном — этапом наличия биологических дефектов или неблагоприятных условий, называемых «предболезнь». Следовательно, фиксированные и функциональные нарушения осанки являются провокаторами болевого синдрома.

Фиксированные нарушения осанки представлены на рентгенограммах (рис. 3а, 3б). Пациентка Л-ва, 7 лет, с жалобами на боли в спине. Девочка профессионально занимается гимнастикой. На рентгенограммах отсутствуют все физиологические изгибы позвоночника к возрасту обязательного их формирования. Данное постуральное нарушение (возникшее из-за слабого мышечного корсета), нарушив функциональные возможности, привело в фиксированному типу нарушения осанки. У больных с плоской спиной снижение рессорной функции позвоночника способствует постоянным микротравмам позвоночно-двигательных сегментов (как костного, так и связочного аппарата) во время движения (ходьбы, бега, прыжков), вызывающих быстрое утомление, болевой синдром. При нарушениях осанки часть мышц, как правило, ослаблена, а другая часть находится в гипертонусе. Таким образом, работоспособность этих групп мышц снижена, и появляются локальные места мышечного гипертонуса, провоцирующие возникновение структуральной патологии.
Диспансеризация детей России 2002 г. показала, что нарушение осанки является одним из самых распространенных изменений опорно-двигательной системы. Нарушения осанки могут развиться в силу описанных факторов.
Нами проводился анализ болевого синдрома в грудном отделе позвоночника в зависимости от нарушения осанки в сагиттальной плоскости.
Ранее мы отметили, что длительно сохраняющаяся антифизиологическая поза приводит к позотоническому напряжению (чаще характерному для детей школьного возраста). Кроме того, данное состояние возникает и у детей, занимающихся спортом. Необходимо отметить, что при функциональных вертеброгенных нарушениях формируется «порочный круг»: боль вызывает мышечный спазм, который, в свою очередь, провоцирует боль. У ряда наших пациентов отмечался миофасциальный болевой синдром, имеющий невертеброгенный генез боли. При осмотре у детей морфологические и функциональные нарушения в позвоночнике отсутствовали, и первичное поражение лежало в самой мышце. Дети отмечали выраженный спазм и болезненность пораженной мышцы с участками уплотнения в ней, определяющиеся при пальпации.
Из группы пациентов с болевым синдромом в грудном отделе позвоночника количество пациентов с болезнью Шейермана–Мау составило 230 человек. При детальном сборе анамнеза дети, которые якобы не жаловались на боли (52 человека), имели прецеденты болевого синдрома, не ярко выраженные и эпизодические. Кроме того, за период с 1999 по 2011 гг. нами была отмечена тенденция к увеличению распространенности болезни Шейермана–Мау в популяции, что отчасти может быть связано с совершенствованием методов диагностики, а также внедрения в нашу работу скрининговых методов обследования с применением КОМОТ. Структурные деформации позвоночника выявляются в 15 раз чаще, чем при ежегодных профилактических осмотрах школьников [4]. В работе мы еще раз подтвердили результаты материалов ряда авторов о аутосомно-доминантном типе наследования болезни Шейермана–Мау [5–7]. Рассматривая группу пациентов с болевым синдромом в грудном отделе, мы подтвердили, что данную патологию надо связывать с многофакторным поражением соединительной ткани (прежде всего — хрящевых структур позвоночника). Но настороженность клиницистов, правильно проведенная диагностика по четкому алгоритму и рациональная и настойчивая, консервативная терапия в большинстве случаев позволяют предотвратить развитие избыточного структурально кифоза и ДДЗП, осложненного множественными межпозвоночными грыжами [2, 8].
На наш взгляд и в связи с исследуемой группой больных, целесообразней считать данную деформацию как характер адаптивной реакции на прогрессирование болевого синдрома и мышечно-тонический компонент, стимулирующий усугубление деформации.
В качестве примера коррекции болевого синдрома у пациентки с вторичными болями вертеброгенного характера на фоне тонического компонента представлена больная О-ва, 17 лет (рис. 6 а-е). Выявленная патология позвоночника в грудном отделе подтверждена методом КОМОТ, рентгенологическим исследованием и обследованием ЭНМГ. Тактика лечения включала БТА-терапию с последующим коррекционным комплексом упражнений лечебной физкультуры.

Качественная диагностика является залогом успешного выявления скелетно-мышечной патологии, которая может стать основой для будущего болевого синдрома. Современный алгоритм диагностики должен отвечать неинвазивным методам. Примененные нами обследования статико-динамического положения позвоночника и нейрофизиологических параметров мышечного корсета с помощью аппаратов КОМОТ и ЭНМГ подтвердили высокую степень выявляемости патологии грудного отдела позвоночника.
Мышечно-тонический компонент, наслаивающийся на различную патологию позвоночника и являющийся основной причиной боли, эффективно устраняется методами физиотерапии, массажа и введением ботулинического токсина типа А в триггерные зоны, локально спазмированные группы мышц.
Литература
- Каннер Р. М. Секреты лечения боли. Пер. с англ. М.: Изд-во «Бином», 2006. 400 с.
- Andres D. E. J., Cerda-Olmedo G., Valla J. C. et al. Use of botulinum toxin in the treatment of chronic myofascial pain // The Clinical journal of pain. 2003. Vol. 19. № 4. P. 269–275.
- Кашуба В. А. Биомеханика осанки. Изд. «Олимпийская литература», 2003. С. 104.
- Swischuk L. E. Emergency imaging of the acutely ill or injured child. In: The spine and the spinal cord. 4 th ed. Philadelphia. Pa: Lippincott Williams and Wilkins. 2000; 532–587.
- Аксенович Т. И. и соавт. Механизмы наследования болезни Шейерманна, 2005. N 4. С. 77–88;
- Колесниченко В. А., Мезенцев А. А. Ортопедия, травматология и протезирование. Харьков, 1998. N.3. С. 98–100;
- Иваничев Г. А. Мануальная терапия. Казань, 1997. 447 с.
- Trevelyan F. C., Legg S. J. Backpain in school children — where to from here? // Appl Ergon. 2006; 37: 45–54.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






