Введение
Эпилепсия серьезно влияет на прямые и непрямые затраты в сфере здравоохранения [1], а также на качество жизни пациентов [2]. Клинические рекомендации по лечению эпилепсии предполагают назначение противоэпилептических препаратов (ПЭП) с целью предотвращения возникновения приступов [3, 4]. Правильный выбор ПЭП может обеспечить раннее облегчение симптомов, уменьшение или устранение побочных эффектов, улучшить прогноз и снизить финансовое бремя для пациентов. При впервые выявленной эпилепсии лечение рекомендуется начинать с монотерапии ПЭП, при неудовлетворительных результатах проводится замена на монотерапию другим ПЭП [4]. Назначение нескольких ПЭП обычно предполагается в случаях, когда несколько попыток монотерапии ПЭП не позволили достичь контроля над приступами. При применении современных ПЭП долгосрочного контроля удается достичь у 70% пациентов с эпилепсией [5]. При установлении точного диагноза эпилепсии пациентам требуется долгосрочная терапия ПЭП.
Вальпроевая кислота (ВК) (вальпроат, препараты ВК), обладающая широким спектром противоэпилептической активности, применяется для лечения практически всех типов эпилептических приступов и синдромов, хотя максимальную ценность препарат представляет для лечения идиопатической генерализованной эпилепсии (ИГЭ) [6, 7]. Хотя ВК обладает сходной или чуть меньшей эффективностью, чем карбамазепин, в отношении фокальных приступов [8], проблемы с переносимостью препарата в некоторых случаях требуют выбора другого ПЭП для лечения фокальной эпилепсии (ФЭ), особенно у женщин [9, 10]. ВК рассматривают как препарат первой линии для лечения генерализованных эпилептических синдромов [11, 12], за исключением случаев, когда имеются специфические противопоказания. В ходе крупного рандомизированного клинического исследования, включавшего детей и взрослых с впервые выявленной генерализованной или неклассифицированной эпилепсией, показатель удержания на лечении (комбинированный показатель эффективности и переносимости) был значительно лучше при применении ВК, чем при использовании ламотриджина или топирамата [13].
В России препараты ВК применяются уже более 25 лет [7], однако исследований по оценке их эффективности и переносимости при впервые выявленной эпилепсии у взрослых проведено недостаточно. Кроме того, отсутствуют работы по оценке эффективности ВК с использованием количественной оценки активности головного мозга на основании данных электроэнцефалографии (ЭЭГ).
Цель исследования: оценить эффективность и переносимость монотерапии препаратами ВК у пациентов с впервые выявленной эпилепсией.
Материал и методы
В неконтролируемое клиническое исследование было включено 63 пациента: с ФЭ — 24 (38,1%), с ИГЭ — 39 (61,9%). Среди обследованных было 37 (58,7%) мужчин и 26 (41,3%) женщин в возрасте от 18 до 78 лет (средний возраст 29,37±12,17 года).
Критерии включения: 1) впервые выявленная ФЭ/ИГЭ; 2) подписанное информированное согласие на участие в исследовании, в котором, в частности, были описаны все риски, связанные с приемом ВК.
Критерии невключения: 1) неподтвержденный диагноз эпилепсии и неэпилептические приступы; 2) медикаментозная/спонтанная ремиссия (отсутствие эпилептических приступов); 3) идиопатические (генетические) возраст-зависимые формы ФЭ; 4) тяжелая соматическая патология, декомпенсация хронических заболеваний; 5) онкологические, в т. ч. нейроонкологические, заболевания; 6) беременность и лактация; 7) отказ от участия в исследовании.
Продолжительность исследования составила 12 мес., включая 5 контрольных визитов (табл. 1). Суточная доза ВК составляла 18,6±3,5 мг/кг (от 11 до 28 мг/кг). Титрование проводилось по стандартной схеме (250 мг/нед.). Если возникала необходимость в смене терапии вследствие недостаточной эффективности или развивались непереносимые нежелательные явления (НЯ), то назначался дополнительный визит.
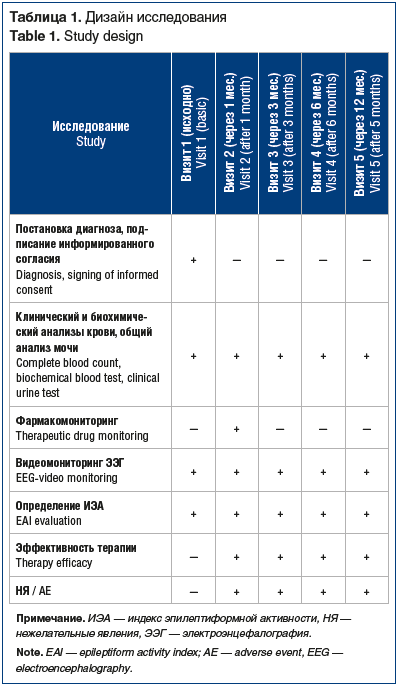
Диагноз устанавливали в соответствии с рекомендациями Международной противоэпилептической лиги (ILAE, 2014, 2017), принимая во внимание тип приступов, критерии эпилептического синдрома, современное определение заболевания [14, 15].
Всем пациентам проводили клинический и биохимический анализы крови, общий анализ мочи. Оценку уровня ВК в крови до приема препарата и через 2–2,5 ч после приема утренней дозы проводили при титровании через 1 мес. терапии, или при смене схемы терапии в связи с ее неэффективностью, или при возникновении НЯ (референсные значения 50–100 мкг/мл).
При каждом посещении проводили видеомониторинг ЭЭГ (4–24 ч), по результатам которого оценивали:
доминирующий ритм, показатели альфа-, бета-, тета- и дельта-активности, регионарное замедление в тета- и дельта-диапазоне (в период бодрствования);
наличие/отсутствие фаз и стадий сна, физиологических паттернов сна (во время сна);
фокальную, диффузную и генерализованную эпилептиформную активность с расчетом усредненного количественного ИЭА, наличие эпилептических приступов (фокальных и генерализованных) и их субклинических паттернов (в бодрствовании до сна, во время сна, после сна и во время фрагментарных пробуждений).
НЯ оценивали по шкале «Оценка побочных эффектов при лечении ПЭП» (SIDAED) [16]. При возникновении переносимых НЯ (<20 баллов) корректировали дозу ВК либо дополнительно назначали лекарственные препараты (симптоматическую терапию). При развитии непереносимых НЯ (≥20 баллов) проводили замену препарата.
Эффективность терапии ВК оценивали по следующим критериям: медикаментозная ремиссия (отсутствие приступов); выраженный ответ (респондеры; снижение частоты приступов более чем на 50%); недостаточный эффект (снижение частоты приступов менее чем на 50%); удержание на терапии (комплексный показатель эффективности/переносимости); фармакодинамическая аггравация (увеличение частоты приступов относительно исходной и/или появление нового типа приступов).
Статистическую обработку результатов проводили с использованием программного обеспечения SPSS 23.0, Statistica 8.0 для Windows (StatSoft Inc., США). Нормальность распределения показателей оценивали по критерию Колмогорова — Смирнова. Данные представляли как M±SD (M — средняя, SD — стандартное отклонение) при нормальном распределении и как медиану (25-й и 75-й процентили) — при ненормальном. Значимость различий количественных учетных признаков между группами оценивали с помощью критерия Манна — Уитни, качественных учетных признаков — с помощью критерия χ2. Различия считали статистически значимыми при p<0,05. Корреляционный анализ проводили по методу Пирсона. При значении коэффициента корреляции r≤0,19 корреляцию расценивали как очень слабую, 0,2–0,49 — как слабую, 0,5–0,69 — среднюю, 0,7–0,89 — сильную, более 0,9 — очень сильную.
Результаты исследования
У пациентов с ИГЭ основным эпилептическим синдромом была ювенильная абсансная эпилепсия (n=17; 43,6%), а также эпилепсия с изолированными генерализованными судорожными приступами пробуждения (n=14; 35,9%). Реже отмечались ювенильная миоклоническая эпилепсия (n=7; 17,9%) и фотосенситивная эпилепсия (n=1; 2,6%). У большинства пациентов с ФЭ была выявлена лобная эпилепсия (n=13; 54,2%), реже — височная (n=9; 37,5%) и теменная (n=2; 8,3%).
У трети пациентов (n=19; 30,2%) приступы были единичные (1 раз в полгода) и у второй трети — частые (≤3 в месяц; n=20; 31,7%). Редкие (1 раз в 2–3 мес.) приступы отмечались в 15 (23,8%) и очень частые (>3 в месяц) — в 9 (14,3%) наблюдениях (табл. 2).
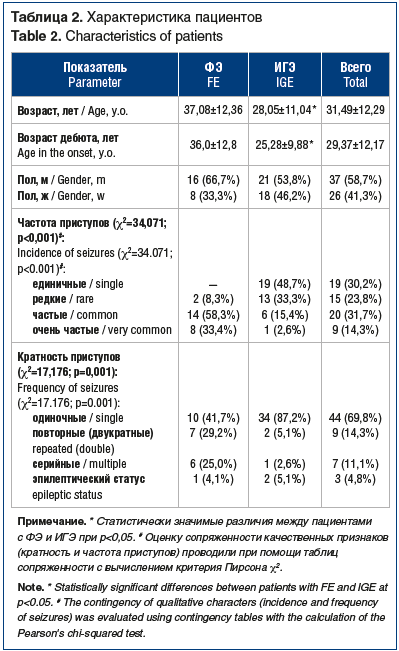
При оценке кратности приступов было выявлено, что у большинства пациентов приступы были одиночные (n=44; 69,8%), реже встречались повторяющиеся (двукратные) (n=9; 14,3%), серийные (n=7; 11,1%) и эпилептический статус (n=3; 4,8%) (см. табл. 2).
Индекс эпилептиформной активности. До начала лечения ИЭА был высоким у пациентов как с ФЭ, так и с ИГЭ. Суммарный ИЭА у пациентов с ИГЭ до начала лечения ВК был в 2,7 раза выше, чем у пациентов с ФЭ. Уже через 1 мес. после начала лечения он уменьшился в 9,2 и 5,3 раза при ИГЭ и ФЭ соответственно (p<0,01) и продолжал снижаться в течение всего периода наблюдения. Такая же тенденция наблюдалась и при оценке ИЭА до, во время и после сна (табл. 3).
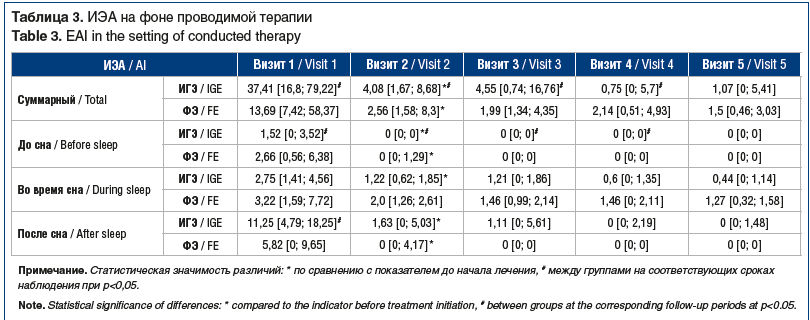
При проведении корреляционного анализа выявлена взаимосвязь между величиной ИЭА до сна и возрастом пациентов (r=0,347; p=0,005), а также кратностью приступов (r=0,252; p=0,046). ИЭА во время сна также коррелировал с кратностью приступов (r=0,310; p=0,013). ИЭА во время фрагментарных пробуждений и после сна был взаимосвязан с эпилептическим синдромом (r=-0,356; p=0,004 и r=-0,357; p=0,04).
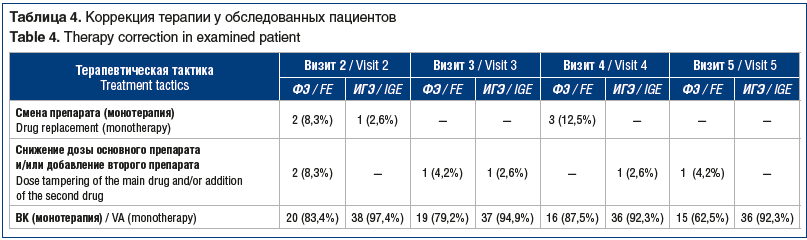
Изменения схемы терапии. На другой препарат было переведено 6 (9,5%) пациентов, дуотерапия была назначена 6 (9,5%) больным. В итоге на монотерапии ВК остался 51 (81%) пациент: 15 (62,5%) с ФЭ и 36 (92,3%) с ИГЭ (табл. 4).
Эффективность терапии. Как видно из представленных в таблице 5 данных, в целом ремиссия на фоне монотерапии ВК была достигнута в 61,6% наблюдений. Снижения частоты приступов на 50% и более удалось достичь у 19% пациентов.
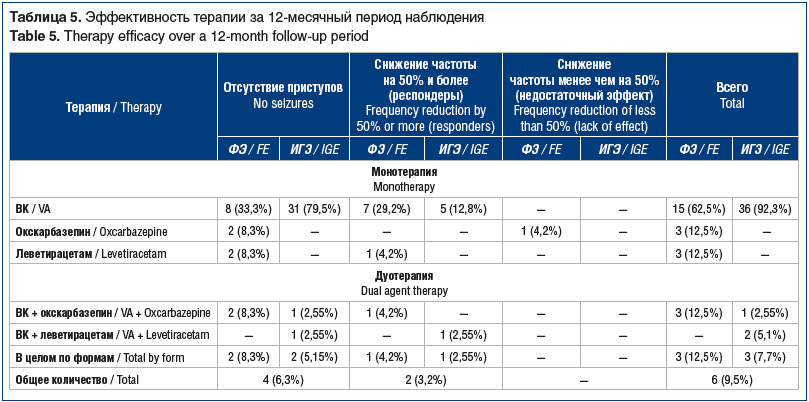
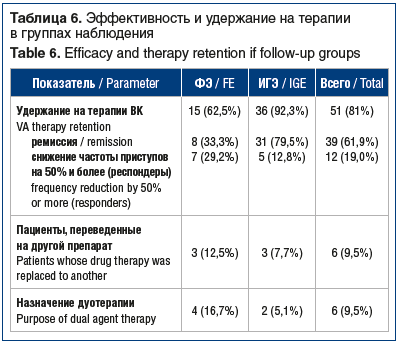
Показатель удержания на терапии является производным от эффективности и переносимости ВК. Он включает пациентов в ремиссии и респондеров за минусом пациентов, у которых были выполнены отмена ВК и/или перевод на дуотерапию (табл. 6). Удержание на монотерапии констатировали у 51 (81%) пациента, из них 15 (62,5%) с ФЭ и 36 (92,3%) с ИГЭ.
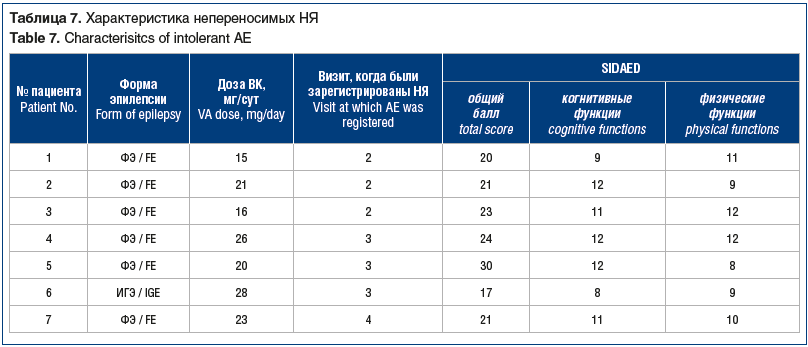
Переносимость терапии. У 6 (9,5%) пациентов на визитах 2 и 3 на фоне лечения констатировали непереносимые НЯ, потребовавшие замены терапии (табл. 7). У 1 пациента с ФЭ непереносимые НЯ наблюдались на двух визитах (в обоих случаях проводилась замена препарата). Чаще НЯ развивались при ФЭ (n=5; 20,8%), реже — при ИГЭ (n=1; 2,6%). Среди НЯ были нарушения когнитивных функций, депрессии и поведенческие нарушения, реже возникали цефалгический синдром, диспепсические явления и аллергические реакции.
Фармакомониторинг ВК. При проведении фармакомониторинга выявлено, что у пациентов с ФЭ концентрация препарата до начала его приема и через 2 ч после приема составляла 73 (62,7; 79,0) мкг/мл и 80 (71,45; 87,5) мкг/мл соответственно, а у пациентов с ИГЭ — 69 (65,0; 78,0) мкг/мл и 79 (72,5; 86,5) мкг/мл соответственно.
Обсуждение
Будучи представленными на рынке ПЭП с 1960-х гг., препараты ВК более чем за 60 лет экспериментальных исследований и клинического применения зарекомендовали себя как одни из наиболее эффективных ПЭП [17]. ВК действует не только на уровне синаптической щели, но и за счет прямой и непрямой стимуляции конформационной адаптации нейронов. В частности, эффект ВК реализуется за счет модулирующего действия на глутаматергическую и ГАМК-ергическую нейротрансмиссию, в сочетании с эпигенетическими механизмами, реализующимися путем прямого модулирующего действия на деацитилазы гистонов. Благодаря обширному терапевтическому потенциалу ВК ее препараты считаются препаратами выбора не только при эпилепсии с генерализованным началом, но также и при других типах эпилептических приступов, от фокальных до синдрома Леннокса — Гасто [17].
Наблюдавшаяся в ходе данного исследования частота достижения ремиссии без приступов (81%) была выше, чем в исследованиях других авторов [18–21], где данный показатель варьировал от 47 до 70%, и ниже, чем в исследовании, проведенном B.J. Steinhoff et al. [22], — 83,3%. В исследовании К.Ю. Мухина [23] эффективность ВК составила 80%: 71% при симптоматической ФЭ, 86% при идиопатической и 90% при ИГЭ.
В настоящем исследовании удержание на монотерапии отмечалось у 81% пациентов, из них 62,5% с ФЭ и 92,3% с ИГЭ, что сопровождалось снижением суммарного ИЭА в 9,1 раза при ФЭ и в 35 раз при ИГЭ (с 30,35 [12,16; 65,09] до 1,33 [0; 4,83] на визитах 1 и 5 среди всех пациентов, включенных в исследование), что подтверждает эффективность применения вальпроатов.
Связанные с лечением НЯ сильно коррелируют с качеством жизни пациентов. Успех или недостаточная эффективность лечения преимущественно определяется профилем НЯ препарата, а наиболее важным показателем исхода является прекращение приема препарата вследствие непереносимых или фатальных побочных эффектов [24]. В настоящем исследовании непереносимые НЯ, потребовавшие смены препарата, развились у 6 (9,5%) пациентов. Полученные данные согласуются с результатами исследования П.Н. Власова и соавт. [25], в котором частота НЯ при приеме ВК составила 16%.
На начальном этапе ПЭП следует титровать до исходных целевых доз, что приводит к неустойчивой эффективной концентрации препарата в крови в период титрования [26]. ВК характеризуется непредсказуемой связью между дозой и концентрацией препарата в крови. Есть пациенты, у которых контроль над приступами достигается при более низких концентрациях. Таким образом, существует необходимость индивидуального подбора терапии с контролем концентрации препарата в крови [27]. При проведении фармакомониторинга (на визите 2) у пациентов как с ФЭ, так и с ИГЭ концентрация препарата через 2 ч после приема утренней дозы увеличивалась в 1,1 раза и не превышала референсных значений. Также не было выявлено корреляции между возникновением НЯ и дозой препарата. Развитие НЯ, вероятнее всего, связано с наличием индивидуальных особенностей фармакокинетики и фармакодинамики.
К ограничениям настоящего исследования можно отнести небольшой объем выборки, который не позволил провести анализ результатов в зависимости от дозировки ВК, а также отсутствие контрольной группы.
Заключение
Таким образом, количественная оценка ЭЭГ у пациентов с впервые выявленной эпилепсией выявила высокий ИЭА до, во время, после сна, а также суммарный ИЭА. Препараты ВК — это ПЭП с наиболее широким спектром активности и хорошим терапевтическим эффектом в виде ремиссии по приступам (удержание на монотерапии составило 81%) для инициального лечения ФЭ и ИГЭ в монотерапии, на фоне приема которых наблюдаются значимое снижение ИЭА (p<0,001) и незначительная частота НЯ (9,8%), преимущественно со стороны нервной системы и желудочно-кишечного тракта. С целью оптимизации подбора ПЭП рекомендовано проведение фармакомониторинга и оценки ИЭА.
Сведения об авторах:
Кожокару Анжела Борисовна — к.м.н., заведующая лабораторией клинической нейрофизиологии,ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России, 123182, Россия, г. Москва, ул. Живописная, д. 46; доцент кафедры неврологии, ФГБУ ДПО «ЦГМА». 121359, Россия, г. Москва, ул. Маршала Тимошенко, д. 19, стр. 1А; ORCID iD 0000-0001-9306-1686.
Орлова Александра Сергеевна— к.м.н., доцент кафедры патологии человека Института клинической медицины им. Н.В. Склифосовского, ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), 119991, Россия, г. Москва, ул. Трубецкая, д. 8,
стр. 2; ORCID iD 0000-0001-9725-7491.
Шмырев Владимир Иванович — д.м.н., профессор, заведующий кафедрой неврологии, ФГБУ ДПО «ЦГМА», 121359, Россия, г. Москва, ул. Маршала Тимошенко, д. 19, стр. 1А; ORCID iD 0000-0002-6802-2789.
Акарачкова Елена Сергеевна — д.м.н., профессор, президент, АНОМеждународное общество «Стресс под контролем», 115573, Россия, г. Москва, ул. Мусы Джалиля, д. 40; ORCID iD 0000-0002-7629-3773.
Лебедева Джинна Ивановна — доцент кафедры медицинской профилактики и реабилитации института непрерывного профессионального развития, ФГБОУ ВО Тюменский ГМУ Минздрава России, 625023, Россия, г. Тюмень, ул. Одесская, д. 54; ORCID iD 0000-0003-2478-9619.
Контактная информация: Кожокару Анжела Борисовна, e-mail: angela.neural@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 10.07.2020, поступила после рецензирования 24.07.2020, принята в печать 07.08.2020.
About the authors:
Angela B. Kozhokaru — Can. of Sci. (Med.), Head of the Laboratory of Clinical Neurophysiology,Burnasyan Federal Medical Biophysical Center of Federal Medical Biological
Agency: 46, Zhivopisnaya str., Moscow 123182, Russian Federation; Associate Professor of the Department of Neuro-logy, Central State Medical Academy of the Administrative Department of the President of the Russian Federation:
1A build., 19, Marshala Timoshenko str., Moscow, 121359, Russian Federation; ORCID iD 0000-0001-9306-1686.
Alexandra S. Orlova — Can. of Sci. (Med.), Associate Professor of the Department of Human Pathology at the N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University): 2 build. 8, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0001-9725-7491.
Vladimir I. Shmyrev — Dr. of Sci. (Med.), Professor, Head of the Department of Neurology, Central State Medical Academy of the Administrative Department of the President of the Russian Federation: 1A build., 19, Marshala Timoshenko str., Moscow, 121359, Russian Federation; ORCID iD 0000-0002-6802-2789.
Elena S. Akarachkova — Dr. of Sci. (Med.), Professor, Chairman, International Society “Stress Under Control”: 40, Musy Jalilya str., Moscow, 115573, Russian Federation; ORCID iD 0000-0002-7629-3773.
Jinna I. Lebedeva — Associate Professor of the Department of Preventive & Rehabilitation Medicine at the Institute of Continuing Professional Education, Tumen State Medical University: 54, Odesskaya str., Tumen, 625023, Russian Federation; ORCID iD 0000-0003-2478-9619.
Contact information: Angela B. Kozhokaru, e-mail: angela.neural@gmail.com. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 10.07.2020, revised 24.07.2020, accepted 07.08.2020.
.
Информация с rmj.ru






