Связь клинических проявлений НПВП-гастропатии у больных ревматоидным артритом с моторными нарушнениями верхних отделов ЖКТ
Д.И. Абдулганиева1, Н.Э. Белянская1, Е.Л. Насонов2,
1Казанский государственный медицинский университет, Казань;
2Учреждение Российской академии медицинских наук Научно-исследовательский институт ревматологии РАМН, Москва
Цель – оценка моторных нарушений верхних отделов желудочно-кишечного тракта (ЖКТ) у больных ревматоидным артритом (РА) при приеме диклофенака натрия по данным 24-часовой рН-метрии и их взаимосвязи с клиническими проявлениями гастропатии, обусловленной приемом нестероидных противовоспалительных препаратов (НПВП-гастропатии). Материал и методы. В исследуемую группу было включено 39 больных с диагнозом РА, 14 человек составили группу контроля. Всем включенным в исследование проводилось клиническое обследование, эндоскопическое исследование пищевода, желудка и двенадцатиперстной кишки, суточное мониторирование рН желудка и пищевода («Гастроскан-24», НПП «Исток-Система», г. Фрязино).
Результаты и обсуждение. При сравнении 24-часовой внутрипищеводной и интрагастральной кислотности у больных РА и здоровых были выявлены различия показателей кислотности в ночное время. В группе больных РА было отмечено понижение кислотности в ночное время по сравнению с группой контроля (р<0,05). Полученные значения рН могут косвенно свидетельствовать о наличии дуоденогастроэзофагеального рефлюкса у пациентов с РА. Анализ 24-часовых рН-грамм выявил, что сочетание гастроэзофагеального и дуоденогастрального рефлюксов встречалось у 37% больных. Именно в этой группе у всех пациентов был отмечен клинический «перекрест» болевого и диспепсического синдромов (р<0,05).
Заключение. Выявленные нами нарушения моторики верхних отделов ЖКТ у больных РА, принимающих НПВП, могут играть значимую роль в развитии клинических проявлений НПВП-гастропатии, и, возможно, определенной группе больных необходимо проводить медикаментозную коррекцию симптомов, связанных с нарушением моторики.
Ключевые слова: ревматоидный артрит, нестероидные пропивовоспалительные препараты, 24-часовая рН-метрия, нарушения моторики желудочно-кишечного тракта
Нестероидные противовоспалительные препараты (НПВП) являются важным компонентом комплексной терапии ревматоидного артрита (РА). Именно в терапии ревматических заболеваний, в частности РА, НПВП используются длительно и в высоких дозах [1]. Постоянно принимают НПВП не менее 68,5% больных РА [2, 3]. Наиболее частой патологией, ассоциированной с приемом НПВП, является поражение гастродуоденальной зоны – НПВП-гастропатия. Клинические проявления НПВП-гастропатии развиваются у 5–50% пациентов, принимающих НПВП [4–7].
Согласно общепризнанной концепции, центральным звеном патогенеза НПВП-гастропатий является блокада фермента циклооксигеназы 1, определяющей синтез «цитопротективных» простагландинов (ПГ) [1, 8]. Уменьшение концентрации ПГ в слизистой оболочке приводит к существенному снижению ее защитного потенциала и способствует ее повреждению естественными факторами агрессии – кислотой и пепсином, содержащимися в желудочном соке [8]. Дополнительными факторами, связанными с действием НПВП, считаются коагуляционные и микроциркуляторные нарушения в слизистой оболочке, блокада NO-синтетазы, разобщение окислительного фосфорилирования в митохондриях эпителиоцитов, ускорение клеточного апоптоза, нарушение процессов репарации и т. д. [4, 8]. Все это приводит к значительному снижению устойчивости слизистой оболочки, потенцирует ее повреждение под влиянием кислотно-пептического фактора и вызывает клинические проявления НПВП-гастропатии.
Определенное значение в возникновении клинических проявлений синдрома диспепсии может иметь действие НПВП на моторику желудочно-кишечного тракта (ЖКТ) [9]. При использовании НПВП наблюдается двигательная дисфункция гастродуоденального комплекса [7, 10], что может вызывать застой содержимого желудка, тем самым провоцируя рефлюкс [8]. Одной из причин нарушения моторики верхних отделов ЖКТ при приеме НПВП является компенсаторное повышение концентрации эндогенных простагландинов Е2 и простациклина вследствие раздражающего действия НПВП на слизистую оболочку. В данном случае имеется сходство с побочным действием синтетических простагландинов (мизопростол) [11]. При РА могут наблюдаться нарушения моторики пищевода, обусловленные, вероятно, проявлением системности ревматоидного воспаления, в основе которого лежат иммунные нарушения, способствующие развитию эндотелиальной дисфункции и снижению секреции оксида азота.
Целью нашего исследования являлась оценка моторных нарушений гастродуоденальной зоны у больных РА на фоне приема диклофенака натрия по данным 24-часовой рН-метрии, а также изучение их взаимосвязи с клиническими проявлениями НПВП-гастропатии.
Материал и методы
В основную группу были включены 39 больных РА (диагноз соответствовал критериям ACR 1987 г.), средний возраст составил 41,7±2,1 года, средняя продолжительность заболевания – 8,1±1,1 года. Все больные не менее 1 мес принимали диклофенак натрия (100–150 мг в сутки). Всем проводилось полное клиническое обследование, эндоскопическое исследование пищевода, желудка и двенадцатиперстной кишки, суточное мониторирование рН желудка и пищевода при помощи системы для длительного непрерывного мониторирования «Гастроскан-24», (НПО «Исток-Система», г. Фрязино). Эндоскопические изменения, характерные для НПВП-гастропатии, оценивались по классификации F. Lanza [12] и выявлены у всех 39 пациентов. Изменения слизистой оболочки пищевода в виде гиперемии нижней трети наблюдались у 4 больных РА.
В контрольную группу были включены 14 практически здоровых добровольцев, у которых в анамнезе отсутствовали ревматические заболевания и заболевания ЖКТ, при проведении фиброгастродуоденоскопии слизистая оболочка верхних отделов пищеварительного тракта оценивалась как практически неизмененная.
Каждый пациент подписывал бланк информированного согласия на участие в исследовании. Больные и здоровые были идентичны по возрасту.
Полученные данные обрабатывались на персональном компьютере с использованием программы Statistica 6.0A. Нулевую гипотезу об отсутствии существенного различия между сравниваемыми группами отвергали при уровне значимости 0,05.
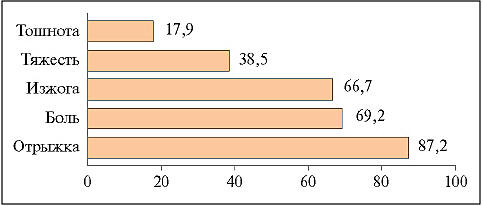
Рис. 1. Структура жалоб со стороны верхних отделов ЖКТ у больных РА с НПВП-гастропатией
Результаты и обсуждение
В результате проведенного клинического обследования больных РА с НПВП-гастропатией выявлена высокая частота болевого и диспепсического синдромов (рис. 1).
Проведенный анализ взаимосвязи клинико-лабораторных особенностей РА и диспепсического и абдоминального болевого синдромов показал, что наличие диспепсических жалоб и боли в эпигастральной области не зависело от пола, возраста больных, а также длительности, активности, рентгенологической стадии заболевания и наличия ревматоидного фактора в сыворотке крови (р>0,05).
Средние показатели 24-часовой интрагастральной кислотности у больных РА представлены в табл. 1.
При сравнении 24-часовой интрагастральной кислотности у больных РА и здоровых нами были выявлены различия показателей кислотности в ночное время (см. табл. 1). В контрольной группе происходило повышение кислотообразования в ночные часы по сравнению с дневными – 2,41±0,27 и 3,11±0,22 соответственно (р<0,05). В группе больных РА были отмечены противоположные изменения – понижение интрагастральной кислотности в ночное время до 3,68±0,30 (р<0,05). Следует отметить, что положение тела не влияло на показатели кислотности как у больных РА, так и в группе контроля (см. табл. 1). Выявленные различия могут быть связаны с возникновением в ночные часы у пациентов с РА дуоденогастрального рефлюкса (ДГР).
Таблица 1. Средние показатели 24-часовой интрагастральной кислотности у больных РА (М±δ)
| Значение рН | Больные РА (n=34) | Контроль (n=14) |
| Среднее в течение суток | 3,20±0,22 | 2,68±0,23 |
| В дневное время | 2,91±0,22 | 3,11±0,22 |
| В ночное время | 3,68±0,30* | 2,41±0,27* |
| В горизонтальном положении тела | 3,35±0,26 | 2,60±0,28 |
| В вертикальном положении тела | 3,04±0,20 | 2,89±0,21 |
| Минимальное | 0,70±0,12 | 0,48±0,07 |
| Максимальное | 8,56±0,16** | 7,44±0,19** |
Примечание. *– р<0,05 по сравнению с дневными показателями, **– р<0,05 по сравнению с контролем.
Известно, что рН-метрия является косвенным методом оценки моторики верхних отделов ЖКТ, а увеличение уровня рН до 7,0 и выше в теле желудка свидетельствует о наличии и выраженности ДГР [13, 14].
При анализе 24-часовых рН-грамм в группе контроля ДГР выявлялся в 35,7% случаев (табл. 2). Однако он регистрировался только в ранние утренние часы, его средняя суточная длительность составила 53,4±6,44 мин с последующим возвращением рН к исходному уровню перед завтраком. Полученные нами данные совпадают с феноменом повышения уровня рН вследствие возникновения ДГР в утренние часы, который был описан у здоровых и ранее [15].
У больных РА ДГР выявлялся в 67,7% случаев (см. табл. 2). В отличие от группы контроля, он чаще возникал в вечерние и ночные часы и его средняя продолжительность составляла 268,2±21,18 мин (р<0,05). Частота и длительность ДГР при РА были значительно выше, чем в контроле (р<0,05).
На рис. 2 представлена 24-часовая рН-грамма тела желудка больной Т. с болевым и диспепсическим синдромами, на которой стрелками показан ДГР, возникающий в ночное время. Общая продолжительность эпизодов ДГР составила ≥4 ч, средний уровень рН в дневное время – 1,8, в ночное – 6,1.
При изучении показателей 24-часовой внутрипищеводной кислотности у больных РА и здоровых нами также были выявлены различия (табл. 3).
Максимальные значения внутрипищеводной кислотности у пациентов с РА и здоровых в течение суток составили 8,76±0,14 и 7,96±0,20 соответственно (р<0,05). При РА наблюдалось понижение рН в ночное время 6,19±0,13 по сравнению с 5,90±0,16 в группе контроля (р<0,05). Это может косвенно свидетельствовать о наличии ДГР у пациентов с РА, вероятно, вследствие ослабления тонуса нижнего пищеводного сфинктера и нарушения антродуоденальной моторики.
Показатели DeMeester, характеризующие наличие и выраженность гастроэзофагеальных рефлюксов у больных РА, отражены в табл. 4.
Полученные результаты показали, что в группе больных РА имелись отклонения показателей DeMeester от нормальных значений. Особенно ярко это прослеживалось в отношении таких показателей, как общее время с рН <4, время с рН <4 лежа, число рефлюксов, длящихся дольше 5 мин.
На рис. 3 представлены 24-часовые рН-граммы пищевода и тела желудка больной С., 25 лет, с диагнозом РА.
Как видно на рис. 3, у пациентки С. имелось наличие ДГР и гастроэзофагеального рефлюкса, при этом средняя продолжительность ДГР составила не менее 5 ч. Было отмечено повышение таких показателей
Таблица 2. Характеристика ДГР у больных РА
| Показатель | Больные РА | Контроль |
| Частота ДГР, n (%) | 23 (67,7)* | 5 (35,7) |
| Длительность ДГР, мин | 268,2+21,18* | 53,4+6,44 |
Примечание. *– р<0,05 по сравнению с группой контроля.
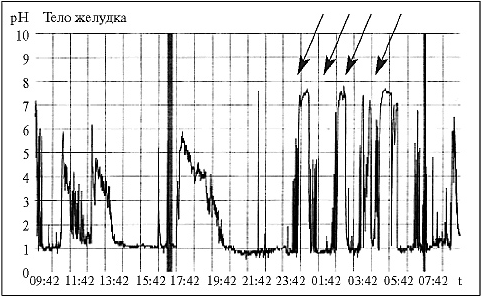
Рис. 2. 24-часовая рН-грамма тела желудка больной Т., 57 лет, с РА (стрелками указаны пики, соответствующие ДГР)
Таблица 3. Показатели 24-часовой внутрипищеводной кислотности у больных РА
| Значение рН | Больные PA (n=34) | Контроль (n=14) |
| Среднее в течение суток | 5,89+0,13 | 5,84+0,13 |
| В дневное время | 5,71+0,14 | 5,90+0,14 |
| В ночное время | 6,19+0,13* | 5,90+0,16 |
| В горизонтальном положении тела | 5,97+0,15 | 5,89+0,15 |
| В вертикальном положении тела | 5,80+0,12 | 5,79+0,18 |
| Минимальное | 1,29+0,14 | 0,84+0,12 |
| Максимальное | 8,76+0,14** | 7,96+0,20 |
Примечание. *– р<0,05 по сравнению с дневным рН; **– р<0,05 – по сравнению с контрольной группой.
Таблица 4 Показатели DeMeester у больных РА (М±8)
| Показатели | Больные РА (n=34) | Норма |
| Время с рН <4, общее, % | 6,93+1,82 | <4,5 |
| Время с рН <4, стоя, % | 8,52+2,04 | <8,4 |
| Время с рН <4, лежа, % | 5,82+1,91 | <3,5 |
| Число рефлюксов с рН <4 | 29,58+5,50 | <46,9 |
| Число рефлюксов дольше 5 мин | 3,91+1,05 | <3,5 |
| Самый длительный рефлюкс, мин | 17,79+4,35 | <19 мин 48 с |
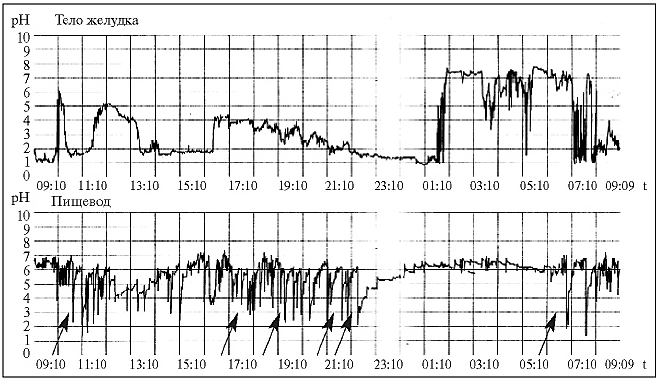
Рис. 3. 24-часовые рН-граммы пищевода и тела желудка больной С., 25 лет (стрелками указаны пики, соответствующие гастроэзофагеальным рефлюксам)
DeMeester, как общее время с рН <4, время «лежа» с рН <4, общее число гастроэзофагеальных рефлюксов в дневное время. Таким образом, у больной С. c клинической картиной эпигастралгии и диспепсии наблюдалось нарушение как гастродуоденальной, так и гастроэзофагеальной моторики.
При анализе клинических симптомов НПВП-гастропатии нами была выявлена прямая корреляционная зависимость между наличием таких кислотозависимых симптомов, как боль в эпигастрии и изжога (р<0,05), аналогичная прямая корреляция встречалась и между дисмоторными проявлениями – тошнота, отрыжка, тяжесть в эпигастральной области (р<0,05). Таким образом, у пациентов с болью в эпигастральной области чаще отмечалась изжога, а у пациентов с тяжестью в животе – чаще тошнота и отрыжка. Отмечалась также обратная корреляция между кислотозависимыми и дисмоторными симптомами, т. е. пациенты с РА с болью в эпигастрии и изжогой реже отмечали тошноту, отрыжку и тяжесть в эпигастральной области, и наоборот (р<0,05).
Анализ 24-часовых рН-грамм выявил, что у 37% больных РА имелось сочетание гастроэзофагеального и дуоденогастрального рефлюксов. Именно в этой группе у всех пациентов был отмечен клинический «перекрест» болевого и диспепсического синдромов (р<0,05).
Таким образом, выявленные нами нарушения моторики верхних отделов ЖКТ у больных РА, принимающих НПВП, могут играть значимую роль в развитии клинических проявлений НПВП-гастропатии, и, возможно, определенной группе больных необходимо проводить медикаментозную коррекцию симптомов, связанных с нарушением моторики.
ЛИТЕРАТУРА
1. Каратеев А.Е. НПВП-ассоциированная патология верхних отделов ЖКТ: современное состояние проблемы – http://medi.ru/doc
2. Циммерман Я.С., Циммерман И.Я. Гастродуоденальные эрозивно-язвенные повреждения, индуцированные приемом нестероидных противовоспалительных препаратов. Клин мед 2008;2:8–14.
3. Alonso-Ruiz A., Pijoan J., Ansuategui E. Tumor necrosis factor alpha drugs in rheumatoid arthritis: systematic review and meta-analysis of efficacy and safety. BMC Musculoskelet Disord 2008;9:52.
4. Wallace J.L. Prostaglandins, NSAIDs, and gastric mucosal protection: why doesn’t the stomach digest itself. Physiol Rev 2008;88:1547–65.
5. Scarpignato C., Hunt R.H. Nonsteroidal antiinflammatory drug-related injury to the gastrointestinal tract: clinical picture, patho-genesis, and prevention. Gastroenterol Clin North Am 2010;39(3):433–64.
6. Lanas A. A review of the gastrointestinal safety data – a gastroenterologist’s perspective. Rheumatology (Oxford) 2010;49:3–10.
7. Насонов Е.Л., Каратеев А.Е. Поражения желудка, связанные с приемом нестероидных противовоспалительных препаратов. Клин мед 2000;3:4–10 (ч. 1);4:4–9 (ч. 2).
8. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Под ред. А.Е. Каратеева. М.: ИМА-ПРЕСС, 2009;167 с.
9. Дроздов В.Н. Гастропатии, вызванные НПВП: патогенез, профилактика и лечение. Consilium medicum 2005;1(прил.):3–6.
10. Bassotti G., Bucaneve G., Furno P. Double-blind, placebo-controlled study on effect of diclofenac sodium and indometacin on post-prandial gastric motility in men. Dig Dis Sci 1998;43:1172–6.
11. Каратеев А.Е., Насонов Е.Л. Нестероидные противовоспалительные препараты и верхние отделы желудочно-кишечного тракта: патология, не связанная с развитием язв и эрозий. Рус мед журн 2002;10(28):28–30.
12. Lanza F.L. Endoscopic studies of gastric and duodenal injury after the use of ibupro-fen, aspirin, and other non-steroidal anti-inflammatory agents. Am J Med 1984;77:19–24.
13. Ильченко А.А., Селезнева Э.Я. Компьютерная рН-метрия желудка и пищевода. Клиническое значение метода: Метод. рекомендации №15. М.: Департамент здравоохранения Правительства Москвы, 2001;40 с.
14. Рапопорт С.И., Лакшин А.А., Ракитин Б.В., Трифонов М.М. рН-метрия пищевода и желудка при заболеваниях верхних отделов пищеварительного тракта. Под ред акад. РАМН Ф.И. Комарова. М., 2005; 208 с.
Поступила 11.04.2011
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru





