Содержание статьи
Прогностическое значение экспрессии генов молекул врожденного иммунитета (TLR2, TLR4 и HBD1) при невынашивании беременности
И. В. Бахарева, доктор медицинских наук, профессор
Л. В. Ганковская, доктор медицинских наук, профессор
Л. В. Ковальчук, доктор медицинских наук, профессор, академик РАЕН
О. А. Свитич, доктор медицинских наук, доцент
В. В. Романовская, кандидат медицинских наук
П. А. Кузнецов, кандидат медицинских наук
A. M. Магомедова
Е. В. Дворецкая
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития России, Москва
Внутриутробная инфекция (ВУИ) является важной и нерешенной проблемой акушерства и перинатологии [1–3]. ВУИ развивается у 27,4–36,6% детей, рожденных живыми, а в структуре смертности новорожденных инфекционная патология занимает ведущее положение, обусловливая от 11% до 45% потерь [4, 5]. ВУИ является причиной многих осложнений беременности: невынашивания, плацентарной недостаточности, инфекционных заболеваний плода, хронической гипоксии, мертворождений, пороков развития плода, синдрома задержки роста плода. Увеличение частоты данной патологии в структуре акушерских осложнений и перинатальной заболеваемости и смертности обусловлено увеличением количества женщин фертильного возраста с наличием той или иной урогенитальной инфекции (УГИ) [6].
Сложности антенатальной диагностики ВУИ связаны с полиэтиологичностью патологии, отсутствием четкой взаимосвязи между выраженностью клинических проявлений у матери и степенью поражения плода, многофакторным влиянием инфекционного агента на плод. Из-за неспецифичности клинических проявлений ВУИ диагностика ее во время беременности затруднена и возможна лишь при сочетанном использовании клинических и лабораторно-инструментальных методов исследования [7, 8].
В возникновении ВУИ важную роль играют ограниченные возможности иммунной системы беременной своевременно распознать и уничтожить этиологические агенты инфекции. Иммунологическая защита против различных патогенов осуществляется в результате скоординированной работы врожденной и адаптивной систем иммунитета [9, 10]. В последние годы появляются первые работы о роли механизмов врожденного иммунитета в репродуктивной функции человека [11–14]. Важное значение в развитии ряда патологических процессов, в том числе воспаления, имеют распознающие рецепторы врожденной иммунной системы: То11-подобные рецепторы (Toll-like receptors (TLRs)) [15–17]. TLRs, распознавая консервативные молекулярные образцы различных патогенов, включая вирусы, бактерии, грибы, увеличивают локальный синтез цитокинов, простагландинов, хемокинов и противомикробных пептидов, что запускает механизм реализации воспалительного ответа [18, 19]. Первым TLR, идентифицированным у человека, был TLR4. Этот рецептор распознает липополисахариды (ЛПС) клеточной стенки грамотрицательных бактерий. Наиболее широким спектром специфичности из всех идентифицированных TLRs обладает TLR2. TLR2 связывается с липопротеинами грамположительных и грамотрицательных бактерий, пептидогликаном и липотейхоевой кислотой грамположительных бактерий, грибковым зимозаном.
Экспрессия TLRs доказана в эпителии эндометрия и цервикального канала [20, 21]. Взаимодействие TLRs с различными патогенами индуцирует выработку провоспалительных цитокинов. Плацентарная ткань при нормальной доношенной беременности также экспрессирует TLRs 1–10 на уровне генов [23]. Определенные ВУИ во время беременности оказывают как прямое, так и непрямое влияние на выживание клеток трофобласта, что зависит от активации различных TLRs [22].
В проблеме ВУИ вопросы ее диагностики и прогнозирования являются наиболее актуальными в настоящее время. Имеются основания предполагать, что применение современных технологий для выявления доклинических признаков ВУИ может обеспечить раннюю диагностику данной патологии и возможность новых подходов к разработке комплексных мер профилактики и лечения.
Цель исследования
Оценка прогностической роли комплексного исследования уровня экспрессии генов Toll-подобного рецептора 2 (TLR2), То11-подобного рецептора 4 (TLR4) и противомикробного пептида HBD1 эпителием слизистой оболочки цервикального канала и клетками плаценты при беременности высокого риска реализации ВУИ.
Материалы и методы
В данное исследование было включено 120 женщин. В основную группу входили женщины с наличием УГИ и невынашиванием беременности инфекционного генеза (в 1а подгруппе — недоношенные дети имели разнообразные локальные и системные проявления ВУИ; в 1б подгруппе — клинические признаки ВУИ отсутствовали). Группу сравнения составили женщины с УГИ, беременность которых закончилась своевременными родами, реализации ВУИ не было (3-я группа). Контрольную группу составили здоровые женщины с физиологически протекающей беременностью, которая завершилась своевременными родами (2-я группа).
Уровень экспрессии генов TLR2, TLR4, HBD-1 в эпителиальных клетках слизистой оболочки цервикального канала и ткани плаценты определялся методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ).
Для этого на первом этапе из биологического материала выделяли РНК с использованием метода кисло-фенольной экстракции с использованием сорбентов — силикагелей (набор «Рибо-сорб», ФГУН ЦНИИЭ Роспотребнадзора, «АмплиСенс», РФ).
На следующем этапе исследований проводили реакцию обратной транскрипции (синтез к ДНК на матрице РНК). Реакционная смесь содержала в общем объеме 25 мкл 4 мкл РНК, четыре основных dNTP («СибЭнзим», РФ) в концентрации ImM каждого, 10 нмоль random гексамеров («Синтол», РФ), 10 нмоль праймера-затравки («Синтол», РФ), 40 ед. ингибитора РНКаз («Fermentas», Канада) и 100 ед. ревертазы M-MLV («СибЭнзим», РФ). При составлении реакционной смеси использовали 5-кратный буфер для обратной транскрипции. Отжиг праймера-затравки проводили при 75 °C в термостате «Термит» («ДНК-технология», РФ) в течение 3 минут. Параллельно готовили другую смесь: 2 мкл dNTP; 0,2 мкл обратной транскриптазы; 2,5 мкл 10-кратного буфера для обратной транскриптазы (10 × Reverse Transcriptase Bufer). После добавления второй смеси пробирки помещали в амплификатор «Терцик» («ДНК-технология», РФ) с заданной программой инкубации: при 37 °C в течение 1 ч, затем образцы прогревали до 94 °C в течение 10 мин. Полученную кДНК хранили при –70 °C.
В работе применялся метод ПЦР-РВ. Последовательность праймеров подбирали с помощью программы Vector NTI 8,0, анализируя последовательность генов, полученную из электронной базы данных GenBank [18]. Реакционную смесь готовили из реактивов «Набора для проведения ПЦР-РВ в присутствии интеркалирующего красителя SYBR Green I» («Синтол», РФ) согласно рекомендациям фирмы-производителя. После приготовления реакционных смесей пробирки помещали в амплификатор для ПЦР-РВ АНК-32 (Институт аналитического приборостроения РАН, Россия), позволяющий анализировать образцы ДНК/РНК в динамическом диапазоне от 1 до 104 копий и одновременно детектировать четыре флуоресцентных красителя (FAM/SYBR Green, ROX, R6G, CY5) с заданной программой (95 °C — 20 сек, 62 °C — 40 сек) с числом циклов 35–40. Изучение экспрессии исследуемого гена проводили относительно экспрессии гена актина.
Для определения экспрессии гена р-актина помимо имеющейся системы использовали «Набор реактивов для обнаружения и определения кДНК р-актина человека» («Синтол», РФ). Все действия по постановке реакции осуществлялись согласно рекомендациям фирмы-производителя.
Статистический анализ проводили с использованием общепринятых статистических методов, рассчитывая в группах данных: среднее арифметическое (X), X = ZXj/n, дисперсию (а2), а2 = I (Xj — X)2/n, среднее квадратичное отклонение (стх), ах = vE (Xj — X)2/n, где v — значение варианта, n — число экспериментов.
Применяли также компьютерные статистические программы BioStat и Excel. В работе результаты представлены в виде Х ± а. Для сравнения групп данных использовали непараметрические методы статистической обработки. В связи с разным числом наблюдений в каждой из групп для оценки статистической достоверности различий экспрессии генов в исследуемых группах использовали непараметрический критерий Манна–Уитни.
Результаты исследования и их обсуждение
Средний возраст обследованных в группах составил 25,7 ± 0,26 года, с индивидуальными колебаниями от 19 до 42 лет. При клиническом анализе было выяснено, что женщины 1-й, 2-й и 3-й групп достоверно не отличались по возрасту, наследственности, характеру менструальной функции.
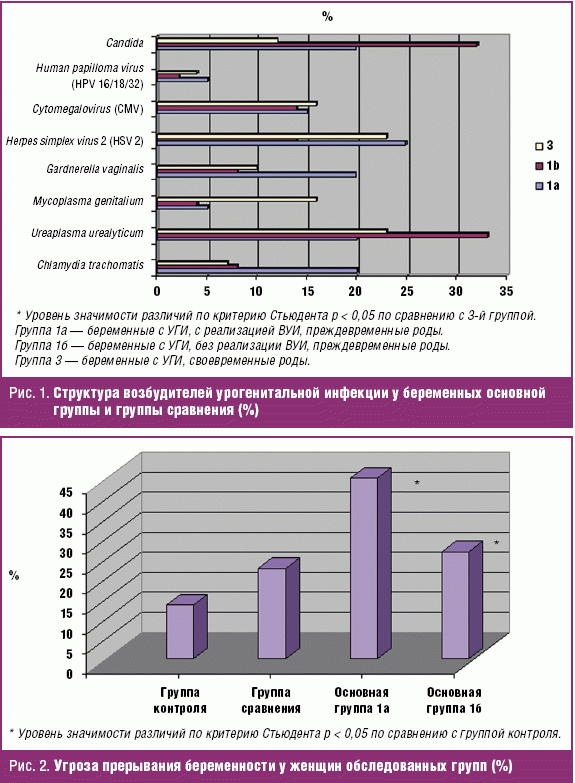
В структуре УГИ у пациенток 1-й группы наиболее часто во время беременности выявлялась Ureaplasma urealyticum (29,2%). На втором месте по частоте встречаемости — Candida (27,7%). На третьем месте — вирусная инфекция: Herpes simplex virus 2 (16,9%), Cytomegalovirus (13,9%) — рис. 1. Данные лабораторного обследования подтвердили инфекционный генез невынашивания у беременных основной группы.
Субклиническое течение инфекционного процесса без выраженных системных изменений у беременных подтверждено при гистологическом исследовании последов у женщин обследованных групп.
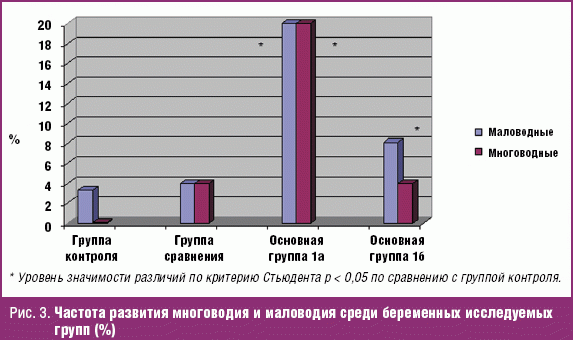
Проанализировано течение беременности и родов у женщин 1-й и 2-й групп. При этом оценивали частоту акушерских осложнений в зависимости от вида действующего патогенного микроорганизма. Наличие активной инфекции может способствовать развитию патологии сократительной деятельности матки, провоцируя угрозу прерывания беременности и преждевременных родов. Так, угроза прерывания беременности развилась у 45% обследованных 1а подгруппы (с реализацией ВУИ) и 26,7% 1б подгруппы основной группы, что в 2 раза выше, чем у женщин контрольной группы (13,3%) (рис. 2).
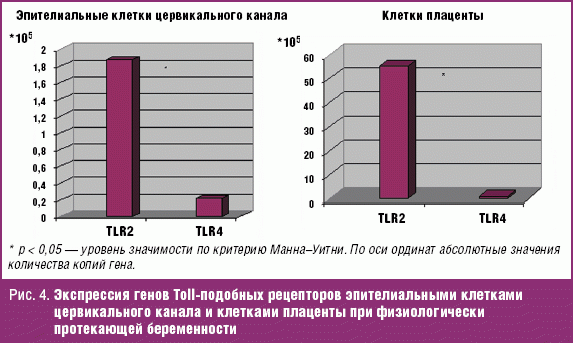
Характерным осложнением во время беременности среди женщин основной группы с наличием УГИ также является изменение индекса амниотической жидкости, причем как в сторону многоводия, так и маловодия. У беременных 1а подгруппы с реализацией ВУИ маловодие и многоводие в III триместре развивалось чаще (20%). У здоровых беременных многоводия не отмечалось. У 3,3% здоровых женщин отмечалось маловодие (рис. 3).
Плацентарная недостаточность выявлена при УЗИ и была подтверждена гистологически у 35,5% женщин 1а подгруппы (с реализацией ВУИ), у 15,5% женщин в 1б подгруппе, у 3,3% здоровых беременных. Хроническая внутриутробная гипоксия плода диагностирована у 15% женщин 1а подгруппы (с реализацией ВУИ), в то время как среди здоровых беременных не выявлено данное акушерское осложнение.
Таким образом, влияние бактериальной и вирусной инфекции на течение беременности выражается в развитии ряда осложнений беременности, наиболее характерными из которых являются: угроза прерывания беременности, плацентарная недостаточность, многоводие, маловодие.
У 67,7% женщин основной группы недоношенная беременность осложнилась преждевременным разрывом плодных оболочек (ПРПО). В группе сравнения при наличии УГИ и доношенной беременности отмечалось дородовое излитие околоплодных вод у 8%, раннее излитие околоплодных вод — у 10% здоровых женщин.
Нами проведено комплексное определение количественной экспрессии генов рецепторов врожденного иммунитета TLR2 и TLR4 противомикробного пептида HBD1 клетками слизистой цервикального канала, клетками плаценты и мононуклеарными клетками периферической крови.
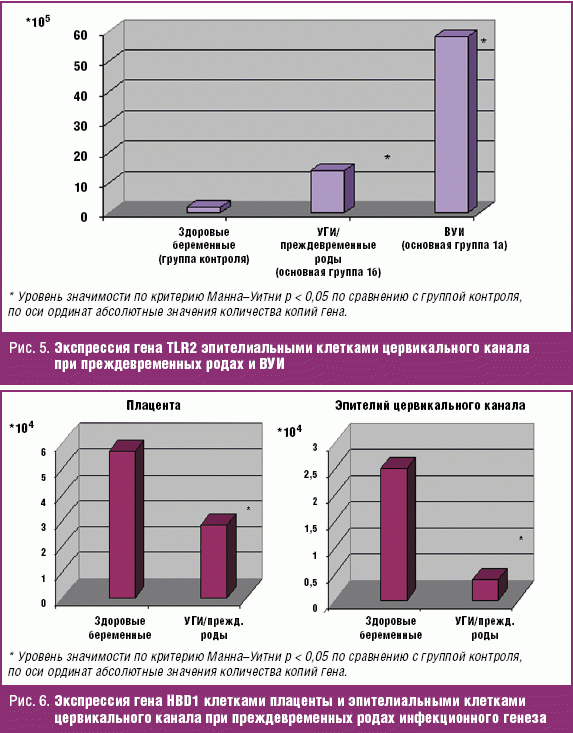
При физиологически протекающей беременности уровень экспрессии генов TLR2 и TLR4 различался. Экспрессия гена TLR2 эпителиальными клетками цервикального канала превышала уровень экспрессии TLR4 в девять раз (TLR2 1,87 ± 0,35 × 105 копий гена, TLR4 0,21 ± 0,01 × 105) (р < 0,05) (рис. 4). Повышенная экспрессия генов TLR2 клетками слизистой цервикального канала выявлена и у здоровых небеременных женщин [11].
В клетках плаценты экспрессия гена TLR2 также превышала уровень экспрессии гена TLR4 (рис. 4). Это можно объяснить более широким спектром микробных агентов, распознаваемых TLR2.
При исследовании экспрессии генов TLR2 и TLR4 клетками плаценты у беременных с УГИ и благоприятным исходом беременности — своевременными родами (группа сравнения) возрастает экспрессия гена TLR2 (122,64 ± 16,76 × 105 копий гена) в 2 раза по сравнению со здоровыми беременными из группы контроля (59,19 ± 5,85 × 105) (р < 0,05), уровень экспрессии гена TLR4 достоверно не изменялся.
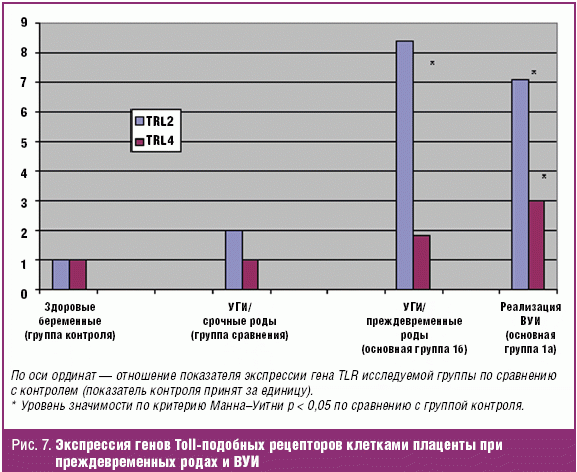
При сопоставлении уровня экспрессии гена TLR2 у женщин в конце второго, третьем триместре с исходами беременностей удалось установить взаимосвязь многократного его повышения с развитием преждевременных родов. При невынашивании беременности инфекционного генеза (беременные основной группы) нами была отмечена гиперэкспрессия гена TLR2 клетками плаценты (458,97 ± 36,06 × 105 копий гена) в 7,8 раза по сравнению с нормой (59,18 ± 5,85 × 105) (р < 0,05). Выявлена взаимосвязь высокого уровня экспрессии гена TLR2 клетками плаценты с развитием ПРПО. У 44 беременных с наличием УГИ и несвоевременным излитием вод, входящих в основную группу, уровень экспрессии гена TLR2 превышал нормативные в 5 раз (р < 0,05), TLR4 в 1,5 раз.
В клетках слизистой цервикального канала экспрессия гена TLR2 возрастала в 8,7 раза у беременных с невынашиванием беременности инфекционного генеза по сравнению с группой здоровых беременных (рис. 5). Уровень экспрессии гена TLR4 при наличии УГИ увеличивался в 1,3 раза но сравнению с группой контроля.
Противомикробные пептиды являются эффекторными молекулами врожденного иммунитета и оказывают прямое противомикробное действие. У беременных исследуемых групп была изучена экспрессия гена противомикробного пептида HBD1, который относится к Р-дефензинам и синтезируется эпителиальными клетками слизистых оболочек. Ген HBD1 экспрессируется в слизистых оболочках влагалища, эндометрии, маточных трубах, при беременности — в хорионе, плаценте [17].
При физиологической беременности (группа контроля) экспрессия гена HBD1 эпителиальными клетками слизистой цервикального канала составила: 2,51 ± 0,12 × 104 копий гена; клетками плаценты — 5,69 ± 0,6 × 104. Нами установлена взаимосвязь низких уровней экспрессии гена противомикробного пептида HBD1 клетками плаценты, эпителиальными клетками цервикального канала с развитием преждевременных родов в основной группе. Преимущественно снижение экспрессии гена HBD1 отмечалось в клетках цервикального канала — в 6,4 раза по сравнению с контролем (2,51 ± 0,12 × 104 копий гена в группе контроля, 0,39 ± 0,02 × 104 в основной группе) (р < 0,05) (рис. 7). Однако в группе сравнения у беременных с УГИ и благоприятным исходом — своевременными родами без реализации ВУИ определялся повышенный уровень экспрессии гена HBD1 эпителием цервикального канала: 2,5 ± 0,15 × 105 (группа контроля)/3,14 ± 0,23 × 104 (группа сравнения) соответственно (р < 0,05) (рис. 6).
Нами проанализирована структура патологии новорожденных, родившихся от женщин, включенных в исследование. От 120 матерей родились живыми 118 новорожденных. В двух случаях отмечалась интра- и антенатальная гибель детей с экстремально низкой массой тела в результате глубокой недоношенности и асфиксии. В основной группе у 65 беременных с преждевременными родами родились недоношенные дети в сроке гестации 26–36 недель. У 20 детей от матерей данной группы были клинические признаки ВУИ, состояние при рождении данных детей было тяжелое, обусловленное недоношенностью и ВУИ. В группе контроля у 30 беременных с нормально протекающей беременностью и своевременными родами дети родились доношенными. Все новорожденные данной группы родились в удовлетворительном состоянии без видимых пороков развития. В группе сравнения родились доношенные дети от 25 беременных с УГИ. Длительное лечение, в основном по поводу недоношенности и внутриутробной пневмонии с переводом на второй этап выхаживания 70% (14) из 1а подгруппы с реализацией ВУИ, 42,2% (19) из 1б подгруппы без реализации ВУИ, требовалось преимущественно для детей от матерей основной группы. Длительность пребывания в стационаре недоношенных новорожденных детей колебалась от 10 до 40 дней.
Оценка состояния недоношенных новорожденных с реализацией ВУИ, родившихся от матерей с УГИ 1а подгруппы основной группы, составляла по Апгар на 1-й и 5-й минуте соответственно 6,1 ± 0,4 и 6,4 ± 0,6 балла. Средняя масса таких детей при рождении — 1730 ± 134 г. Такая же оценка состояния недоношенных новорожденных без реализации ВУИ, родившихся от матерей с УГИ 1б подгруппы, составили соответственно 7,0 ± 0,3 и 7,75 ± 0,3 балла, средняя масса этих детей — 2410 ± 103 г. В массоростовых показателях не было достоверных различий между группой сравнения и контрольной группой. В группе здоровых беременных оценка состояния новорожденных составила 8,5 ± 0,4 и 8,6 ± 0,38 балла, средняя масса — 3430 ± 148 г, в группе сравнения оценка по шкале Апгар 7,7 ± 0,33 и 8,4 ± 0,36 балла, масса 3590 ± 154 г.
Наличие признаков ВУИ было исследовано в основной группе у недоношенных детей от матерей с УГИ. При анализе течения раннего неонатального периода отмечена наибольшая частота реализации ВУИ — развития внутриутробной пневмонии в основной группе при преждевременных родах — 24,6% (16). Другие клинические проявления ВУИ у детей, рожденных матерями 1-й группы (кандидоз, энтероколит, кожно-геморрагический синдром и др.), отмечались примерно с одинаковой частотой, и нередко имело место сочетание двух и более признаков у одного ребенка.
Также у новорожденных от женщин основной группы чаще отмечались неспецифические клинические признаки, такие как отечный синдром (11%), гипербилирубинемия (18,5%), свидетельствующие о напряженном состоянии адаптационных механизмов в условиях отрицательного влияния инфекционного и гипоксического факторов. У 40% (26) детей от матерей основной группы отмечалось развитие гипоксического поражения ЦНС, у 20% внутрижелудочковые кровоизлияния (ВЖК) различной степени. Достоверного различия недоношенных детей с синдромом задержки развития плода (СЗРП) от матерей основной группы с УГИ и доношенных детей с СЗРП от матерей группы сравнения не отмечалось (4,6% и 4,0% соответственно).
Мы проводили клинико-иммунологические параллели между изменением уровня экспрессии генов рецепторов TLR2 и TLR4 клетками плаценты и эпителия цервикального канала женщин основной группы и наличием реализации ВУИ их новорожденных. В этом же контексте проведен анализ экспрессии гена противомикробного пептида HBD1.
Анализ средних значений экспрессии генов TLRs клетками плаценты у женщин основной группы показал достоверное и значительное их повышение при реализации ВУИ новорожденных. Экспрессия гена TLR2 при невынашивании беременности инфекционного генеза и реализации ВУИ новорожденных в 7 раз превышала норму (группа контроля — здоровые беременные — 59,19 ± 5,85 × 105 копий гена, группа с реализацией ВУИ — 420,48 ± 36,02 × 105); р < 0,05, TLR4 в 3 раза (группа контроля — 0,59 ± 0,06 × 105, 1а подгруппа с реализацией ВУИ — 1,77 ± 0,28 × 105); р < 0,05 (рис. 7).
Экспрессия гена TLR2 эпителием цервикального канала при реализации ВУИ возрастала в 30 раз (группа контроля — здоровые беременные — 1,87 ± 0,35 × 105 копий гена, 1а подгруппа — с реализацией ВУИ 59,14 ± 9,43 × 105); р < 0,05 (рис. 5). При изучении экспрессии гена TLR4 эпителием цервикального канала у группы беременных с реализацией ВУИ оказалось, что уровень экспрессии превышал контрольный в 3,5 раза.
При изучении экспрессии гена противомикробного пептида HBD1 у женщин, родивших детей с признаками ВУИ, уровень экспрессии гена HBD1 уменьшался, более выраженное изменение отмечалось в плаценте — в 3,24 раза по сравнению с нормой (группа контроля — здоровые беременные — 5,69 ± 0,59 × 104 копий гена, 1а подгруппа — с реализацией ВУИ — 1,76 ± 0,22 × 104); р < 0,05.
Итак, по отношению к HBD1 установлена обратная зависимость — достоверное снижение значений экспрессии гена эпителиальными клетками цервикального канала и клетками плаценты у беременных с невынашиванием беременности и реализацией ВУИ новорожденных. Экспрессия генов TLRs при данных осложнениях, наоборот, резко возрастает. В группе сравнения при УГИ и благоприятном исходе беременности у женщин наблюдается увеличение уровня экспрессии гена HBD1, реализации ВУИ их новорожденных не наблюдалось. Это, по-видимому, можно объяснить неполноценностью механизмов противомикробной защиты на границе мать–плод, следствием чего и является распространение инфекции.
Заключение
Таким образом, можно предположить, что изменение экспрессии генов, кодирующих молекулы врожденного иммунитета, такие как паттерн-распознающие рецепторы — TLRs и противомикробный пептид HBD1, может в конечном итоге привести к нарушению механизмов защиты от инфекции в системе мать–плод. В результате проведенных исследований выявлены маркеры, свидетельствующие о возможности развития преждевременных родов и ВУИ плода. Установлен дисбаланс в системе врожденного иммунитета, который выражается в гиперэкспрессии гена TLR2 и угнетении экспрессии гена HBD1 в эпителиальных клетках цервикального канала и клетках плаценты.
Сочетание повышенной экспрессии гена TLR2 и недостаточной экспрессии гена HBD1 является чувствительным тестом, позволяющим выделить группу риска по возникновению преждевременных родов. Дисбаланс исследуемых генов врожденного иммунитета наблюдался при реализации ВУИ.
Проведение подобных исследований по изучению экспрессии генов TLR2 и HBD1 в клетках слизистой цервикального канала на ранних сроках беременности позволяет прогнозировать вероятность развития данных осложнений и своевременно назначать и проводить корригирующую терапию.
Литература
- Сенчук А. Я., Дубоссарская З. М. Перинатальные инфекции: практическое пособие. М.: МИА. 2004: 448.
- Guaschino S., De Seta F., Piccoli M., Maso G., Alberico S. Aetiology of preterm labour // В JOG. 2008, Apr; 115 (5): 674–675.
- Серов В. Н., Тютюнник В. Л., Зубков В. В. и др. Перинатальные потери у беременных с инфекционными заболеваниями и плацентарной недостаточностью // Акушерство и гинекология. 2002; 3: 16–21.
- Безнощенко Г. Б., Долгих Т. И., Кривчик Г. В. Внутриутробные инфекции (вопросы диагностики и врачебной тактики). М.: Медкнига; Н. Новгород: Изд-во НГМА, 2003: 88.
- Гриноу А., Осборн Д., Сазерленд Ш. Врожденные, перинатальные и неонатальные инфекции. М., Медицина, 2000: 287.
- Кулаков В. И., Гуртовой Б. Л., Анкирская А. С., Антонов А. Г. Актуальные проблемы антимикробной терапии и профилактики инфекций в акушерстве, гинекологии и неонатологии // Акушерство и гинекология. 2004; 1: 3–6.
- Кан Н. Е. Современные технологии в диагностике и прогнозировании внутриутробных инфекций. Автореф. дисс. … докт. мед. наук. М., 2005.
- Сидорова И. С., Макаров И. О., Матвиенко Н. А. Внутриутробная инфекция: Ведение беременности, родов и послеродового периода. М.: Медпресс-информ, 2008: 65–70.
- Сухих Г. Т, Ванько Л. B. Иммунология беременности. М., 2003, 269–283, 400 с.
- Moffett A., Loke Y. W. The immunological paradox of pregnancy: a reappraisal // Placenta. 2004; 25: 1–8.
- Fazelil A., Bruce С., Anumba D. O. Characterization of Toll-like receptors in the female reproductive tract in humans // Human Reprod. 2005; 20 (5): 1372–1378.
- Guleria L., Pollard J. W. The trophoblast is a component of the innate immune system during pregnancy // Nat. Med. 2000; 6: 589–593.
- Romero R. Novel aspects of neutrophil biology in human pregnancy // Am. J. Reprod. Immunol. 2005; 53: 275.
- Schaefer T. M., Fahey J. V., Wright J. A. et al. First trimester trophoblast cells mount a potent antiviral response upon exposure to viral dsRNA // Am. J. Reprod. Immunol. 2005; 53: 299.
- Ковачьчук Jl. В., Хорева М. В, Варивода А. С. Врожденные компоненты иммунитета: То11-подобные рецепторы в норме и при патологии // ЖМЭИ. 2005; 4: 96–104.
- Medzhitov R., Janeway Jr С. А. Innate immunity // The New England Journal of Medicine. 2000; Aug.: 338–344.
- Young S. L., Lyddon T. D., Jorgenson R. L., Misfeldt M. L. Expression of Toll-like receptors in human endometrial epithelial cells and cell lines // Am. J. Reprod. Immunol. 2004; 52: 67–73.
- Ковальчук Л. В., Ганковская Л. В., Ганковская О. А., Лавров В. Ф. и др. Роль ТоП-подобных рецепторов и дефенсинов в противомикробной защите урогениталъного тракта женщин // ЖМЭИ. 2008; 1: 46–50.
- Zhang D. Zhang G. Hoyden M. S. et al. A Toll-like receptor that prevents infection by uropathogenic bacteria // Science. 2004, 303: 1522.
- Schaefer T. M., Fahey J. V., Wright J. A. et al. First trimester trophoblast cells mount a potent antiviral response upon exposure to viral dsRNA // Am. J. Reprod. Immunol. 2005; 53: 299.
- Young S. L., Lyddon T. D., Jorgenson R. L., Misfeldt M. L. Expression of Toll-like receptors in human endometrial epithelial cells and cell lines // Am. J. Reprod. Immunol. 2004; 52: 67–73.
- Abrahams V. M., Мог G. Toll-like Receptors and their Role in the Trophoblast // Placenta. 2005; 26: 540–547.
- Xu J., Holzman С. В., Arvidson C. G., Chung H., Goepfert A. R. Midpregnancy vaginal fluid defensins, bacterial vaginosis, and risk of preterm delivery // Obstet Gynecol. 2008, Sep; 112 (3): 524–531.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru


