Содержание статьи
Введение
Клиническими проявлениями новой коронавирусной инфекции (coronavirus disease 2019, COVID-19) являются лихорадка, слабость, головная боль, миалгия, одышка, сухой кашель, боли в животе, тошнота, рвота и диарея. При прогрессировании заболевания альвеолярное повреждение может постепенно привести к дыхательной недостаточности и к летальному исходу [1–3]. Лабораторные предикторы [4] неблагоприятных клинических исходов включают лимфопению (35–75% случаев), повышение СРБ (75–93% случаев), ЛДГ (27–92% случаев), СОЭ (до 85% случаев) и D-димера (36–43% случаев), а также снижение уровня сывороточного альбумина (50–98% случаев) и гемоглобина (41–50%). Изначально в многоцентровых клинических исследованиях, проведенных в Китае, в качестве методов лечения пневмонии, связанной с COVID-19, были предложены противовирусные препараты и гидроксихлорохин [5, 6]. Ангиотензин-превращающий фермент 2 (АПФ2) играет важнейшую роль в проникновении вируса в клетку и последующем развитии легочной инфекции (рис. 1) [7–15]. АПФ2 в значительной степени экспрессируется в эпителии ротовой полости, эпителии дыхательных путей, альвеолоцитах, энтероцитах тонкой кишки и щеточной каемке проксимальных почечных канальцев [10]. Локализация рецепторов АПФ2 связана со сродством к определенным тканям и патогенезом вирусной инфекции. Заражение SARS-CoV может вызывать инфекцию верхних дыхательных путей, но чаще всего — инфекцию нижних дыхательных путей. Передача инфекции COVID-19 происходит аналогично другим коронавирусам, в основном от человека к человеку. Тяжесть заболевания варьирует от легкой до тяжелой. В 2011 г. Lang et al. заявили, что лактоферрин (ЛФ) может быть потенциально эффективен при лечении ТОРС [7]. Однако до настоящего времени не было сообщений о клиническом применении ЛФ у пациентов с COVID-19. SARS-CoV — это оболочечный РНК-содержащий вирус с геномом длиной около 30000 нуклеотидов, он кодирует неструктурный репликазный комплекс и структурные белки, включая в т. ч. шиповидный (S), оболочечный (E) белки и белок S2, мембранный (M) и нуклеокапсидный (N) белки [7]. Шиповидный белок состоит из двух субъединиц: S1 опосредует связывание вируса с рецепторами на клетках-мишенях, и S2 отвечает за слияние вируса с клеточной мембраной и проникновение в клетку-хозяина [7]. АПФ2, металлопептидаза, является функциональным рецептором вируса, отвечает за связывание с белком S (рис. 1) и опосредует проникновение вируса в клетки-мишени [7].
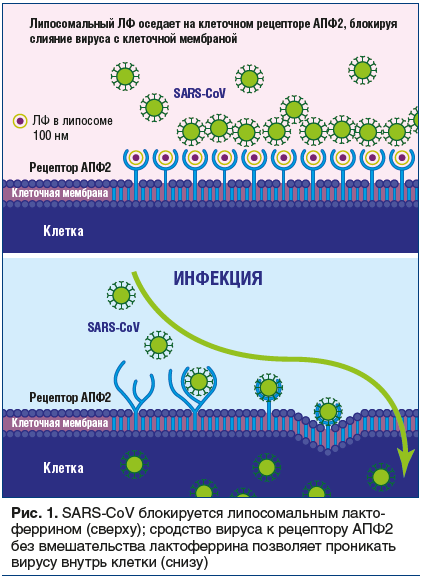
Сегмент с аминокислотами 318–510 белка S1 является рецептор-связывающим доменом для рецептора АПФ2 [7]. У некоторых пациентов с инфекцией COVID-19 развивается интенсивный иммунный ответ «хозяин против вируса». Врожденный иммунный ответ играет важную роль в подавлении вирусной инфекции. Многие гены могут быть вовлечены во врожденный иммунный ответ, например гены, кодирующие синтез лактоферрина, S100A9 и липокалина 2, которые участвуют в клиренсе SARS-CoV [8, 9, 11]. Наблюдалась повышенная экспрессия гена ЛФ и сильное повышение уровня ЛФ (в 150 раз) у пациентов с SARS по сравнению со здоровыми добровольцами. Считается, что ЛФ может стимулировать активность NK-клеток и агрегацию и адгезию нейтрофилов [16, 17]. ЛФ является многофункциональным гликопротеином, присутствующим в различных жидкостях организма, включая грудное молоко, слюну, слезную жидкость, сперму, выделения из влагалища, бронхиальную слизь, секреторные жидкости желудочно-кишечного тракта и мочу, а также присутствует в нейтрофильных гранулах лейкоцитов [16]. ЛФ обладает противовирусной активностью в отношении ряда РНК- и ДНК-содержащих вирусов [18–23], которые используют молекулы клеточной мембраны, такие как гепарансульфат протеогликаны (ГСПГ), для проникновения в клетки. Эти молекулы являются первыми сайтами закрепления на поверхности клетки и помогают вирусу установить первичный контакт с клетками-хозяевами [7]. ЛФ может предотвращать интернализацию некоторых вирусов после связывания с ГСПГ, присутствующими в большинстве клеток [7]. Это свойство ЛФ обеспечивает защиту хозяина от вирусных инфекций. ЛФ играет важную защитную роль в иммунной защите хозяина от инвазии COVID-19.
Целью данного исследования явилось изучение эффективности применения липосомального бычьего лактоферрина (ЛЛФ) для лечения COVID-19 у амбулаторных пациентов.
Материал и методы
Для включения в исследование было отобрано 75 пациентов с COVID-19 с характерными симптомами заболевания и положительным результатом на SARS-CoV-2. Пациенты были изолированы и проходили лечение в домашних условиях с помощью дистанционных систем, обследовались ежедневно в течение 10 дней с последующим наблюдением до 1 мес. Диагноз был подтвержден экспресс-тестом цельной крови на антитела IgM/IgG к SARS-CoV-2 (экспресс-тест на антитела IgM/IgG к SARS-CoV-2 «Лиминг Био» (Liming Bio), Цзянсу, КНР). ЛЛФ (Lactyferrin™ Forte (Лактиферрин Форте)) питьевой («Сесдерма Лабораториз» (Sesderma Laboratories, Валенсия, Испания), а также липосомальный цинк (ЛЦ) в форме сиропа (Zinc Defense (Цинк Дефенс)) «Сесдерма Лабораториз» (Sesderma Laboratories, Валенсия, Испания) вводили перорально по 4–6 доз в сутки. Принимали раствор липосомального цинка в дозе 10 мг / 10 мл 2–3 р./сут. Контрольная группа из 12 пациентов получала только ЛЛФ. Общая суточная доза ЛЛФ составляла от 256 до 384 мг/сут. Lactyferrin™ (Лактиферрин) содержит ЛФ (32 мг / 10 мл и витамин С 12 мг / 10 мл). Оба вещества являются гидрофильными, и их всасывание в желудке очень ограничено. Липосома с ее закрытой везикулярной системой с двойным фосфолипидным слоем может инкапсулировать как гидрофильные (ЛФ, витамин С, цинк), так и гидрофобные вещества.
Все члены семьи, контактировавшие с пациентами (256 человек), получали половину этой дозы. Пациенты с головной болью, сухим кашлем и заложенностью носа также применяли Lactyferrin (Лактиферрин), капли назальные, и Lactyferrin (Лактиферрин), спрей для полости рта, 4 р./сут соответственно. Также все пациенты с одышкой применяли ЛФ в лекарственной форме аэрозоль (SES Nanomist (СЕС Наномист), «Сесдерма Лабораториз» (Sesderma Laboratories)).
Состояние всех пациентов медицинская команда оценивала удаленно. Пациентов наблюдали ежедневно (не менее 2 р./сут) в течение 10 дней, а затем через 30 дней. Для каждого пациента в каждом случае симптомы оценивали по шкале от 0 до 3 баллов следующим образом: 0 баллов — отсутствие симптомов; 1 балл — легкая степень тяжести; 2 балла — умеренная степень тяжести; 3 балла — тяжелая степень. Вкус и запах оценивали по шкале от 0 до 5 баллов, где 0 баллов — отсутствие вкуса/запаха (агевзия/аносмия), а 5 баллов — отсутствие изменений вкуса/запаха.
Результаты исследования
В группе с комбинированным лечением (ЛЛФ + ЛЦ) медианный возраст пациентов составлял 42 года; 45% были женщины (контрольная группа была сопоставима по половозрастному составу пациентов). Во время наблюдения не было зарегистрировано летальных
исходов.
До начала лечения наиболее распространенными симптомами были слабость/утомляемость (94,44%), потеря обоняния (83,33%) и вкуса (88,89%), мышечная боль (66,67%), сухой кашель (61,11%), головная боль (55,56%), диарея (44,4%), насморк (33,33%), затрудненное дыхание (27,78%), заложенность носа (22,22%) и одинофагия (22,22%). Другие симптомы включали жар (38%), судороги (30%), бессонницу (50%), ночную ажитацию (30%), тошноту и сильную боль в животе, метеоризм, боль в горле (28%); 1 пациент жаловался на внезапное и сильное выпадение волос (1,3%). В таблице 1 указаны доли пациентов с различной выраженностью симптомов.
Через 48 ч от начала лечения пациенты сообщали о существенном облегчении симптомов. Уменьшились доли пациентов, испытывающих слабость и миалгию. Все пациенты с умеренной и тяжелой одышкой использовали ЛФ в форме аэрозоля в виде ингалятора Наномист (SES Nanomist (СЕС Наномист), «Сесдерма Лабораториз» (Sesderma Laboratories)). Существенного улучшения ощущения вкуса или обоняния через 48 ч не регистрировали (табл. 1). Улучшение ощущения вкуса и обоняния происходило медленнее по сравнению с остальными симптомами.
На 5-й день (через 120 ч) от начала лечения состояние всех участников продолжало улучшаться, однако значительного улучшения ощущения вкуса и обоняния не наступало. Восстановление обоняния и ощущения вкуса у пациентов происходило медленнее, чем купирование других симптомов заболевания (табл. 1).
Динамика основных симптомов
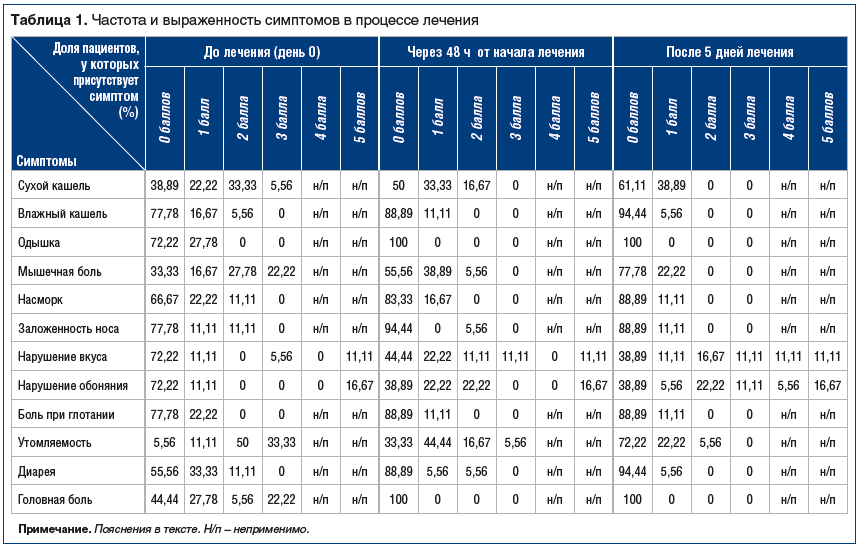
Сухой кашель (рис. 2): в начале исследования более половины пациентов предъявляли жалобы на сухой кашель. На фоне проводимой терапии количество пациентов с сухим кашлем существенно уменьшилось.
Затруднение дыхания: все пациенты, которые сообщили о затрудненном дыхании в начале исследования (день 0), сообщили об улучшении через 48 ч.
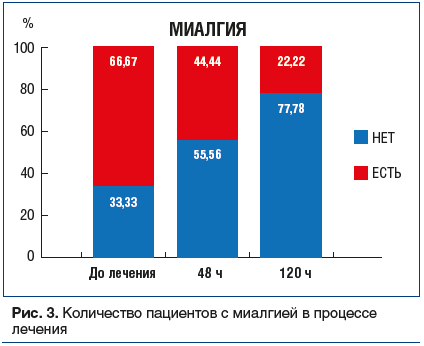
Миалгия (рис. 3): через 48 и 120 ч от начала лечения доля пациентов с мышечной болью, связанной с COVID-19, существенно снизилась.
Утомляемость (рис. 4): доля пациентов, которых беспокоила повышенная утомляемость и слабость, снизилась через 48 и 120 ч от начала лечения.
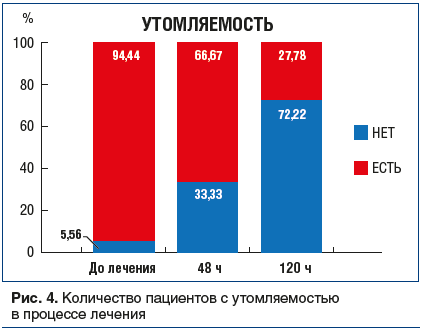
Головная боль (рис. 5): в день 0 более половины пациентов отмечали сильную головную боль; через 48 и 120 ч от начала терапии ни один из этих пациентов не предъявлял жалоб на головную боль.
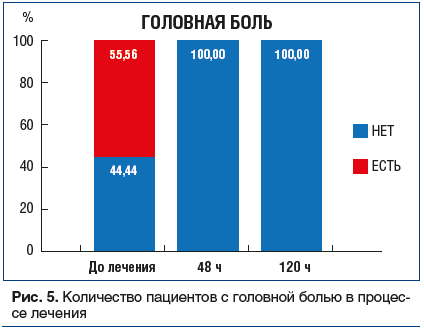
Нарушение вкуса (рис. 6): исходно у большинства пациентов наблюдалась агевзия (полное отсутствие вкуса) или гипогевзия (частичное притупление вкусовых ощущений), только у 11,11% больных данный симптом отсутствовал. На фоне лечения отмечали прогрессирующее восстановление способности различать вкус пищи, и на 10-й день у всех пациентов нарушения восприятия вкуса пищи отсутствовали.
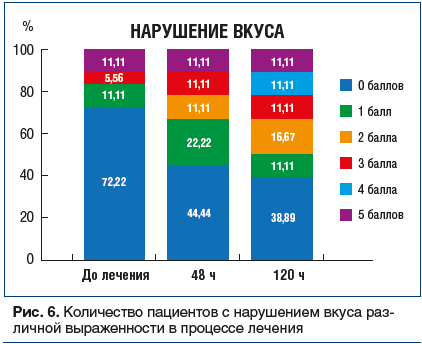
Нарушение обоняния (рис. 7): исходно аносмия (полное отсутствие обоняния) или гипосмия (частичное притупление обоняния) наблюдались у большинства пациентов. На фоне лечения отмечали прогрессирующее восстановление обоняния, и на 10-й день оно полностью восстановилось у 95% больных.
Результаты, полученные в контрольной группе приема ЛЛФ, были сопоставимы с результатами в основной группе.
Анализ этих результатов показал, что пероральный прием ЛЛФ и ЛЛФ + ЛЦ обеспечивает быстрое выздоровление у 100% пациентов в течение первых 4–5 дней. Такое же лечение, но в более низких дозах, по-видимому, оказывает потенциальное профилактическое действие в отношении COVID-19 у здоровых людей, непосредственно связанных с пациентами.
Важно отметить, что сочетание перорального и местного лечения обеспечило значимое облегчение головной боли и сухого кашля. У некоторых из этих пациентов наблюдалась заложенность носовых пазух. Пищевые добавки ЛЛФ и ЛЦ поддерживали и усиливали реакцию иммунной системы благодаря своим антиоксидантным, антибактериальным и противовирусным свойствам.
Обсуждение
Нарушения обоняния и вкусового восприятия преобладали в описанных случаях и возникали очень рано, отражая массивное проникновение вирусных частиц в слизистую оболочку полости рта и носоглотки. Эти симптомы были также описаны при ТОРС [19, 21, 24]. АПФ2, который является основным рецептором для COVID-19, в значительной степени экспрессируется в эпителии слизистой оболочки полости носа, ротовой полости, в эпителии корня языка, а также в глотке (вирус обладает значительной тропностью к данным тканям) [25]. Эти изменения могут рассматриваться как временное нарушение обоняния и вкусового восприятия и требуют дальнейшего наблюдения и изучения [19, 22, 26]. В данном исследовании у 28% пациентов наблюдалось затрудненное дыхание. В этих случаях пациенты применяли с помощью ингалятора липосомальный ЛФ в форме аэрозоля 4 р./сут. Ингаляции переносились хорошо. ЛФ является естественным компонентом бронхиальной слизи. Терапия липосомами в форме аэрозоля применяется в течение ряда лет и характеризуется удовлетворительным профилем безопасности [27–29]. Она использовалась в комбинации с рибавирином при инфекции, вызванной респираторно-синцитиальным вирусом [30], и риновирусных инфекциях [29]. ЛФ является гидрофильным химическим веществом, которое благодаря своей инкапсуляции в фосфатидилхолиновые липосомы проявляет амфифильные свойства. ЛФ достигает достаточно высоких концентраций в ткани легких и обеспечивает отсроченное высвобождение ЛФ. Нанолипосома ЛФ имеет размер 100 нм, но при распылении в дыхательных путях ее размер уменьшается до 50 нм благодаря фильтру на отверстии изделия. Липосомы способны взаимодействовать с сурфактантом, а фосфатидилхолин (ФХ) может также оказывать выраженное противовоспалительное действие [17, 31, 32]. При COVID-19 возможны изменения количества и качества сурфактанта за счет уменьшения содержания фосфолипидов, что может приводить к ухудшению функции легких, как это происходит при хронической обструктивной болезни легких. При нарушении выработки сурфактанта альвеолы спадаются во время спокойного дыхания, что приводит к ухудшению легочного комплаенса. ЛФ представляет собой глобулярный белок, принадлежащий к семейству трансферринов и проявляющий большое сродство к ионам железа. ЛФ является защитным белком, содержащимся в грудном молоке, где он присутствует в относительно высокой концентрации (1 г/л), особенно на стадии выработки молозива (до 7 г/л). Он также присутствует в других жидкостях организма (слезная жидкость, сперма, влагалищное отделяемое, слюна, бронхиальная слизь и т. д.). ЛФ синтезируется нейтрофилами крови и различными типами клеток, включая некоторые ацинарные клетки. Уровни эндогенного ЛФ повышаются при инфекции и воспалении. ЛФ обладает антибактериальными и противовирусными свойствами, модулирует иммунную систему и защищает от воспаления кишечника [33].
В настоящем исследовании использовали липосомальный лактоферрин (ЛЛФ), зарегистрированный в качестве пищевой добавки Lactyferrin™ (Лактиферрин). У большинства пациентов ответ на лечение наблюдался в первые 3–4 дня приема препарата Lactyferrin™ (Лактиферрин), хотя рекомендованная продолжительность лечения составляла 10 дней. Лица, контактировавшие с пациентами, также получали половину лечебной дозы, что препятствовало развитию у них заболевания. Пищевая добавка на основе липосомального бычьего ЛФ, Lactyferrin™ Forte (Лактиферрин Форте) питьевой («Сесдерма Лабораториз» (Sesderma Laboratories), Валенсия, Испания), зарегистрирована в Европейском союзе (Ирландия), а также одобрена к применению Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (U.S. Food and Drug Administration (FDA)) в качестве пищевой добавки. Европейское агентство по безопасности продуктов питания (European Food Safety Authority) признает, что бычий ЛФ является пищевой добавкой с лекарственными свойствами и классифицируется как новый безопасный («в целом признанный безопасным») продукт питания, не имеющий противопоказаний. Суммарная доза неинкапсулированного ЛФ для взрослых колеблется от 1,4 до 3,4 г. Нами были разработаны липосомы на основе ФХ, который является биосовместимым и биоразлагаемым химическим веществом [17, 20, 31, 34]. ЛФ в свободном виде разлагается в желудке под действием соляной кислоты и гидролитических ферментов (протеазы, пепсин); следовательно, биодоступность свободной формы очень ограничена. Таким образом, в применяемой нами биодобавке ЛФ и витамин C инкапсулированы в липидный пузырь размером 100 нм или нанолипосому, изготовленную из соевого ФХ. Нанолипосома защищает ЛФ от разрушения пищеварительными ферментами и позволяет неповрежденному белку проходить через двенадцатиперстную кишку и попадать в системное кровообращение, где его биодоступность очень высока [17, 31, 34]. Инкапсулированный ЛФ таким образом защищен от пепсина и гидролиза протеазами. Также важно отметить, что свободный ЛФ быстро выводится из системного кровотока, что ограничивает его терапевтический потенциал. Следовательно, его инкапсулирование в липосомы необходимо для увеличения стабильности в плазме крови. ФХ, используемый для изготовления липосом, — повсеместно распространенная молекула фосфолипидов естественного происхождения, которая является основным липидом в клеточных мембранах и белках крови. Кроме того, ФХ служит основным физиологическим источником холина, основного питательного вещества и предшественника нейромедиатора ацетилхолина. ФХ также необходим для производства поверхностно-активных веществ, которые имеют критическое значение для функции легких и желудочно-кишечного тракта. Термины «фосфатидилхолин» и «лецитин» иногда используются взаимозаменяемо; однако лецитин представляет собой смесь нескольких липидов и фосфолипидов. ФХ необходим для образования и восстановления клеточных мембран и жизненно необходим для нормальной функции печени. ЛФ способен оказывать антибактериальное, противогрибковое и противовирусное действие в отношении ряда микроорганизмов [18, 35–37], что становится возможным благодаря механизмам действия, включающим не только способность ЛФ связывать железо, но также взаимодействовать с различными молекулярными и клеточными компонентами. Антибактериальная активность ЛФ реализуется за счет создания дефицита железа, которое необходимо для роста бактерий, в то время как его противовирусная активность [37–39] связана с конкуренцией за рецепторы клеточной мембраны, которые обычно используются вирусами для проникновения в клетки. В частности, ЛФ блокирует АПФ2 и предотвращает связывание шиповидного белка S вируса с клеткой-хозяином, предотвращая слияние вируса с клеточной мембраной [8–12]. Липосомальный ЛФ также может подавлять репликацию вируса иммунодефицита человека (ВИЧ) после проникновения в клетку [18, 37]. Кроме того, у некоторых пациентов с ВИЧ-1 наблюдается снижение уровня ЛФ в плазме крови, а у других недостаток ЛФ (и секреторного IgA) в полости рта, что значительно коррелирует с частыми инфекционными осложнениями [38]. Польза нанолипосом также связана с их размером и составом (ФХ); их размер (100 нм) меньше размера вируса (150 нм), они могут конкурировать с вирусом в связывании с клеточными рецепторами. ЛФ обладает иммуномодулирующими и противовоспалительными свойствами [32, 40]. Кроме того, ЛФ играет иммуномодулирующую роль в поддержании иммунного и физиологического гомеостаза и ограничении повреждения тканей путем модуляции цитокинов, хемокинов и рецепторов клеточной поверхности, участвующих в сигнальных каскадах [41–46].
Многие пациенты старше 70 лет имеют дефицит цинка, что может способствовать тяжести инфекции. Цинк гидрофилен и плохо всасывается через желудочно-кишечный тракт. Цинк обладает противовирусным действием [30, 33, 47–49], может влиять на металлопротеазы, участвующие в процессе слияния коронавируса, уменьшая как проникновение в клетки, так и слияние клеток. ЛФ можно использовать в качестве монотерапии или в комбинации с цинком. Обе добавки нетоксичны и могут использоваться в качестве вспомогательных средств наряду с обычными противовирусными препаратами или гидроксихлорохином [24]. Препараты, применявшиеся в данном исследовании, обладают благоприятным профилем безопасности. В настоящее время изучаются эффективность и безопасность применения гидроксихлорохина и азитромицина для лечения COVID-19 [50–52], и хотя клинические исследования не завершены, установлено, что гидроксихлорохин может вызывать широкий спектр побочных эффектов (со стороны сердечно-сосудистой системы, кожи и ее придатков, желудочно-кишечного тракта, системы крови, гепатобилиарной системы и т. д.). Азитромицин [52], как и гидроксихлорохин, обладает потенциальной способностью удлинять интервал QT, что может привести к развитию фатальных нарушений ритма сердца [52].
Перевод выполнен по материалам статьи Serrano G., Kochergina I., Albors A. et al. Liposomal Lactoferrin as Potential Preventative and Cure for COVID-19. Int J Res Health Sci. 2020;8(1):8–15. URL: http://ijrhs.org/article/2020/8/1/105530ijrhs813.
Конфликт интересов
А. Альборс является сотрудником медицинского отдела компании и «Сесдерма Лабораториз» (Sesderma Laboratories), Валенсия, Испания, Е. Диаз, М. Ороваль, Г. Уэсо, Х.М. Серрано являются сотрудниками научно-исследовательского отдела компании «Сесдерма Лабораториз» (Sesderma Laboratories), Валенсия, Испания.
Благодарность
Редакция журнала выражает благодарность компании Sesderma за помощь в переводе и адаптации текста данной статьи.
.
Информация с rmj.ru






