Содержание статьи
- 1 Введение
- 2 Может ли назначение антибиотиков при острых респираторных заболеваниях (ОРЗ) предотвратить развитие бактериальных осложнений?
- 3 Влияет ли антибиотикорезистентность респираторных патогенов на выбор препарата для лечения ИДП в амбулаторной практике?
- 4 Нужно ли исключить макролиды из использования в педиатрической практике в связи с распространением макролидорезистентных штаммов пневмококка?
- 5 Что лучше назначить — амоксициллин или амоксициллин/клавуланат?
- 6 Нужны ли в России высокие дозы амоксициллина или амоксициллина/клавуланата?
- 7 Эффективны ли пероральные цефалоспорины III поколения (в частности, цефиксим) в качестве препаратов для эмпирической терапии ИДП у детей?
- 8 Какова оптимальная длительность антибактериальной терапии ИДП у детей?
- 9 Заключение
Введение
Каждый ребенок переносит 3–8 эпизодов инфекции дыхательных путей (ИДП) за год, большинство из них имеют вирусную этиологию [1]. Только 6–8% всех ИДП у детей обусловлены бактериальными возбудителями и требуют назначения антибактериальной терапии (АБТ) [2]. В то же время нельзя оставить без внимания значимость бактериальных ИДП. Например, согласно результатам исследования PAPIRUS (Prospective Assessment of Pneumococcal Infection in Russia), заболеваемость пневмонией в Российской Федерации составляет чуть более 530 случаев на 100 000 детей до 5 лет [3]. В США ежегодная частота пневмонии составляет 157 случаев на 100 000 детей, наибольшая частота наблюдается у детей до 2 лет (622 случая на 100 000) [4]. Огромное количество публикаций (и российских, и зарубежных) ежегодно посвящается профилактике и лечению ИДП в педиатрии, но интерес врачей к данной проблеме с каждым годом не уменьшается, а лишь увеличивается. Практика ставит перед врачами вопросы, на которые не всегда можно найти однозначные ответы. Некоторым из этих вопросов посвящена данная публикация.
Может ли назначение антибиотиков при острых респираторных заболеваниях (ОРЗ) предотвратить развитие бактериальных осложнений?
Ответ на данный вопрос присутствует в целом ряде систематических обзоров, метаанализов, ретроспективных и проспективных исследований, которые продемонстрировали, что профилактическое назначение антибиотиков при ОРЗ не предотвращает развитие бактериальных осложнений. Так, в Кохрейновском метаанализе (2013) был установлен положительный эффект от применения антибактериальных препаратов (АБП) при тонзиллите и фарингите, а именно уменьшение длительности симптомов в среднем на 16 ч, но это в основном было обусловлено включением в метаанализ исследований, в которых АБП назначались при тонзиллофарингите, вызванном Streptococcus pyogenes [5]. Авторы отмечают, что польза от назначения АБП при тонзиллите и фарингите весьма скромная [5].
Что касается острого среднего отита (ОСО), то очень наглядными являются результаты ретроспективного когортного исследования, проведенного в Великобритании в 1990–2006 гг. [6]. В ходе данного исследования была проанализирована база данных General Practice Research Database с общим числом детей 2 622 348 (854 ребенка с мастоидитом, из них только у 1/3 была клиника ОСО). Как оказалось, при ОСО отмечается положительный эффект от назначения АБП, однако количество пациентов с ОСО, которых надо пролечить для предотвращения 1 случая мастоидита (number needed to treat, NNT), составляет 4831 [6]. Если бы АБП вообще не назначались при ОСО, то дополнительно возникло бы 255 случаев мастоидита, но при этом в Великобритании в год стало бы на 738 775 назначений АБП меньше [6].
В ходе еще одного ретроспективного когортного исследования, проведенного в Великобритании, были проанализированы сведения о 3,36 млн эпизодов ИДП у детей и взрослых, также полученные из базы данных General Practice Research Database [7]. Как оказалось, после инфекций верхних дыхательных путей, тонзиллита, фарингита и ОСО серьезные осложнения возникают редко, но незначительная польза от назначения АБП присутствует, при этом показатель NNT составляет >4000 [7]. На основании полученных результатов был сделан вывод о том, что профилактическое назначение АБП для снижения риска возникновения серьезных осложнений инфекций верхних дыхательных путей нецелесообразно [7].
Кохрейновский метаанализ результатов 11 рандомизированных контролируемых исследований, в котором проводилось сравнение АБТ с плацебо при лечении пациентов с симптомами острой инфекции верхних дыхательных путей продолжительностью до 7 дней или острого гнойного ринита продолжительностью до 10 дней, не продемонстрировал пользу от назначения АБП при простудных заболеваниях. Кроме того, в группе АБТ по сравнению с группой плацебо была выше частота нежелательных явлений [8].
Еще в одном Кохрейновском метаанализе (2017 г., 17 исследований, 5099 участников) было установлено, что имеются ограниченные данные о клинической пользе применения АБП при остром бронхите (сокращение выраженности и длительности кашля, продолжительности заболевания на 0,64 дня и периода нарушенной повседневной активности на 0,49 дня), однако преимущества от назначения АБТ необходимо рассматривать в более широком контексте потенциальных нежелательных лекарственных реакций, чрезмерного применения лекарственных средств для лечения состояний, которые пройдут и без лечения, а также роста антибиотикорезистентности (АБР) респираторных патогенов и удорожания стоимости лечения [9].
Более того, результаты нескольких исследований продемонстрировали, что профилактическое назначение АБП при ОРЗ повышает риск бактериальной инфекции [10–13]. Респираторный тракт здорового человека содержит более 140 различных геномов микроорганизмов, бронхиальное дерево содержит в среднем 2000 бактериальных геномов на 1 см2 поверхности, а возникающий дисбиоз респираторного тракта, желудочно-кишечного тракта (ЖКТ) и кожи на фоне АБТ способствует клиническому развитию патогенной бактериальной инфекции, а также аллергической предрасположенности [10, 13].
Влияет ли антибиотикорезистентность респираторных патогенов на выбор препарата для лечения ИДП в амбулаторной практике?
Несомненно, клиницисту необходимо иметь четкие представления о резистентности наиболее частых бактериальных возбудителей ИДП, а именно Streptococcus pneumoniae, S. pyogenes и Haemophilus influenzae. Наиболее информативным источником данных по АБР различных бактериальных патогенов в РФ является online «Карта антибиотикорезистентности России» — AMRmap (доступна по ссылке www.map.antibiotic.ru), которая разработана совместно НИИ антимикробной химиотерапии и Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии [14]. Далее будет представлена информация по АБР респираторных патогенов в РФ за период с 2013 по 2018 г. по данным анализа AMRmap, а также по другим публикациям по данной проблематике за указанный период времени.
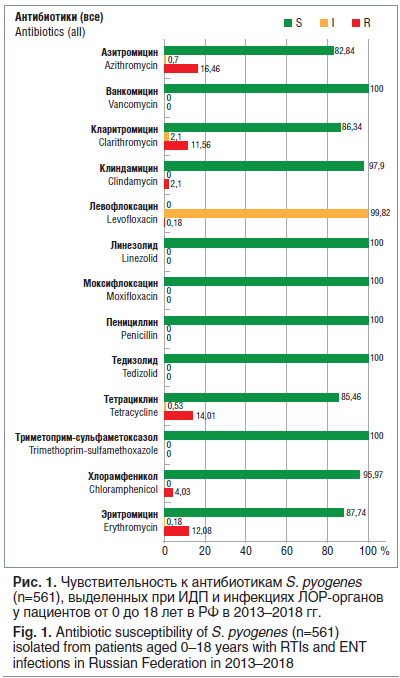
С 2013 по 2018 г. в НИИ антимикробной химиотерапии был собран и протестирован 561 штамм S. pyogenes, выделенный при ИДП и инфекциях ЛОР-органов у пациентов в возрасте от 0 до 18 лет (рис. 1). Все изоляты β-гемолитического стрептококка серогруппы А (БГСА) сохраняли универсальную чувствительность ко всем β-лактамным антибиотикам, а также к ванкомицину и линезолиду. Наибольший уровень устойчивости отмечен к препаратам тетрациклинового ряда (около 14% нечувствительных штаммов) и к макролидам (около 12% штаммов, нечувствительных к эритромицину).
По данным AMRmap, за указанный период среди протестированных 242 изолятов H. influenzae резистентными к ампициллину были 12,8% штаммов. В то же время, по результатам международного исследования SOAR (Survey of Antibiotic Resistance), в котором были изучены 279 штаммов гемофильной палочки, выделенных в РФ в 2014–2016 гг., нечувствительными к амоксициллину оказались 19% изолятов, при этом продукция β-лактамаз была обнаружена у 15,4% штаммов [15]. Амоксициллин/клавуланат сохранял активность против более чем 97,5% изолятов H. influenzae.
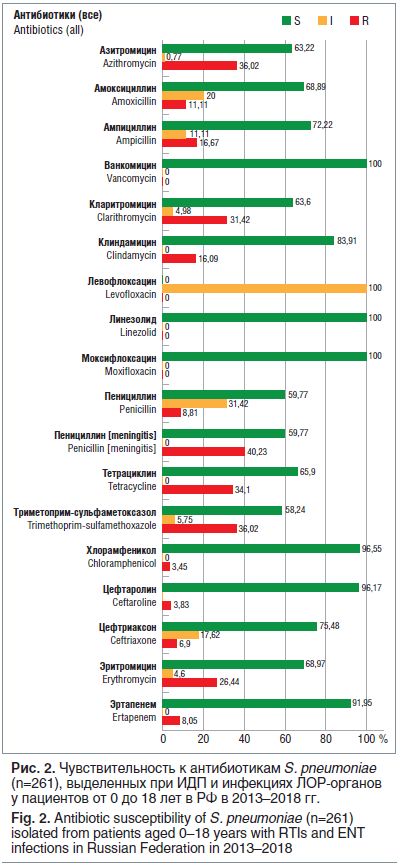
AMRmap также позволяет изучать динамику АБР различных возбудителей. При анализе чувствительности к АБП пневмококков, выделенных в педиатрической популяции пациентов в 2013–2018 гг., отмечены существенные изменения в АБР по сравнению с более ранними периодами времени.
Так, заметно выросли показатели устойчивости S. pneumoniae к пенициллину: в среднем по России частота умеренно резистентных штаммов составляет более 30%, а резистентных — почти 9%. Распространение пенициллинорезистентных пневмококков сопровождается увеличением числа изолятов, нечувствительных к парентеральным цефалоспоринам III поколения (цефтриаксону), — 17,6% умеренно резистентных и 6,9% резистентных изолятов. Частота резистентности к макролидам по РФ превысила 30% (рис. 2).
Нужно ли исключить макролиды из использования в педиатрической практике в связи с распространением макролидорезистентных штаммов пневмококка?
Несомненно, нельзя игнорировать появившиеся в последние 5 лет тревожные тенденции, в частности рост резистентности пневмококков к макролидам (около 30% в педиатрической популяции пациентов). В связи с этим макролиды потеряли позиции стартовых препаратов при эмпирической терапии ИДП и инфекций ЛОР-органов у детей.
Макролиды не рассматриваются в Европейских рекомендациях по риносинуситу 2012 г. (European position paper on rhinosinusitis and nasal polyps, EPOS) и Руководстве по ведению взрослых и детей с острым бактериальным риносинуситом 2012 г., разработанных Американским обществом по инфекционным болезням (The Infectious Diseases Society of America, IDSA), как препараты для эмпирической АБТ риносинусита, что ранее уже обсуждалось в российских публикациях [16, 17].
Тем не менее нельзя полностью исключить целый класс АБП из клинического использования. В Испании уровень нечувствительности S. pneumoniae составляет 25–30%, однако макролиды (азитромицин или кларитромицин) присутствуют в практических рекомендациях по терапии бактериального синусита при аллергии на β-лактамы [18]. В Канаде аналогичная ситуация: при уровне нечувствительности к макролидам, равном 19–23%, азитромицин и кларитромицин остаются в рекомендациях по терапии риносинусита при непереносимости β-лактамных антибиотиков [19].
В Италии уровень резистентности S. pyogenes к макролидам составлял в 2000 г. 38,6%, в 2012–2013 гг. — 7,4%, S. pneumoniae — 25%, при этом макролиды используются при БГСА-тонзиллофарингите и ОСО в качестве альтернативных препаратов при аллергии на β-лактамы (кларитромицин или азитромицин). А что касается внебольничной пневмонии, то у детей 1–3 мес. и 5–18 лет кларитромицин и азитромицин рассматриваются как препараты выбора наряду с аминопенициллинами [20].
Примером аналогичного подхода к использованию макролидов являются российские клинические рекомендации Национальной медицинской ассоциации оториноларингологов «Острый синусит», где указано, что макролиды (азитромицин, кларитромицин, джозамицин) следует применять при остром синусите у детей в случае аллергии на β-лактамы [21]. Конечно же, о макролидах следует помнить и в случаях, когда ИДП (в первую очередь внебольничная пневмония) вызваны атипичными патогенами (Mycoplasma pneumoniae, Chlamydophila pneumoniae).
Что лучше назначить — амоксициллин или амоксициллин/клавуланат?
При ответе на этот вопрос нужно принимать во внимание как частоту нечувствительности H. influenzae к ампициллину (12,8%, а по данным исследования SOAR — 19% изолятов, большинство из них продуцировали β-лактамазы), так и индивидуальные факторы риска наличия резистентной флоры у педиатрических пациентов [22]:
прием антибиотиков в течение предшествующих 3 мес.;
госпитализация в течение предшествующих 3 мес.;
лечение в дневных стационарах поликлиник;
посещение детских дошкольных учреждений;
контакт с детьми, посещающими детские дошкольные учреждения;
иммуносупрессивные заболевания/состояния;
хронические заболевания органов дыхания (бронхиальная астма);
сахарный диабет;
недавние путешествия.
При лечении респираторных инфекций у пациентов с перечисленными факторами риска незащищенные пенициллины могут оказаться неэффективными, поэтому выбор стартовой терапии решается в пользу назначения препарата с более широким микробиологическим спектром и терапевтическими возможностями — амоксициллина/клавуланата [22].
В целом в РФ в настоящее время амоксициллин в качестве стартовой терапии остается приоритетным в случаях нетяжелого течения инфекции, когда отсутствуют факторы риска инфекции, вызванной антибиотикорезистентными возбудителями. При наличии факторов риска инфекции, вызванной антибиотикорезистентными возбудителями, а также при неэффективности стартовой АБТ следует рассмотреть назначение амоксициллина/клавуланата [22].
Нужны ли в России высокие дозы амоксициллина или амоксициллина/клавуланата?
На этот вопрос в настоящий момент нет однозначного ответа. С одной стороны, рост АБР и распространение умеренно резистентных (>30%) и резистентных (9%) к пенициллину штаммов S. pneumoniae заставляет задуматься о целесообразности назначения амоксициллина или амоксициллина/клавуланата в высоких дозах (90 мг/кг/сут по амоксициллину). С другой стороны, исследований, в которых бы проводилось прямое сопоставление эффективности и безопасности стандартных и высоких доз амоксициллина/клавуланата, почти нет.
В рандомизированном контролируемом исследовании сравнивались стандартные (45 мг/кг/сут) и высокие (90 мг/кг/сут) дозы амоксициллина в течение 3 дней у 876 детей в возрасте от 2 мес. до 5 лет с внебольничной пневмонией: частота неэффективности терапии составила 5,9% и 7,9% соответственно [23]. Авторы исследования заключают, что клинические исходы у детей с нетяжелой пневмонией не различаются при применении стандартной и высокой дозы амоксициллина [23].
В 2018 г. было опубликовано двойное слепое рандомизированное исследование, проведенное в США в период с ноября 2014 г. по февраль 2017 г. с участием 315 амбулаторных взрослых пациентов с острым синуситом, в котором сравнивались стандартная и высокая дозы амоксициллина/клавуланата [24]. В связи с тем, что на половине исследования стала недоступной оригинальная высокодозная форма амоксициллина/клавуланата (2000/125 мг), во 2-м периоде исследования стали использовать обычный амоксициллин в дозе 1750 мг в сочетании с 250 мг клавулановой кислоты. Как оказалось, у взрослых пациентов с острым бактериальным синуситом не отмечено различий в улучшении к 3-му дню и излечении к 10-му дню между 1-м и 2-м периодами лечения (табл. 1). Отмечалось лишь несколько более быстрое улучшение при применении высоких доз амоксициллина во 2-м периоде лечения, однако это не повлияло на исходы терапии. При этом частота нежелательных явлений (прежде всего, со стороны ЖКТ) была выше в группе высоких доз, хотя различия не достигли статистической значимости. Частота же тяжелой диареи составила 15,8% во 2-м периоде исследования в группе использования высоких доз амоксициллина/клавуланата и 4,8% в группе использования стандартной дозы (р=0,048).
![Таблица 1. Сравнение стандартных и высоких доз амоксициллина/клавуланата у взрослых пациентов с острым синуси- том [24] Table 1. Comparison of standard and high doses of amoxicillin/clavulanate in adult patients with acute sinusitis [24] Таблица 1. Сравнение стандартных и высоких доз амоксициллина/клавуланата у взрослых пациентов с острым синуси- том [24] Table 1. Comparison of standard and high doses of amoxicillin/clavulanate in adult patients with acute sinusitis [24]](https://medblog.su/wp-content/uploads/2020/07/1594412064_381_infektsii-dyhatelnyh-putej-v-pediatricheskoj-praktike-slozhnye-otvety-na-prostye-voprosy-andreeva-i-v-stetsyuk-o-u-egorova-o-a.png)
При анализе прогнозируемой эффективности АБП в отношении пневмококка и гемофильной палочки на основании фармакокинетических и фармакодинамических параметров были установлены незначительные различия между стандартной и высокодозной терапией амоксициллином/клавуланатом, но в то же время выявлено явное преимущество амоксициллина/клавуланата перед амоксициллином в отношении H. influenzae (табл. 2) [15].
![Таблица 2. Прогнозируемая эффективность антибиотиков в отношении S. pneumoniae и H. influenzae на основании фар- макокинетических и фармакодинамических параметров [15] Table 2. Predictable efficacy of antibiotics against S. pneumoniae and H. influenzае ba Таблица 2. Прогнозируемая эффективность антибиотиков в отношении S. pneumoniae и H. influenzae на основании фар- макокинетических и фармакодинамических параметров [15] Table 2. Predictable efficacy of antibiotics against S. pneumoniae and H. influenzае ba](https://medblog.su/wp-content/uploads/2020/07/1594412064_486_infektsii-dyhatelnyh-putej-v-pediatricheskoj-praktike-slozhnye-otvety-na-prostye-voprosy-andreeva-i-v-stetsyuk-o-u-egorova-o-a.png)
Эффективны ли пероральные цефалоспорины III поколения (в частности, цефиксим)
в качестве препаратов для эмпирической терапии ИДП у детей?
Когда речь идет о пероральных цефалоспоринах III поколения (цефиксиме, цефтибутене), то в первую очередь нужно помнить, что эти препараты не эквивалентны по активности в отношении основного респираторного патогена S. pneumoniae и по эффективности при бактериальных ИДП парентеральным цефалоспоринам III поколения (цефтриаксону и цефотаксиму).
В международном исследовании Alexander Project, в котором приняли участие 26 стран и было протестировано 8882 штамма пневмококка, резистентность пневмококка к цефиксиму составила 30,8% [25]. В соответствии с позицией ВОЗ цефиксим относится к группе watch (бдительность, наблюдение), т. е. к антибиотикам, которые рекомендуются в качестве препаратов для терапии только небольшого перечня инфекций. Цефиксим не рекомендован ВОЗ для лечения респираторных инфекций у детей, а единственным показанием к его применению в «Примерном перечне основных лекарственных средств» указаны острая инвазивная бактериальная диарея и дизентерия (препарат 2-го ряда) [26]. Тем не менее при тестировании педиатров [27] на вопрос: «Какие β-лактамы сохраняют активность в отношении пенициллинорезистентных штаммов S. pneumoniae?» — более 30% врачей указали цефиксим и около 15% — цефтибутен, что совершенно не соответствует действительности. Применение цефиксима как препарата этиотропной терапии возможно только в случаях установленной (по данным бактериологического исследования) роли H. influenzae в качестве единственного этиологического агента ИДП при непереносимости или предшествующей неэффективности препаратов выбора (1-го ряда). Применение же пероральных цефалоспоринов III поколения в качестве препаратов стартовой эмпирической терапии респираторных инфекций абсолютно нецелесообразно.
Какова оптимальная длительность антибактериальной терапии ИДП у детей?
Существуют заболевания, при которых четко оговорена продолжительность АБТ. Так, при стрептококковом тонзиллофарингите длительность применения составляет 10 дней для всех АБП, кроме азитромицина и бензатина бензилпенициллина [1, 28, 29]. При других ИДП и инфекциях ЛОР-органов продолжительность АБТ устанавливается на основании клинической и параклинической динамики. Уже более 10 лет отмечается общая тенденция к сокращению длительности АБТ очень многих нозологических форм инфекционных заболеваний, в т. ч. бактериальных ИДП.
На сегодняшний момент существуют публикации, демонстрирующие эквивалентную эффективность стандартных и коротких курсов АБТ даже такого серьезного заболевания у детей, как внебольничная пневмония.
Так, согласно результатам рандомизированного контролируемого исследования с участием 2188 детей в возрасте от 2 мес. до 5 лет с нетяжелым течением внебольничной пневмонии применение амоксициллина в течение 3 дней было сопоставимым по клинической эффективности с его 5-дневным курсом (89,5% и 89,9% соответственно), а приверженность родителей назначенной АБТ составила 94% и 85% соответственно [30].
В опубликованном в 2011 г. обзоре приведены результаты 4 исследований, выполненных в развивающихся странах с участием детей в возрасте от 2 мес. до 5 лет с диагностированной в соответствии с критериями ВОЗ нетяжелой внебольничной пневмонией. Как оказалось, не было выявлено статистически достоверных различий между 3-дневным и 5-дневным курсами АБТ по клинической неэффективности или частоте возникновения рецидивов [31].
В Кохрейновском систематическом обзоре было показано, что у детей в возрасте от 2 мес. до 5 лет с нетяжелой пневмонией 3-дневный курс АБТ не уступает по эффективности более длительному курсу лечения [32].
Эксперты Российского респираторного общества, Американского общества по инфекционным болезням (Infectious Diseases Society of America, IDSA) и Американского торакального общества (American Thoracic Society, ATS) полагают, что продолжительность АБТ при внебольничной пневмонии должна составлять не менее 5 дней [33].
Вряд ли большинство педиатров решатся лечить ребенка с нетяжелой внебольничной пневмонией 5 дней. Тем не менее, учитывая возрастающую проблему распространения АБР, нужно помнить о том, что чрезмерно длительное назначение антибиотиков также является фактором риска формирования АБР у патогенов. Как правило, при нормализации температуры тела и положительной клинической и параклинической динамике (результаты инструментальных исследований, лабораторных методов диагностики) на 2–3 сут терапии будет достаточно продолжить АБТ еще в течение 3–4 сут, при этом общая продолжительность назначения АБП составит в среднем 6–8 сут.
Заключение
В данной публикации мы попытались аргументированно ответить на частые и весьма непростые вопросы, возникающие у клиницистов. Хочется надеяться, что эта статья поможет педиатрам грамотно и обоснованно выбирать тактику АБТ при бактериальных ИДП.
Сведения об авторах:
Андреева Ирина Вениаминовна — к.м.н., доцент, старший научный сотрудник НИИ антимикробной химиотерапии, ORCID iD 0000-0001-7916-1488;
Стецюк Ольга Ульяновна — к.м.н., старший научный сотрудник НИИ антимикробной химиотерапии, ORCID iD 0000-0002-7316-9187;
Егорова Ольга Анатольевна — к.м.н., доцент кафедры оториноларингологии, ORCID iD 0000-0002-6316-6046.
ФГБОУ ВО СГМУ Минздрава России. 214019, г. Смоленск, ул. Крупской, д. 28.
Контактная информация: Андреева Ирина Вениаминовна, e-mail: irina.andreeva@antibiotic.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 19.04.2020.
About the authors:
Irina V. Andreeva — MD, PhD, Associate Professor, Senior Research Fellow of the Institute of Antimicrobial Chemotherapy, ORCID iD 0000-0001-7916-1488;
Olga U. Stetsyuk — MD, PhD, Senior Research Fellow of the Institute of Antimicrobial Chemotherapy, ORCID iD 0000-0002-7316-9187;
Olga A. Egorova — MD, PhD, Associate Professor of the Department of ENT Diseases, ORCID iD 0000-0002-6316-6046.
Smolensk State Medical University. 28, Krupskaya str., Smolensk, 214019, Russian Federation.
Contact information: Irina V. Andreeva, e-mail: irina.andreeva@antibiotic.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 19.04.2020.
.
Информация с rmj.ru