Коэнзимное ацетилирование и уровень свободных жирных кислот крови у детей с ацетонемией и билиарной недостаточностью
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
ГБОУ ВПО СЗГМУ им. И. И. Мечникова Минздравсоцразвития России, Санкт-Петербург
Ацетонемические состояния наблюдаются у детей с заболеваниями органов пищеварения, нервно-артритическим диатезом, инфекционными заболеваниями и в стрессовых ситуациях. Провоцируют ацетонемию физические и психические перегрузки, диетические погрешности и различные ситуации, сопровождающиеся избыточными энергетическими расходами в организме. Основным звеном метаболических сдвигов при ацетонемических состояниях является нарушение гликолиза и липолиза, неполное окисление жировых кислот [1], накопление кетоновых тел, развитие эндогенной интоксикации, сопровождающейся приступами неукротимой рвоты [2, 3].
Ключевой механизм, обусловливающий развитие ацетонемии, связан с дефицитом фермента коэнзимного ацетилирования [3]. Процессы ацетилирования занимают центральное место в межклеточном обмене веществ и наиболее интенсивно протекают в печени. Путем ацетилирования осуществляется окислительное декарбоксилирование пировиноградной кислоты, синтез и распад жиров, синтез ацетилхолина, стероидов и др. При исключении из диеты пантотеновой кислоты происходит уменьшение содержания кофермента А (КоА) в тканях [4]. Активность КоА определяется также наличием в его структуре сульфгидрильных (SH) групп. Среди активаторов фермента КоА большое значение имеют соединения, содержащие SH-группы [1]. Среди тиоловых соединений в клинической практике наиболее известен Унитиол, который эффективно используется при тяжелых интоксикациях [5]. Расположение SH-групп в структуре Унитиола (2,3?димеркаптопропансульфата натрия) таково, что они могут активно вступать в метаболические процессы. По мнению А. Лабори [6], тиоловые соединения вызывают метаболическую реанимацию в связи с присутствием в их структуре SH-групп. Эффективны тиоловые группы в препарате Липоевая кислота (Липамид). Это позволило применить препараты, содержащие сульфгидрильные группы с целью активации КоА [6].
Цель исследования. Изучить активность коэнзимного ацетилирования и показатели уровня свободных жирных кислот (СЖК) в крови у детей с рецидивирующими приступами ацетонемических рвот при гастродуоденобилиарной патологии. Оценить влияние тиолсодержащих и энерготропных препаратов на активность КоА, разработать протекторную терапию для профилактики ацетонемических метаболических кризов.
Материал и методы. Под наблюдением находилось 65 пациентов в возрасте от 3 до 10 лет с заболеваниями органов пищеварения. В комплекс обследования включались оценка клинико-анамнестических данных, анализы клинического минимума, УЗИ органов брюшной полости, фиброгастродуоденоскопия с проведением хелпил-теста, гастроимпедансометрия, биохимические исследования крови: протеинограмма, сахар, холестерин (традиционными методами), уровень свободных жирных кислот (СЖК) — колорометрическим методом Duncombe [7]. Определение активности КоА проводилось по методу Л. Н. Буловской [4]. Качественным методом (тест-полоски) проводилось определение ацетона в моче.
Результаты. Основной жалобой у больных при поступлении в стационар были приступы тошноты, слабости, рвоты от 3 до 8 раз в сутки с последующим появлением запаха ацетона изо рта и ацетонурии. Рецидивы ацетонемических рвот у детей приводили к ухудшению у них трофического статуса и нарушению иммунологической резистентности организма. Возникала подверженность детей вирусным инфекциям, на фоне которых ацетонемия была их постоянным спутником, развивался причинно-следственный порочный круг.
В результате проведенного обследования у 22 детей был выявлен поверхностный антральный гастрит, у 18 детей — поверхностный распространенный гастрит и у 25 пациентов — поверхностный гастродуоденит с узелковой гиперплазией в антральном отделе желудка. Хелпил-тест у обследованных детей был отрицательным. Показатели гастроимпедансометрии подтвердили диагнозы хронического гастрита и хронического гастродуоденита (ХГД) у детей. У 30 пациентов кислотообразующая функция желудка была повышенной, у 35 больных — резко повышенной. У всех обследованных детей по данным УЗИ была выявлена сопутствующая дискинезия желчевыводящих путей (ДЖВП), гипертонический тип, из них у 35 детей (53,8%) были осадочные образования в желчи (явления холестаза), у 30 детей — желчь не имела осадочных образований.
Биохимические исследования крови выявили разной степени выраженности диспротеинемию, дислипидемию и тенденцию к гипогликемии. Активность КоА и уровень СЖК в крови у обследованных детей на фоне ацетонемии представлены в табл. 1. Ацетонурия у всех обследованных детей была резко выраженной (ацетон мочи был на ++ или +++).
Активность КоА у детей до начала лечения на фоне ацетонемии была резко сниженной, наиболее значимо у пациентов с сопутствующей ДЖВП с осадочными образованиями в желчи, составив только 25% от возрастного норматива (р2-3 < 0,001), у пациентов с сопутствующей ДЖВП без осадочных образований в желчи активность КоА оказалась ниже возрастного норматива на 57% (р1-3 < 0,01). Уровень СЖК в крови имел противоположную направленность: у детей с сопутствующей ДЖВП с явлениями холестаза он превышал средневозрастную норму в 4,3 раза (р2-3 < 0,001), у пациентов без проявлений холестаза содержание СЖК в крови превышало возрастной норматив в 3,7 раза (р1-3 < 0,001). Следует отметить, что уровень СЖК у больных с проявлениями холестаза был достоверно выше, по сравнению с таковым у пациентов без осадочных образований в желчи (р1-2 < 0,01).
По поводу ацетонемии больным назначался протекторный комплекс терапии, включающий пантотенат кальция (100 мг/сутки), витамин В6 (30 мг/сутки) внутримышечно. В качестве активатора КоА применялся препарат Унитиол — донатор сульфгидрильных групп в дозе 0,1 мл 5% раствора на 1 кг массы тела внутримышечно 2 раза в день в течение 7 дней. При уменьшении частоты рвот назначался Элькар (в возрастной дозе), он увеличивает скорость окисления жиров в митохондриях клеток и уменьшает выраженность кетоацидоза [8]. С антикетогенной целью использовался витамин В12 по 500 мкг/сутки в течение 3 дней (внутримышечно). В последующие дни комплекс протекторных средств назначался детям на фоне антацидов и прокинетиков (Маалокс, Мотилиум). Симптомы эндогенной интоксикации удавалось купировать при редкой частоте рвот путем пероральной регидратации (раствор Регидрона), при частых рвотах — инфузия 5% глюкозы и изотонического раствора хлорида натрия (соотношение 1:1) в объеме 40–50 мл/кг массы тела внутривенно. Объем жидкости на сутки дополнялся введением питья минеральной воды, сладкого чая, Регидрона. После ликвидации рвот назначалась диета, богатая углеводами и белком (обезжиренный творог, мясное суфле, жидкие каши, муссы, кисель). После ликвидации ацетонемии больным назначался лечебный стол 1 (по Певзнеру).
Курс метаболической терапии в короткие сроки устранял ацетонемию и кетонурию. После 3-недельного срока протекторной терапии у больных повторно исследовали активность КоА и уровень СЖК в крови (табл. 2).
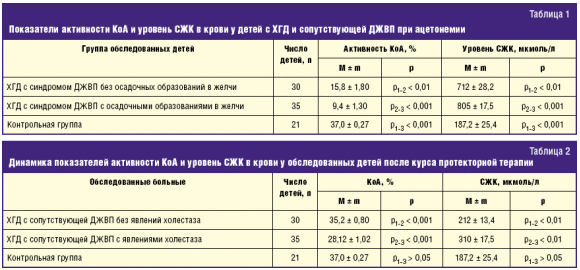
После окончания курса лечения средняя величина показателя активности КоА составила у детей без проявлений холестаза в желчи 35,2 ± 0,80% (при норме 37,0 ± 0,27), полученные значения показателей достоверно не отличались от величин норматива (р > 0,05), в то время как этот же показатель у больных с проявлениями холестаза увеличивался в 3 раза по сравнению с исходным значением, однако средняя величина активности КоА достоверно отличалась от таковой в контроле (28,12 ± 1,02% и 37,0 ± 0,27%, р2-3 < 0,01). Следовательно, активность КоА у детей с холестатическими изменениями в билиарной системе наступает медленнее, чем у детей с ДЖВП без осадочных образований в желчи. При улучшении показателей активности КоА отмечена положительная динамика в содержании СЖК в крови у пациентов обеих групп наблюдения, однако более выраженная направленность к их нормализации была у больных с ДЖВП без проявлений холестаза (212,0 ± 13,4 мкмоль/л при норме 187,2 ± 25,4 мкмоль/л), данная средняя величина уже достоверно не отличалась от норматива (р1-3 > 0,05). У детей с ДЖВП при выраженных проявлениях холестаза средняя величина содержания СЖК в крови снизилась по сравнению с исходным значением в 2,6 раза и составила 310,0 ± 17,5 при норме 187,2 ± 25,4 мкмоль/л, однако данный показатель еще достоверно отличался от возрастного норматива (р2-3 < 0,01).
Таким образом, явления билиарной недостаточности с нарушением коллоидной структуры желчи требуют пролонгированной и более расширенной метаболической терапии (включение в программу лечения Хофитола или Урсофалька).
Анализ результатов исследований позволил сформулировать рекомендации по метаболической коррекции рецидивов ацетонемических состояний у больных на фоне сопутствующих заболеваний органов пищеварения. В терапию детям с рецидивами ацетонемии необходимо включать пантотеновую кислоту, Унитиол, витамин В6 и Элькар. Использование пантотеновой кислоты и донаторов сульфгидрильных групп в сочетании с активаторами окисления жирных кислот в митохондриях клеток (Элькар) позволяет предупредить развитие дисферментоза и дислипидемии.
В состав метаболического комплекса для профилактики рецидивов ацетонемии включаются пантотенат кальция 100 мг/сутки, Липоевая кислота 25 мг/сутки, витамин В6 30 мг/сутки и Элькар 20% по 14 капель 2 раза в день. Элькар наиболее показан детям с резидуальными последствиями пренатального поражения головного мозга. Препарат обладает детоксицирующим действием, нормализует липидный и углеводный обмен, повышает устойчивость тканей к токсическим продуктам обмена, уменьшает образование кетокислот.
Курс протекторной терапии проводится в течение 1 месяца, 3–4 цикла в год. До назначения протекторной терапии у 42 детей (64,6%) провоцирующими факторами ацетонемии были алиментарные погрешности (избыток жирных блюд и «белого» мяса, богатого пуринами), у 20 детей (30,7%) — физические спортивные перегрузки и у 15 детей (23%) — острые инфекционные заболевания (с лихорадкой, диареей и обезвоживанием). После проведения плановой метаболической коррекции воздействие тех же провоцирующих ситуаций не вызывало у детей ацетонемических состояний.
Клинический пример. Ольга А., 9 лет, поступила в стационар по скорой помощи с диагнозом направления «острый гастроэнтерит».
Жалобы при поступлении на многократную рвоту, боли в животе, повышение температуры до 38,2 °С.
Анамнез болезни. Больна вторые сутки, сначала появилась тошнота, боли в животе, рвота, затем отмечено повышение температуры и жидкий стул. Рвота повторялась после еды и питья.
В приемном покое температура 38 °С, бледность и сухость кожных покровов и слизистых. Язык обложен белым налетом. Резкий запах ацетона изо рта. Питание пониженное, индекс массы тела — 14 при норме 18. Глаза запавшие, пульс 90 в минуту, ритмичный, дыханий 25 в минуту. Тоны сердца приглушены. Дыхание везикулярное. Живот при пальпации болезненный в зоне эпигастрия и пилородуоденальной области. Положительные пузырные симптомы: Ортнера, Мерфи, Керра. Печень и селезенка не увеличены. Стул жидкий. Рвота в приемном покое повторялась трехкратно. Установлен диагноз острой кишечной инфекции.
Анамнез жизни. Ребенок от первой беременности, нормальных родов. Масса при рождении 3450 г, длина 51 см. Закричала сразу, к груди приложена в родильном зале. Период новорожденности без особенностей. На грудном вскармливании до 2 месяцев, затем искусственное вскармливание смесью Нутрилон. Прикормы вводились по возрасту, аппетит был снижен, отмечали повышенную нервную возбудимость и недостаточные прибавки массы тела. В связи с низким аппетитом были частые погрешности в диете. С 3 лет посещала детский сад, переносила частые респираторные инфекции. Каждое ОРЗ сопровождалось подъемом температуры более 38,5 °С, приступами рвот, снижением аппетита. В возрасте 3,5 и 4 лет приступы рвот повторялись. Бактериологические посевы и серологические исследования на острые кишечные инфекции были отрицательные. В 7 лет был выявлен лямблиоз, но излечение от лямблий не привело к ликвидации приступов рвот и болей в животе. В 9 лет обследована у гастроэнтеролога, проведена фиброгастродуоденоскопия, диагностирован распространенный поверхностный гастрит, бульбит.
Семейный анамнез. У матери ребенка хронический гастродуоденит и желчнокаменная болезнь. У бабушки (по материнской линии) — сахарный диабет.
Данные обследования в стационаре. Анализ крови: гемоглобин — 126 г/л; эритроциты — 4,6 × 1012/л; гематокрит — 38 об%; тромбоциты — 330 × 109/л; лейкоциты — 6,5 × 109/л; палочкоядерные — 1%; моноциты — 3%; СОЭ — 8 мм/час.
Анализ мочи — цвет ярко-желтый, относительная плотность — 1018; белок — нет, сахар — нет, лейкоциты — 2–3 в п/зр., соли оксалатов +, ацетон ++++.
Биохимический анализ крови: аланинаминотрансфераза — 13,1 ед.; аспартатаминотрансфераза — 18,2 ед.; сахар крови — 3,5 ммоль/л; мочевина — 6,2 ммоль/л; билирубин общий 16,7 мкмоль/л; амилаза — 47,2 ед., СЖК — 680,3 мкмоль/л; мочевая кислота — 600 мкмоль/л; активность КоА — 9,8% (при средней норме 37%); калий — 3,9 ммоль/л; натрий 134 ммоль/л; хлор — 106 ммоль/л; рН — 7,4.
Реакции непрямой гемагглютинации крови с кишечными и иерсиниозными диагностикумами — отрицательная.
Бактериологические посевы кала на дизентерийную и тифо-паратифозную флору отрицательные. Иммуноферментный анализ кала на ротавирусы — положительный. Копрограмма: консистенция жидкая, крахмал внеклеточный +, крахмал внутриклеточный ++; лейкоциты 10–15 в п/зр.; слизь +++.
Фиброгастродуоденоскоспия: распространенный поверхностный гастрит, поверхностный дуоденит, эрозивный эзофагит. Helicobacter pylori (-).
УЗИ органов брюшной полости: обнаружена деформация желчного пузыря, перетяжка в области шейки, осадочные образования в желчи.
В результате проведенного обследования установлен диагноз острого гастроэнтерита, ротавирусной этиологии. Сопутствующие заболевания: хронический гастродуоденит, поверхностный тип, в фазе обострения. Эрозивный эзофагит. Нутритивная недостаточность 1-й ст. Осложнение: синдром ацетонемии.
Проведенное лечение. Дробное питье минеральной воды Боржоми, чая. В связи с повторными рвотами после питья — инфузия внутривенно 10% раствора глюкозы и раствора Рингера в соотношении 1:1 в объеме 400 мл/сутки в течение первых 2 дней лечения, витамин В6 внутривенно 50 мг, витамин С 200 мг. Витамин В12 внутримышечно по 500 мкг № 3, внутрь Липоевая кислота по 25 мг 2 раза в сутки и пантотенат кальция 100 мг/сутки. После ликвидации рвот назначался Элькар по 28 капель 2 раза в сутки, Маалокс и Гевискон внутрь.
В результате проведенного лечения состояние ребенка улучшилось, температура тела нормализовалась к концу первого дня лечения, рвоты исчезли на вторые сутки терапии, возобновился аппетит и оформился стул на 3-й день госпитализации.
Ребенок выписан в удовлетворительном состоянии с рекомендацией соблюдения диеты стола 1, исключением потребления тугоплавких жиров, шоколада, субпродуктов, «белого» мяса, продолжения приема антацидных и желчегонных препаратов. Для профилактики ацетонемических состояний назначен протекторный комплекс, состоящий из пантотената кальция (100 мг/сутки), Липоевой кислоты (25 мг/сутки), Элькара (20 капель 2 раза/сутки), витамин В6 и В1 (возрастные дозы). Курс лечения в течение 1 месяца (проводить 3 цикла в год). При дальнейшем наблюдении за пациенткой ацетонемические состояния не возобновлялись.
Выводы
- У больных ХГД и сопутствующей ДЖВП выявлено нарушение процессов ацетилирования в печени, связанное с дефицитом КоА.
- Дефицитное коэнзимное ацетилирование обусловливает нарушение процессов бета-окисления жирных кислот с нарастанием их уровня в крови и появлением продуктов их неполного окисления (ацетона, кетоновых тел и др.), что сопровождается развитием эндотоксикоза.
- Негормональный антагонизм СЖК с инсулином при длительном неустранении может быть пусковым механизмом формирования метаболического синдрома у детей, в том числе при его развитии у детей без признаков абдоминального ожирения.
- Ацетилирующая функция печени наиболее значимо нарушается у пациентов с билиарной недостаточностью при обнаружении осадочных образований в желчи.
- К факторам, определяющим эффективность коррекции у детей ацетонемических состояний, относят кофактор А — пантотеновую кислоту, средства — носители сульфгидрильных групп (Липоевая кислота, Унитиол), витамины В1, В6, В12 и энерготропные препараты (Элькар).
- Использование протекторных средств для процессов ацетилирования предупреждает рецидивы ацетонемии у детей.
Литература
- Кретович В. А. Введение в энзимологию. М., 1974. С. 52–55.
- Рябчук Ф. Н. Корригирующая терапия ацетонемических кризов у детей с сочетанной гастродуоденальной патологией. В кн.: Сборник научных трудов «Актуальные вопросы педиатрии». СПб, 2001. С. 110–113.
- Рябчук Ф. Н., Пирогова З. И. Ацетилирующая функция печени и активность субстратного пищеварения у детей с неязвенной диспепсией // Гастроэнтерология Санкт-Петербурга. 2003. № 2–3. С. 145
- Буловская Л. Н. Некоторые процессы ацетилирования в организме человека в норме и при ряде заболеваний нервной системы. Дисс. канд. мед. наук. 1958. С. 55, 85.
- Машковский М. Д. Лекарственные средства. М.: Новая волна. 2007. С. 714, 748.
- Лабори А. Регуляция обменных процессов. Пер. с франц. М., 1970.
- Duncombe W. G. The colorimetric micro-determination of non-esterified fatty acids in plasma. Clin, Chim. Acta. 1964. № 9. Р. 122–125.
- Хорошилов И. Е. Нутриционная и метаболическая терапия в лечении ожирения и кахексии // Гастроэнтерология Санкт-Петербурга. Материалы 14?го Международного Славяно-Балтийского научного форума. СПб: Гастро. 2012. С. 103.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







