Необходимость коррекции дефицита железа у пациентов, длительное время получающих антиагрегантную терапию
А. Л. Верткин, доктор медицинских наук, профессор
А. С. Скотников, кандидат медицинских наук
МГМСУ, Москва
Согласно рекомендациям Американской ассоциации сердца (AHA) и Американского колледжа кардиологов (ACC), а также рекомендациям Европейского общества кардиологов (ECS), в числе прочих препаратов для лечения ишемической болезни сердца (ИБС) должны применяться антиагреганты и антикоагулянты прямого и непрямого действия. Ацетилсалициловая кислота (АСК) в дозе 75 мг/сутки показана всем больным со стабильной стенокардией при отсутствии противопоказаний (желудочно-кишечные кровотечения, аллергия, резистентность к АСК). Доказано, что ежедневное применение АСК в дозе 75–150 мг/сутки у пациентов с высоким риском неблагоприятных сосудистых событий на 32% снижает риск острого инфаркта миокарда, инсульта и внезапной сосудистой смерти, кроме того, на 50% уменьшает риск смерти и инфаркта миокарда при остром коронарном синдроме (ОКС). Именно поэтому терапия АСК рекомендуется всем больным с подозрением на ОКС при отсутствии явных противопоказаний, а основой лечения обострений ишемической (коронарной) болезни сердца, связанных с разрывом атеросклеротической бляшки, является воздействие на тромбообразование внутри сосуда с помощью антитромботических лекарственных средств. Казалось бы, у АСК нет откровенно слабых мест. Однако доказано, что АСК блокирует только один путь активации тромбоцитов (COX-1) и не влияет на блокаду адгезии тромбоцитов к поврежденному эндотелию. Кроме того, АСК повышает риск желудочно-кишечного кровотечения (ЖКК), причем этим же свойством, только в меньшей степени, обладают и ее кишечно-растворимые формы.
ЖКК у больных с сердечно-сосудистыми заболеваниями (ССЗ) по данным разных авторов составляют от 11% до 44% от всех кровотечений из верхнего отдела желудочно-кишечного тракта и сопровождаются высокой летальностью. По данным Верткина А. Л. и соавторов у больных, основной причиной смерти которых являются различные формы ИБС, в 21% случаев выявляются фатальные ЖКК из острых гастродуоденальных эрозий и язв [1]. В особо худшем положении находятся пожилые больные с осложненными формами ССЗ, у которых ЖКК являются непосредственной причиной смерти в 33–40% случаев, в то время как при кровотечении на фоне пептической язвенной болезни летальность при ЖКК не превышает 10% [2].
Более того, у пожилых больных в 16% смертельные ЖКК не диагностируются при жизни [3]. Высокий риск ЖКК традиционно связывают с длительным приемом антиагрегантов и антикоагулянтов с целью вторичной профилактики ССЗ [4]. Установлено, что частоту возникновения ЖКК в 2–3 раза увеличивает длительный прием даже «малых» (50–100 мг) доз АСК [5].
Основной причиной высокого риска ЖКК, помимо возраста, является внезапное ухудшение или обострение хронических форм ИБС, приводящее к развитию ОКС и прогрессированию сердечной недостаточности. Наиболее частой локализацией и источником кровотечений являются эрозии слизистой верхних отделов пищеварительного тракта. Возникающая ишемия слизистой оболочки гастродуоденальной области, снижая факторы ее защиты, вызывает относительную гиперацидность желудка, на фоне которой развивается острое эрозивно-язвенное поражение с последующим ЖКК. Фатальные ЖКК из эрозий или язв слизистой оболочки желудка и двенадцатиперстной кишки выявляют у 21% умерших от различных форм ИБС, в том числе у 10% больных с первичным и у 54% с повторным инфарктом миокарда [6]. Зачастую эти кровотечения протекают субклинически и не приводят к существенным гемодинамическим нарушениям, поэтому на практике они часто не диагностируются. Однако согласно крупным исследованиям (GUSTO, 1999; ASSENT-3, 2006; CAPRIE, 1996; OASIS-5, 2005) даже небольшое кровотечение в 5 раз повышает летальность у пациентов с ОКС в течение первых 30 дней и в 1,5 раза — в последующие 5 месяцев после состоявшегося кровотечения [7–10]. Таким образом, можно предположить, что постгеморрагическая анемия и высокий риск кровотечения являются независимыми факторами риска смертности больных ИБС и ее острых форм.
Кроме того, у подавляющего большинства пациентов с ССЗ диагностируется остеоартроз, по поводу которого больные длительно используют нестероидные противовоспалительные препараты (НПВП). Нередко возникающая при этом НПВП-гастропатия способствует появлению типичных симптомов, ассоциированных с гиперацидностью, а ЖКК, как характерный признак ятрогенного влияния лекарств на слизистую желудка, как правило, при этом не диагностируется. Таким образом, риск ЖКК у больных ИБС является кумулятивным, включающим в себя острые поражения гастродуоденальной слизистой оболочки и НПВП-гастропатию.
Однако на практике у больных ИБС риск ЖКК обычно оценивают с позиций поиска противопоказаний для назначения терапии антикоагулянтами или антиагрегантами. Типичным ограничением при этом считаются анамнестические указания на язвенную болезнь, выявление которых при опросе больного повсеместно приводит к отказу от указанной терапии. Между тем, согласно международным клиническим рекомендациям и консенсусу специалистов, в этой ситуации более оправдана замена АСК на клопидогрел или дополнительное назначение ингибиторов протонной помпы [11].
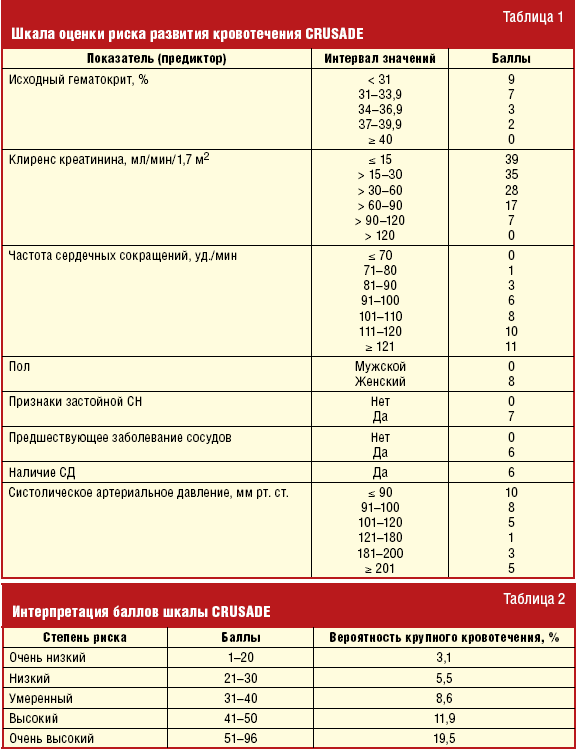
Частота крупных кровотечений при ОКС существенно различается в зависимости от особенностей контингента обследованных больных и проводимой терапии. У ряда пациентов с ОКС повышен риск развития геморрагических осложнений, развитие которых ассоциируют с пожилым возрастом, женским полом и почечной недостаточностью (ESC, 2007). Кроме того, к факторам риска развития кровотечения по данным шкалы CRUSADE относят исходно низкий уровень гематокрита, снижение клиренса эндогенного креатинина, тахикардию, застойную сердечную недостаточность (ЗСН), сахарный диабет (СД), уровень систолического артериального давления (САД) ниже 110 мм рт. ст. и выше 180 мм рт. ст., а также указания на предшествующие заболевания сосудов.
По данным N. Meneveau и F. Schiele хроническая постгеморрагическая анемия встречается у 27% пациентов с ОКС. Эти больные, как правило, имеют тяжелую сопутствующую патологию и менее комплаентны. Смертность данных больных в 4 раза превышает смертность пациентов с ОКС, но без анемии. Частота крупных кровотечений при ОКС существенно различается в зависимости от особенностей клинического течения заболевания и проводимой терапии. Так, по данным регистра GRACE она составляет 2–8%, но может быть и заметно выше при более агрессивном подходе к ведению больных. В роли пускового фактора развития кровотечения обычно выступает внезапное ухудшение или прогрессирующее падение систолической функции сердца при обострении или декомпенсации хронических форм ИБС [12].
ACC, AHA, ESC и ВНОК с целью предотвращения кровотечения при лечении различных форм ИБС рекомендуют врачам предпринимать следующие шаги: корректировать дозу гепарина, используя безопасные препараты (в частности, низкомолекулярные гепарины (НМГ)), сокращать продолжительность антитромботического лечения, а также использовать комбинацию антитромботической и антитромбоцитарной терапии [13–15].
Если риск геморрагических осложнений перевешивает любые потенциальные антиишемические выгоды применения антитромботических средств, то некоторые лекарства вообще следует избегать. К примеру, в рандомизированном исследовании TRITON-TIMI (2007) S. Wiviott и его соавторы показали, что у больных ОКС без подъема сегмента ST (ОКСБПST) с приемом мощного тиенопиридина прасугреля было связано более значимое уменьшение комбинированной конечной точки (инсульт, инфаркт миокарда или смерть), чем с приемом клопидогрела. Однако прием прасугреля не давал никаких преимуществ у пациентов 75 лет и старше, а также у больных с массой тела менее 60 кг, но представлял достоверно высокий риск кровотечения [16].
Чтобы компенсировать кровопотерю, врачи часто прибегают к гемотрансфузии. Долгое время она считалась полезной для тяжелобольных пациентов, а поэтому переливание крови для поддержания уровня гематокрита у больных ИБС с анемией оказалось под пристальным вниманием. По данным W. Wu проведение гемотрансфузии улучшает течение ИБС и прогноз пациентов с анемией [17]. Однако в исследовании S. Rao показано потенциально пагубное воздействие переливания крови при различных формах ИБС. Смертность в больнице и в течение 30 дней после выписки из стационара были значительно выше у пациентов, получавших переливания [18]. Кроме того, в 2009 году американским исследователем E. Jolicoeur и немецким ученым C. Hamm доказано, что истощение 2,3-дифосфоглицерата и оксида азота в длительно хранящихся эритроцитах донора способствует уменьшению доставки кислорода за счет увеличения сродства гемоглобина и кислорода в эритроците, что приводит к микрососудистой обструкции и неблагоприятным воспалительным реакциям [19].
Таким образом, хроническая железодефицитная анемия (ЖДА) отягощает клиническое течение острых и хронических форм ИБС и ухудшает прогноз этой категории пациентов. Значимость анемии в прогнозе сосудистых больных диктует необходимость стратификации риска этих пациентов и определения у них риска развития тромботических и геморрагических осложнений. Стратификация риска у больных ИБС имеет принципиальное значение в выборе стратегии лечения и агрессивности антитромботической и антитромбоцитарной терапии. Антитромботическая и антитромбоцитарная терапия, назначенная пациентам с ИБС, приводит к уменьшению частоты тромботических осложнений, однако увеличивает частоту развития геморрагических осложнений [20]. При этом даже незначительное состоявшееся кровотечение ухудшает прогноз больных ИБС, а иногда является непосредственной причиной их смерти, что делает одной из главных задачу раннего выявления ЖДА у данной категории пациентов и ее своевременной коррекции.
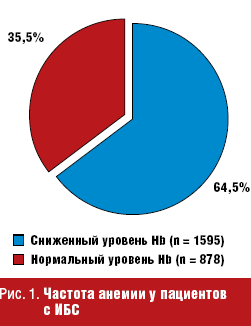
Проведенный авторами скрининг пациентов показал, что из 2473 больных ИБС у 1595 (64,5%) пациентов уровень гемоглобина (Hb) и количество эритроцитов были снижены (рис. 1).
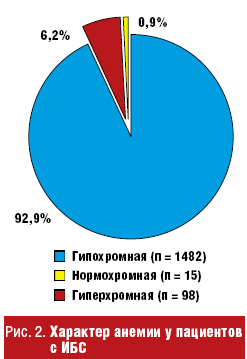
При этом у 1482 больных (92,9%) цветовой показатель меньше единицы, что свидетельствует о гипохромной анемии, у 98 пациентов (6,2%) анемия была гиперхромная, а у 15 больных (0,9%) — нормохромная (рис. 2).
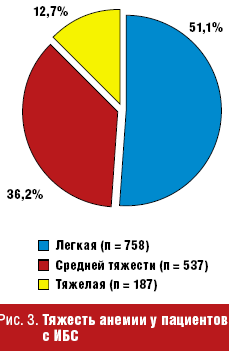
Тяжесть гипохромной анемии также различается: легкая анемия (90 г/л < Hb < 120 г/л) выявлена у 758 человек (51,1%), средней степени (70 г/л < Hb < 90 г/л) — у 537 больных (36,2%), а тяжелая (Hb < 70 г/л) — у 187 пациентов (12,7%) (рис. 3).
У 274 (18,5%) из 1482 больных причиной гипохромной анемии была хроническая почечная недостаточность, вследствие поражения почек при многолетней гипертонической болезни, генерализованном атеросклерозе и СД 2-го типа. У 157 больных (10,6%) анамнестически или в ходе дальнейшего обследования были выявлены злокачественные новообразования различных локализаций, которые и оказались причиной снижения уровня гемоглобина. В 585 историях болезни (39,5%) присутствовали анамнестические указания на кровотечения, способные вызвать постгеморрагическую анемию.
Из всех пациентов с верифицированной постгеморрагической анемией у 147 больных (25,1%) в течение последнего месяца имело место клинически значимое кровотечение, из них у 121 пациента (82,3%) — желудочно-кишечное. В единичных случаях множественные эрозии желудка, сформировавшиеся, вероятно, вследствие приема антиагрегантов, преобразовывались во множественные язвы желудка с перфорацией последних. Смерть наступала от последствий перфорации и осложнений оперативных пособий по данному поводу. Таким образом, тактика ведения больных с ИБС в целом и ОКС в частности зависит от величины риска не только тромботических, но и геморрагических осложнений, которые должны быть оценены клиницистами по специальным шкалам. Предотвращение и скорейшее устранение последствий кровотечения являются ключевыми шагами в установлении баланса между безопасностью и эффективностью лечения ИБС, подразумевающем пожизненное назначение антиагрегантов (табл. 1).
В шкале CRUSADE конкретным значениям фактора (предиктора кровотечения) соотнесено определенное число баллов, суммирование которых дает оценку, позволяющую отнести состояние больного к одной из категорий риска кровотечения. Категории риска развития крупного кровотечения у пациента с ОКСБПST во время госпитализации представлены в табл. 2.
Также существуют данные, отражающие низкую эффективность АСК при СД 2-го типа. Согласно данным клинико-морфологического анализа летальных исходов, имевших место в нехирургических отделениях крупного стационара скорой медицинской помощи Москвы, острый повторный и рецидивирующий инфаркт миокарда становится причиной 2/3 летальных исходов больных ИБС. При этом установлено, что острые язвы или эрозии желудка и двенадцатиперстной кишки у больных с инфарктом миокарда и СД развиваются более чем в 45% случаев, а ЖКК — у 15–20% больных. И, наконец, у 5,5–60% больных, принимающих АСК, по данным разных авторов, развивается резистентность к ней, а значительное число пациентов, длительно получающих терапию АСК, тем не менее, остаются подверженными риску тромботических событий. Среди причин резистентности к АСК обсуждаются низкая приверженность лечению, неадекватная доза, плохая абсорбция в кишечнике (например, при синдроме мальабсорбции), взаимодействие с другими НПВП, нарушения функционального состояния тромбоцитов, единичные нуклеотидные полиморфизмы, взаимодействие тромбоцитов с другими клетками крови, а также иные причины: курение, гиперхолестеринемия, физическая нагрузка или стресс. Кроме того, препараты протонной помпы могут уменьшить эффективность низкой дозы АСК за счет увеличенной ее инактивации желудочно-кишечными эстеразами.
Таким образом, в центре системы профилактики ЖКК у больных ИБС, длительно принимающих АСК, сегодня находится прогнозирование возможного поражения гастродуоденальной слизистой посредством поиска предикторов высокого риска кровотечения, а в случае их выявления — своевременное назначение адекватной антисекреторной терапии на фоне коррекции дефицита железа.
Однако у больных ИБС и ЖДА исследование уровня сывороточного железа врачи проводят лишь в 58,6% случаях. Другие же более специфичные показатели обмена железа (ферритин, трансферрин, общая и латентная железосвязывающая способность сыворотки крови (ЛЖСС)) клиницисты исследуют лишь в 9,4% случаях. Низкая выявляемость анемии закономерно приводит к низкой частоте назначения препаратов железа, которые в стационаре получают около 48,4% пациентов с ИБС и ЖДА, а в первые часы ОКС в отделении кардиореанимации — лишь 23–24%.
Более того, на ЖДА у больных ИБС врачи обращают внимание в основном при значительном снижении уровня гемоглобина, поэтому частота назначения препаратов железа пациентам с легкой анемией крайне мала (6,5%).
Тем временем анемия у сосудистого больного зачастую ассоциируется врачами с высоким риском кровотечения, что вызывает настороженность в отношении назначения адекватной антикоагулянтной и антитромбоцитарной терапии, жизненно важных для данной категории пациентов. Согласно нашим данным, частота назначения антикоагулянтов пациентам с ОКСБПST и больным ОКСБПST с легкой гипохромной анемией составляет 97,1% и 93,1%, что достоверно выше, чем пациентам с ОКС и анемией средней тяжести и тяжелой ЖДА (39,9% и 4,3% соответственно). Спектр назначения больным ОКС и ЖДА антикоагулянтов и препаратов железа представлен в табл. 3.
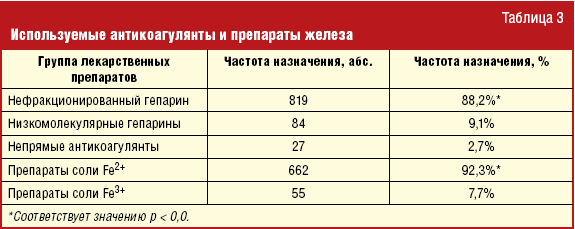
Как видно из таблицы, наибольшее предпочтение в выборе антитромботического препарата клиницисты отдают нефракционированному гепарину (88,2%), в то время как низкомолекулярные гепарины используют лишь в 9,1% случаев. Из 1482 больных АСК была назначена 812 пациентам (69,2%), клопидогрел — 230 (19,6%), а их сочетание — 131 (11,2%) больному. Таким образом, в группе пациентов с ОКСБПST и снижением уровня гемоглобина, ассоциированным с плохим прогнозом и большой вероятностью развития неблагоприятных тромботических событий в ближайшее время, треть пациентов не получает антикоагулянты, а каждый пятый — дезагреганты.
Если говорить о коррекции дефицита железа, то в 92,3% случаев ее проводят препаратами соли двухвалентного железа, среди которых Ферретаб комп. (Lannacher), Сорбифер Дурулес (AstraZeneca), Феррофольгамма (Worwag Pharma) и другие. Препараты соли трехвалентного железа клиницисты назначают больным крайне редко (7,7%). Однако в последние годы сформировалось и укрепилось мнение, согласно которому именно трехвалентное железо является наиболее предпочтительным для пациента с ЖДА, т. к. обладает рядом преимуществ.
Во-первых, препараты трехвалентного железа не обладают раздражающим эффектом на слизистую оболочку верхних отделов желудочно-кишечного тракта и, соответственно, не вызывают ее эрозивно-язвенного поражения, что согласно проведенным нами исследованиям является весьма актуальной проблемой для кардиологических пожилых больных.
Во-вторых, трехвалентное железо не обладает оксидантным эффектом, а потому предотвращает окисление атерогенных фракций липопротеидов и образование свободных радикалов, что также немаловажно для пациентов с многолетним анамнезом ИБС и гиперхолестеринемией. Отсутствие окислительного потенциала также профилактирует потемнение и пожелтение эмали зубов и появление металлического привкуса во рту, которые в случае приема препаратов соли двухвалентного железа зачастую являются причиной отказа пациентов с ЖДА от ее терапии.
В-третьих, в организме человека в обмене железа и его регуляции принимает участие именно трехвалентное железо. При нормальном содержании в организме железа значительная часть его проходит через слизистую оболочку кишки в ток крови, определенная часть задерживается в слизистой. При недостатке железа в слизистой задерживается значительно меньшая его часть, основная часть оказывается в плазме. При избытке железа в организме основная часть железа, проникшего в слизистую оболочку, в ней и задерживается. В дальнейшем эпителиальная клетка, наполненная железом, продвигается от основания к концу ворсинки, затем слущивается и теряется с калом вместе с невсосавшимся железом. Этот физиологический механизм всасывания включается в тех случаях, когда в просвете кишки имеется обычная содержащаяся в нормальной пище концентрация железа. Прекрасно известно, что трехвалентное железо лучше всасывается в кислой окружающей среде, что обеспечивает соляная кислота желудка. Если же у пожилого пациента имеет место ахилия или атрофический гастрит, то Fe3+ перестает усваиваться, а концентрация Fe2+ в кишке в десятки и сотни раз превышает физиологические концентрации, что приводит к всасыванию ионного двухвалентного железа и его избытку в организме. Этот нюанс обязательно следует учитывать при лечении коморбидных больных старшей возрастной группы солями двухвалентного железа [21]. При этом доказано, что прием больших доз препаратов Fe3+ при железодефиците не может привести к избытку железа, т. к. его излишки элементарно не усваиваются организмом. Любому врачу следует аксиоматично помнить постулат: «Трехвалентное железо умеренно всасывается в физиологических концентрациях и абсолютно не всасывается в избыточных» [22].
И, наконец, в-четвертых: железо, содержащее три валентные связи, практически не взаимодействует с другими лекарственными препаратами, которые в больших количествах принимает «сосудистый» больной с инфарктом или инсультом в анамнезе, а данная полипрагмазия оправдана их тяжелым коморбидным статусом.
Лечение ЖДА у пожилых коморбидных больных — это очень важный аспект их комплексной терапии. Один из главных выводов нашей работы заключался в том, что риск развития инфаркта миокарда и смерти у «сосудистых» больных прямо пропорционален степени снижения уровня гемоглобина. Мы обнаружили, что частота развития инфаркта миокарда у пациентов с анемией составляет 25,6%, а без анемии 10,7%, что на порядок ниже. Та же тенденция была зафиксирована в отношении смертельных исходов больных: летальность в группе больных с дефицитом железа примерно на 11% выше, чем у пациентов без анемии. Таким образом, сегодня каждый клиницист должен уделять максимально пристальное внимание показателям обмена железа пациентов с болезнями сердца и сосудов, а также обязан по результатам обследования стараться назначать самые современные эффективные и безопасные препараты трехвалентной соли железа, помня при этом, что анемия является независимым фактором неблагоприятного прогноза больных [24].
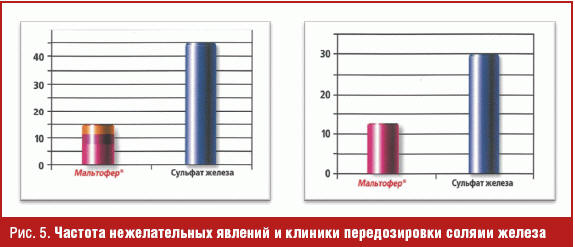
По данным О. В. Зайратьянца ЖКК сегодня стали одной из основных причин расхождения клинического и патолого-анатомического диагнозов, особенно в амбулаторной практике, что лишний раз подчеркивает актуальность данной проблемы и необходимость ее своевременного выявления и устранения [3]. Медикаментозное лечение пациентов с состоявшимся ЖКК наряду с восполнением объема потерянной крови также должно включать в себя коррекцию дефицита железа. Применение Венофера с последовательным переходом на таблетированный препарат трехвалентного железа Мальтофер у больных с постгеморрагической анемией повышает уровень гемоглобина на 13,7 г/л за 6 дней и на 42 г/л за 30 дней. Кроме того, около 10 лет назад доказано, что назначение трехвалентного железа после терапии эритропоэтином, несмотря на серьезную кровопотерю, не приводит к снижению уровня гемоглобина ниже 95 г/л, а в последующем способствует уменьшению дозы эритропоэтина [25]. Таким образом, был впервые сделан вывод, что Венофер не только восстанавливает концентрацию железа и за счет своего особого строения нормализует его обмен, но и является стимулятором эритропоэза. Мальтофер также обладает рядом свойств, дающих ему преимущества перед другими таблетированными препаратами железа. Это, прежде всего, его структурная схожесть с основным переносчиком железа — ферритином, что обеспечивает прочную связь железа и переносчика в ходе обмена железа, а также гипоаллергенность в связи с содержанием декстрина. В доказательной базе препарата Мальтофер одним из основополагающих исследований является работа, в которой авторы показали, что при схожей эффективности таблетированных препаратов двух- и трехвалентного железа Мальтофер обладает несравнимо высоким уровнем безопасности, не вызывая диспепсических расстройств, клиники передозировки солями железа, а также закономерно низким процентом отказа пациентов от проводимой медикаментозной коррекции дефицита железа [26] (рис. 5).
Клинические проявления передозировки железом включают в себя такие симптомы, как боли в эпигастрии, тошнота, кровавая рвота, диарея, бледность кожных покровов, цианоз, судороги, кома, анурия, высокий риск смерти через 3–5 дней, а также некрозы почек и печени. Таким образом, разнообразные причины развития анемии в клинике внутренних болезней требуют комплексного обследования пациентов со сниженным уровнем гемоглобина и их своевременного лечения. Однако клинические проявления синдрома анемии и сидеропении не отличаются особой спецификой и в большинстве случаев основными жалобами больных являются головокружение, шум в ушах, бледность и сухость кожи, сердцебиение, мелькание «мушек» перед глазами, одышка, ломкость ногтей и волос и т. д.
В заключение следует еще раз упомянуть о несомненной, доказанной роли низкого уровня гемоглобина в неблагоприятном прогнозе больных с диаметрально противоположной патологией (исследования OPTIME-CHF, SOLVD, PRAISE, ARIC, RENAAL, CHOIR, TREATE, RED-HF, CHARM, TRIUMPH и т. д.). Таким образом, ЖДА является независимым предиктором худшего прогноза пациентов с соматической патологией и наиболее распространенным осложнением антиагрегантной терапии, что диктует необходимость в комплексном обследовании этой категории больных и требует назначения им своевременной парентеральной и пероральной терапии препаратами соли трехвалентного железа.
Литература
- Верткин А. Л., Круглов В. А., Вовк Е. И., Чудаков С. Ю., Фролова Ю. В., Наумов А. В. Безопасность антиагрегантной терапии // Врач. 2007, № 3, с. 108–112.
- Маев И. В., Самсонов А. А., Вальцова Е. Д., Салова Л. М. Диагностика основных синдромов и заболеваний ЖКТ, печени, желчевыводящих путей. М., 2007.
- Зайратьянц О. В., Полянко Н. И. Итоги работы патологоанатомической службы взрослой сети лечебно-профилактических учреждений департамента здравоохранения города Москвы за 2000–2010 годы. М., 2011.
- Al-Mallah M., Bazari R. N., Jankowski M., Hudson M. P. Predictors and outcomes associated with gastrointestinal bleeding in patients with acute coronary syndromes // J Thromb Thrombolysis. 2007, Feb; 23 (1): 51–55.
- Taylor D. W., Barnett H. J. M., Haynes R. B., Ferguson G. G., Sackett D. L., Thorpe K. E. Low-dose and high-dose acetylsalicylic acid for patients undergoing carotid endarterectomy: a randomised controlled trial // Lancet. 1999; 353: 2179–2184.
- Колобов С. В., Зайратьянц О. В., Попутчикова Е. А. Морфологические особенности острых эрозий и язв желудка у больных инфарктом миокарда // Морфологические ведомости, 2002; 3 (4): 80–82.
- Berger P. B., Ellis S. G., Holmes D. R. Jr., Granger C. B., Criger D. A., Betriu A., Topol E. J., Califf R. M. Relationship between delay in performing direct coronary angioplasty and early clinical outcome in patients with acute myocardial infarction: results from the global use of strategies to open occluded arteries in Acute Coronary Syndromes (GUSTO-IIb) trial // Circulation. 1999, Jul 6; 100 (1): 14–20.
- Sinnaeve P. R., Huang Y., Bogaerts K., Vahanian A., Adgey J., Armstrong P. W., Wallentin L., Van de Werf F. J., Granger C. B. Age, outcomes, and treatment effects of fibrinolytic and antithrombotic combinations: findings from Assessment of the Safety and Efficacy of a New Thrombolytic (ASSENT)-3 and ASSENT-3 PLUS // Am Heart J, 2006, Oct; 152 (4): 684.e1–9.
- CAPRIE Steering Committee A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE) // Lancet. 1996, Nov 16; 348 (9038): 1329–1339.
- Mehta S. R., Yusuf S., Granger C. B., Wallentin L., Peters R. J., Bassand J. P., Budaj A., Joyner C., Chrolavicius S., Fox K. A. Design and rationale of the MICHELANGELO Organization to Assess Strategies in Acute Ischemic Syndromes (OASIS)-5 trial program evaluating fondaparinux, a synthetic factor Xa inhibitor, in patients with non-ST-segment elevation acute coronary syndromes // Am Heart J. 2005, Dec; 150 (6): 1107.
- Heyland D. K., Cook D. J., Schoenfeld P. S., Frietag A., Varon J., Wood G. The effect of acidified enteral feeds on gastric colonization in critically ill patients: results of a multicenter randomized trial. Canadian Critical Care Trials Group // Crit Care Med. 1999, Nov; 27 (11): 2399–2406.
- Meneveau N., Schiele F., Seronde M. F., Descotes-Genon V., Oettinger J., Chopard R. Ecarnot F., Bassand J. P. Anemia for risk assessment of patients with acute coronary syndromes // Am J Cardiol. 2009, Feb 15; 103 (4): 442–447.
- Всероссийское научное общество кардиологов. Рекомендации по лечению острого коронарного синдрома без стойкого подъема сегмента ST на ЭКГ // Кардиология, 2004, № 4 (приложение: 1–28).
- Antman E. M. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction // J Am Coll Cardiol. 2007; 50: e1-e157.
- Bassand J. P., Hamm C. W., Ardissino D. Task Force for Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of European Society of Cardiology. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes // Eur Heart J. 2007; 28: 1598–1660.
- Wiviott S. D., Braunwald E., McCabe C. H. TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes // N Engl J Med. 2007; 357: 2001–2015.
- Wu W. C., Rathore S. S., Wang Y., Radford M. J., Krumholz H. M. Blood transfusion in elderly patients with acute myocardial infarction // N Engl J Med. 2001; 345: 1230–1236.
- Rao S. V., Jollis J. G., Harrington R. A., Granger C. B., Newby L. K., Armstrong P. W., Moliterno D. J., Lindblad L., Topol E. J., Stamler J. S., Califf R. M. Relationship of Blood Transfusion and Clinical Outcomes in Patients With Acute Coronary Syndromes // JAMA. 2004, 292: 1555–1562.
- Jolicoeur E. M., O’Neill W. W., Hellkamp A. APEX-AMI Investigators. Transfusion and mortality in patients with ST-segment elevation myocardial infarction treated with primary percutaneous coronary intervention // Eur Heart J. 2009; 30: 2575–2583.
- Theroux P., Willerson J. T., Armstrong P. W. Progress in the treatment of acute coronary syndromes: a 50?year perspective // Circulation. 2000; 102: IV2-IV13.
- Дворецкий Л. И. Железодефицитные анемии. М., 1998.
- Smith P. Significance of urinary vanillic acid // Nature. 1958, Dec 20; 182 (4651): 1741–1742.
- Кобалава Ж. Д., Дмитрова Т. Б. Кардиоренальный синдром // Русский мед. журнал. 2003, т. 11, № 12, с. 699–702.
- Верткин А. Л., Вилковыский Ф. А., Скотников А. С. Особенности клинического течения, лечения и прогноза ОКСБПST у пациентов с железодефицитной анемией // Медицинский совет. 2010, № 11–12, с. 25–33.
- Шалина Р. И., Бреусенко Л. Е., Кутакова Ю. Ю., Левина А. А. Оценка эффективности применения парентерального препарата железа «Венофер» при железодефицитных состояниях после акушерских кровотечений // Русский мед. журнал. 2003, т. 11, № 1, с. 21–27.
- Jacobs P., Wood I., Bird A. R. // Hematology, 2000, vol. 5, p. 77–83.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







