Источником селена для человека являются продукты питания, вода. На планете выявлены регионы с дефицитом селена, где распространены селенодефицитные заболевания. И недостаток селена, и его избыток неблагоприятны для здоровья человека. Основным органом, использующим селен, является щитовидная железа. В ней содержится наибольшее количество селенопротеинов, которые регулируют процессы образования активных и неактивных форм тиреоидных гормонов, а также защищают щитовидную железу от оксидативного стресса. Селен эффективно снижает уровень антител к тиреопероксидазе (ТПО) у больных с аутоиммунным тиреоидитом, улучшает качество жизни больных с эндокринной офтальмопатией. Исследуется его роль в формировании диффузного и узлового зоба, а также рака щитовидной железы. Проводятся исследования по эффективности включения селена в схемы лечения диффузного токсического зоба. В настоящее время не закончены еще крупномасштабные исследования по влиянию селена на заместительную дозу левотироксина натрия и качество жизни больных при гипотиреозе. Несмотря на многие нерешенные вопросы, селен уже используется в клинической практике эндокринологов. Основными показаниями для назначения селена являются аутоиммунный тиреоидит и эндокринная офтальмопатия.
Ключевые слова: селен, щитовидная железа, антитела к ТПО, аутоиммунный тиреоидит, диффузный токсический зоб, эндокринная офтальмопатия.
Для цитирования: Шестакова Т.П. Использование селена в медицинской практике // РМЖ. 2017. №22. С. 1654-1659
Shestakova T.P.
Moscow regional research clinical institute named after M.F. Vladimirskiy
Selenium is a microelement, which is part of the enzymes, that play an important role in the work of the thyroid gland, reproductive, immune systems and in carcinogenesis.
People receive selenium from food and water. There are selenium deficient regions on the planet, where selenium deficient diseases are common. Both lack of selenium, and its excess are unfavorable for human health. The main organ that uses selenium is the thyroid gland. It contains the largest amount of selenoproteins that regulate the formation of active and inactive forms of thyroid hormones, and also protect the thyroid gland from oxidative stress. Selenium effectively reduces the level of thyroperoxidase (TPO) antibodies in patients with autoimmune thyroiditis, improves the quality of life of patients with endocrine ophthalmopathy. Its role in the formation of diffuse and nodular goiter, as well as thyroid cancer, is studied. Researches on the effectiveness of including selenium in the treatment of Basedow’s goiter are conducted. At present, large-scale studies on the effect of selenium on the replacement dose of levothyroxine sodium and the quality of life of patients with hypothyroidism have not yet been completed. Despite many unresolved issues, selenium is already used in the clinical practice of endocrinologists. The main indications for the appointment of selenium are autoimmune thyroiditis and endocrine ophthalmopathy.
Key words: selenium, thyroid, autoimmunity, TPO antibody, autoimmune thyroiditis, Graves’ disease, endocrine orbitopathy.
For citation: Shestakova T.P. Use of selenium in medical practice (review) // RMJ. 2017. № 22. P.1654 –1659.
Статья посвящена возможностям использования селена в медицинской практике. Селен – микроэлемент, входящий в состав ферментов, играющих важную роль в работе щитовидной железы, репродуктивной, иммунной систем и в канцерогенезе. Недостаток и избыток селена неблагоприятны для здоровья человека. Основным органом, использующим селен, является щитовидная железа. Селен эффективно снижает уровень антител к тиреопероксидазе (ТПО) у больных с аутоиммунным тиреоидитом, улучшает качество жизни больных с эндокринной офтальмопатией. Селен используется в клинической практике эндокринологов при аутоиммунном тиреоидите и эндокринной офтальмопатии.
Содержание статьи
- 1 Введение
- 2 Источники селена
- 3 Влияние дефицита и избытка селена на здоровье человека
- 4 Роль селена в работе щитовидной железы
- 5 Место селена в лечении и профилактике заболеваний щитовидной железы
- 6 Аутоиммунный тиреоидит
- 7 Селен и диффузный токсический зоб (ДТЗ)
- 8 Селен, диффузный и узловой зоб и рак щитовидной железы
- 9 Селен, общая заболеваемость и смертность
- 10 Применение селена на практике
- 11 Заключение
Введение
Селен – микроэлемент, который впервые был описан в 1817 г. шведским химиком Джоном Берзелиусом. Он относится к 16 подгруппе таблицы химических элементов Д.И. Менделеева, где стоит между мышьяком и бромом, а по своим химическим свойствам похож на серу. Благодаря своей способности отдавать электроны селен широко используется в промышленности. В 1957 г. исследователи Schwartz и Foltz обнаружили, что добавление в пищу селена предупреждало развитие мышечной дистрофии и цирроза печени у крыс [1]. В последующие годы было выявлено, что селен является важным элементом фермента глютатионпероксидазы [2], после чего началось изучение влияния дефицита селена на здоровье человека и возможности использования его в медицинской практике. Была раскрыта его роль в работе иммунной, эндокринной и репродуктивной систем, метаболизме, клеточном гомеостазе, канцерогенезе.
Источники селена
Основным источником селена для человека является пища, следовательно, содержание селена в организме определяется диетическими предпочтениями человека. В свою очередь содержание селена в продуктах питания зависит от места произрастания растений. В среднем содержание селена в почве составляет 0,4 мг/кг [3]. Но эта цифра не постоянна. Она зависит от состава почвы, в т. ч. доли органических веществ в ней, и количества осадков, выпадающих в данной местности [4]. В горных районах (Финляндия, Швеция, Шотландия) в почвах выявляется недостаток селена, тогда как глинистые почвы и почвы в регионах с низким уровнем осадков обычно содержат повышенное количество этого микроэлемента. В большинстве стран Европы, Египте, Бразилии, Индии, Китае, Саудовской Аравии, Непале, Бурундии, Новой Гвинее выявлены отдельные регионы с дефицитом селена. Избыток селена также обнаружен в отдельных регионах Индии, Китая, США, Канады, Бразилии, Венесуэлы, Японии. Для сравнения: в Европе потребление селена в среднем составляет 40 мкг/сут, а в США – 93 мкг/сут для женщин и 134 мкг/сут для мужчин [5].
Селен содержится не только в почве, но и в воде. В среднем концентрация селена в водопроводной воде составляет 10 мкг/л, что определено Всемирной организацией здравоохранения (ВОЗ) как минимальный допустимый уровень селена в питьевой воде. В подводных водах концентрация селена несколько выше, но наибольшего уровня она достигает в морской воде, где составляет от 4000 до 12 000 мкг селена на 1 л [6].
Содержание селена в растениях значительно варьирует. Это зависит не только от места произрастания, но и от способности растений захватывать селен из почвы и аккумулировать его. В целом содержание селена выше в овощах по сравнению с фруктами. Содержание селена в зерновых варьирует от 0,01 до 0,55 мкг/г, в молочных продуктах – от 0,001 до 0,17 мкг/г [7]. По данным бельгийского исследования, главным источником селена для человека являются мясные продукты (31%), затем рыба (19%), хлеб и крупы (11%) [8].
В природе селен существует в виде органических (селенометионин и селеноцистеин) и неорганических соединений (селенит и селенат). Учитывая, что органические формы лучше абсорбируются в ЖКТ, некоторые специалисты рассматривают их как основные для профилактики и лечения заболеваний, вызванных дефицитом селена. Селенометионин содержится в растениях, главным образом в зерновых культурах, а селеноцистеин – в основном в продуктах животного происхождения. В пищевых добавках чаще используют неорганические формы селена. Селен абсорбируется в основном в тонком кишечнике (50–80%) и выводится через почки (60%). Еще 35% выводится через толстый кишечник, 5% – через пот и слюну [9]. По непонятным пока причинам содержание селена ниже у курильщиков и уменьшается с возрастом. Кроме этого, содержание селена ниже у лиц, потребляющих большое количество кофе и алкоголя. Употребление в пищу большого количества риса и яиц также ассоциировано с пониженной концентрацией селена в организме [10]. ВОЗ рекомендует потреблять 50–55 мкг селена в сутки [11].
Влияние дефицита и избытка селена на здоровье человека
Как недостаток селена, так и его избыток опасны для человека. Проявления дефицита появляются при употреблении селена менее 40 мкг/сут, а избытка – при употреблении более 400 мкг/сут [12]. Тяжелый дефицит селена приводит к развитию болезни Кешана, проявляющейся сердечной недостаточностью вследствие кардиомиопатии, атрофией, дегенерацией и некрозом суставных хрящей, лихорадкой. Но и менее выраженный недостаток этого микроэлемента неблагоприятно сказывается на состоянии здоровья человека. Селен действует как каталитический центр нескольких ферментов, таких как глютатионпероксидаза, тиоредуксинредуктаза, йодтирониндейодиназа, защищающих клетку от оксидативного стресса, действия свободных радикалов, укрепляющих иммунную систему, участвующих в метаболизме тиреоидных гормонов и т. д. [7].
В некоторых исследованиях недостаток селена был ассоциирован с повышением риска сердечно-сосудистых заболеваний, который снижался при восполнении дефицита. Селен оказывает антиканцерогенный эффект в отношении предстательной железы, печени, поджелудочной железы, толстого кишечника. Кроме этого, селен участвует в имплантации эмбриона, развитии плаценты, повышении фертильности посредством увеличения подвижности сперматозоидов, синтеза тестостерона и спермы [6].
При потреблении более 400 мкг селена в сутки развивается так называемый селенит. Эта редкая ситуация описана в популяционных исследованиях при хронической интоксикации селеном в регионах с высоким его природным содержанием [13]. Симптомами селенита являются тошнота, рвота, боли в животе, диарея, выпадение волос, хрупкость ногтей, периферическая нейропатия и характерный запах чеснока в выделяемом поте и выдыхаемом воздухе. Описаны случаи развития селенита при передозировке пищевых добавок с повышенным его содержанием [14].
Роль селена в работе щитовидной железы
Особую роль играет селен в работе щитовидной железы. Этот орган содержит наибольшее количество селена в пересчете на 1 г ткани в виде селенопротеинов. Участие селена в синтезе тиреоидных гормонов впервые было заподозрено после исследований, проведенных в Заире, где был выявлен не только тяжелый йодный дефицит, но и выраженный дефицит селена. При этом у населения присутствовали тяжелый микседематозный кретинизм и выраженный интеллектуальный дефицит. После этого было проведено множество исследований по изучению роли селена в работе щитовидной железы. В результате было показано, что селен влияет на синтез тиреоидных гормонов опосредованно через селенопротеины [15] (табл. 1). Главным образом на тиреоидный статус действуют селенсодержащие дейодиназы, которые переводят неактивную форму тиреоидных гормонов (Т4) в активную (Т3) путем удаления одного атома йода из внешнего кольца. Кроме этого, они способны переводить Т4 в неактивную форму гормона – реверсивный Т3, отщепляя один атом йода от внутреннего ядра. 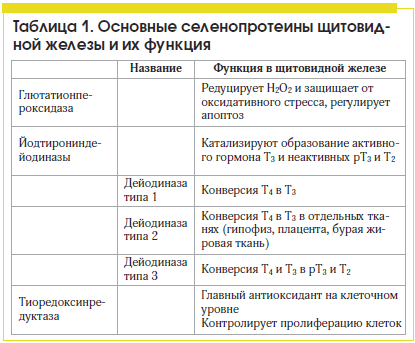
Но этим не ограничивается роль селена в работе щитовидной железы. Так, селенопротеин – глютатионпероксидаза защищает щитовидную железу от оксидативного стресса. Дело в том, что в процессе синтеза тиреоидных гормонов в тиреоцитах накапливается перекись водорода (Н2О2), являющаяся мощным оксидантом. Глютатионпероксидаза обладает способностью инактивировать перекись водорода и свободные радикалы и тем самым ограничивать их повреждающее воздействие на ткань щитовидной железы. Доказано, что при воздействии глютатионпероксидазой снижается концентрация простагландинов и лейкотриенов, что свидетельствует об уменьшении воспаления [16].
При дефиците селена формируется недостаток дейодиназ различных типов, снижается образование Т3, приводящее к стимуляции гипоталамо-гипофизарной оси по системе отрицательной обратной связи и увеличению синтеза тиреотропного гормона (ТТГ). ТТГ стимулирует продукцию тиреоидных гормонов и повышает активность дейодиназ, восстанавливая уровень тиреоидных гормонов. Но при этом он стимулирует образование перекиси водорода, для инактивации которой опять же требуется селенопротеин – глютатионпероксидаза, активность которой в условиях дефицита селена снижена. Перекись водорода накапливается в щитовидной железе, что приводит к повреждению тиреоцитов и развитию фиброза [17, 18]. Повышенное образование перекиси водорода в тиреоците наблюдается во всех случаях избыточной стимуляции щитовидной железы со стороны ТТГ, например, у больных с аутоиммунным тиреоидитом и субклиническим гипотиреозом. В результате наблюдаются повреждение тиреоцитов, прогрессирование гипотиреоза и развитие фиброза. В такой ситуации селенопротеины, обладая антиоксидантной активностью, могут предотвратить или хотя бы затормозить процесс разрушения тиреоцитов и снижения их функциональной активности [15].
Тиоредуксинредуктаза, так же как глютатионпероксидаза, обладает антиоксидантной активностью, но роль этого фермента в работе щитовидной железы менее изучена.
Селенопротеин Р – главный источник селена в плазме, выполняет транспортную функцию и функцию распределения микроэлемента в организме [19]. Он синтезируется в печени и отвечает за удерживание селена в организме и распределение его между органами. Основными органами, в которые поступает из крови селен, являются печень, щитовидная железа, мозг. Однако щитовидная железа и мозг обладают способностью задерживать и накапливать селен даже в условиях дефицита селенопротеина Р [20].
Место селена в лечении и профилактике заболеваний щитовидной железы
Аутоиммунный тиреоидит
Как показали исследования, дефицит селена играет важную роль в повреждении тиреоцитов и снижении их функциональной активности при аутоиммунном тиреоидите. В популяционном исследовании, проведенном Q. Wu et al., было показано, что в регионе с достаточным потреблением селена гораздо реже встречался субклинический гипотиреоз (ОР 0,68; 95% ДИ 0,58–0,93), манифестный гипотиреоз (ОР 0,75; 95% ДИ 0,63–0,90), аутоиммунный тиреоидит (ОР 0,47; 95% ДИ 0,35–0,65). Суммарно распространенность этих заболеваний была почти в два раза меньше в регионе с достаточным обеспечением селеном по сравнению с селенодефицитным районом (18% по сравнению с 30,5%, р
Но способны ли препараты селена предотвратить или хотя бы затормозить развитие аутоиммунного тиреоидита и, впоследствии, гипотиреоза? Однозначного ответа на этот вопрос в настоящее время нет.
В исследованиях больных с аутоиммунным тиреоидитом определялось влияние селена на уровень антитиреоидных антител (к тиреопероксидазе (ТПО) и тиреоглобулину (ТГ)), функцию щитовидной железы, эхогенность ткани щитовидной железы и качество жизни больных (табл. 2). Ни в одной работе не оценивалась частота возникновения гипотиреоза, что, вероятно, обусловлено небольшой длительностью исследований (не более 12 мес.). Применялись в основном органические формы селена, видимо, вследствие их большей биодоступности. 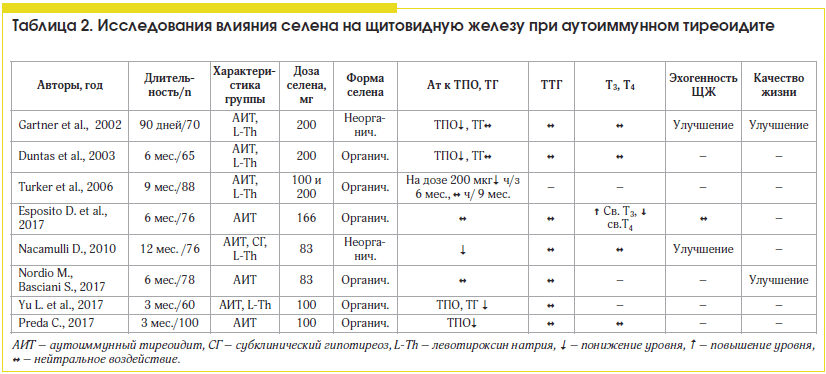
Большинство авторов [22–26] выявили статистически значимое снижение уровня антител к ТПО после применения селена в дозах 83–200 мкг/сут. В исследовании О. Turker et al. было показано, что доза 100 мкг/сут недостаточна для снижения уровня антитиреоидных антител, тогда как доза в 200 мкг была определена как оптимальная. С другой стороны, D. Nacamulli продемонстрировал устойчивое снижение содержания антител к ТПО в результате употребления 83 мкг селена в сутки, причем эффект стойко сохранялся в течение 1 года. Только в одном исследовании было продемонстрировано снижение уровня антител к ТГ, тогда как в большинстве исследований уровень этих антител изменялся незначимо [26].
О. Turker D. et al. обнаружили «ускользание» эффекта, т. к. снижение уровня антител к ТПО продолжалось в течение 6 мес. терапии селеном, но к 9-му мес. уровень антител вновь повысился, хотя и не достиг исходного [27]. Однако в других исследованиях эффект лечения был устойчивым и сохранялся до 12 мес. применения препарата.
Но воздействие на уровень антител было подтверждено не во всех исследованиях на фоне приема тех же доз селена (83–200 мкг/сут) [28, 29].
Не было выявлено какого-либо влияния селена на уровень ТТГ и тиреоидных гормонов. Только в исследовании D. Esposito было обнаружено повышение св. Т3 и снижение св. Т4 в группе больных, принимавших селен, тогда как в контрольной группе отмечалось снижение уровня св. Т3 через 3 и 6 мес. по сравнению с исходным. Такой результат может отражать повышение активности дейодиназ и усиление конверсии Т4 в Т3. Влияние на уровень Т3 проявилось через 3 мес. приема препарата [28].
В исследовании L. Yu в группе больных с гипотиреозом выявлена слабая отрицательная корреляция концентрации селена в крови с ТТГ. Кроме этого, было продемонстрировано, что на фоне селена снижается концентрация интерлейкина-2, что свидетельствует об уменьшении воспаления [26].
В некоторых исследованиях оценивалась выраженность типичных для аутоиммунного тиреоидита изменений ткани щитовидной железы при УЗИ. В двух из трех исследований было выявлено улучшение эхоструктуры, что косвенно свидетельствует об уменьшении аутоиммунного воспаления. Такие позитивные изменения были выявлены в исследованиях, продемонстрировавших одновременно снижение уровня антител к тиреоидной ткани [22, 23]. D. Esposito отметил отсутствие изменений ультразвуковой картины при одновременном отсутствии воздействия на уровень антител [28].
Gartner и Nacamulli оценивали качество жизни больных с аутоиммунным тиреоидитом (АИТ) на фоне приема селена. В обоих исследованиях было выявлено повышение качества жизни, причем отмечалось и снижение уровня антител к ТПО [22, 23].
Некоторые исследователи изучали эффективность комбинации селена с другими препаратами, влияющими на функцию щитовидной железы. Так, у больных с АИТ и эутиреозом, принимавших комбинацию селена и миоинозитола, также влияющего на функцию щитовидной железы, отмечалось значимое снижение уровня и ТТГ, и антитиреоидных антител, тогда как в группе сравнения, в которой пациенты принимали только селен в дозе 83 мкг/сут, таких изменений не было выявлено [29].
Таким образом, в настоящее время получены обнадеживающие данные о снижении уровня антитиреоидных антител при АИТ с помощью селена. Однако требуются дополнительные исследования для формирования рекомендаций по режиму приема препарата и длительности лечения.
Влияние селена на функцию щитовидной железы исследовалось у беременных с повышенным титром антител к ТПО. Известно, что при повышенном уровне антител к ТПО до беременности у женщин значительно увеличивается риск послеродового тиреоидита и развития гипотиреоза во время беременности. Результатами применения 200 мкг селенометионина во время беременности были снижение титра антител к ТПО, улучшение структуры щитовидной железы по данным УЗИ, снижение частоты послеродового тиреоидита и перманентного гипотиреоза в послеродовом периоде [30].
Таким образом, в настоящее время можно считать доказанной роль селена в снижении уровня антитиреоидных антител, особенно антител к ТПО, но не доказана клиническая значимость этого феномена. Кроме этого, только в одном исследовании определялась концентрация селена в крови до и во время приема препаратов селена, что не позволяет определить исходный дефицит микроэлемента и восполнение его во время приема препарата. В настоящее время проводится исследование эффективности селена у больных АИТ со сниженной функцией щитовидной железы. Конечной точкой исследования являются не только уровень антител к ткани щитовидной железы, но и доза заместительной терапии левотироксином натрия, и качество жизни больных. Планируется закончить исследование в 2018 г. [31].
Селен и диффузный токсический зоб (ДТЗ)
К группе аутоиммунных заболеваний щитовидной железы относится ДТЗ. В связи с положительным влиянием селена на уровень антитиреоидных антител проводится изучение его влияния на течение этого заболевания. V. Vrca изучал течение тиреотоксикоза при добавлении селена к традиционной терапии ДТЗ. Применялась фиксированная комбинация 60 мкг селена с другими антиоксидантами: витамином Е, витамином С и бета-каротином. В исследовании было показано, что в группе, получавшей комбинированный селенсодержащий антиоксидантный препарат одновременно с метимазолом, эутиреоз достигался быстрее, чем в группе, принимавшей только метимазол [32]. Но в рандомизированном исследовании М. Leo et al. не было выявлено никаких преимуществ комбинации 166 мкг селена и метимазола перед монотерапией метимазолом [33]. В подобном исследовании J. Calissendorff с применением 200 мкг селенометионина в схеме лечения больных тиреотоксикозом были продемонстрированы более выраженное снижение уровня тиреоидных гормонов и повышение уровня ТТГ [34]. При сравнении этих исследований выявлено только одно различие, которое могло повлиять на результат, – в исследовании J. Calissendorff больные были с подтвержденным лабораторно дефицитом селена. Возможно, что положительное воздействие на лечение тиреотоксикоза селен оказывает только при его дефиците, а при достаточном уровне добавлять его к лечению бессмысленно. Но эта гипотеза требует подтверждения. Кроме этого, возможно, именно комбинация селена с другими антиоксидантами (витамины Е и С) оказывает положительное воздействие.
В другом исследовании селен добавлялся к метимазолу при лечении больных с рецидивом ДТЗ. Были также показаны ускоренное достижение эутиреоза и выраженное снижение уровня антител к рецепторам ТТГ. На заключительном визите большая доля больных в группе, принимавших селен, не имела антител к рецепторам ТТГ, что улучшает прогноз на ближайшее время [35].
Еще одной сферой исследования является использование селена в терапии эндокринной офтальмопатии (болезни Грейвса). Она является одним из клинических проявлений ДТЗ. Это заболевание значительно влияет на качество жизни больных, а применяемые схемы лечения не всегда достаточно эффективны и безопасны. С. Marcocci провел рандомизированное двойное слепое исследование по изучению влияния селена и пентоксифиллина на течение эндокринной офтальмопатии. 152 пациента с эндокринной офтальмопатией были разделены на группы, получавшие селен, пентоксифиллин или плацебо. В исследовании использовали неорганическое соединение селенит натрия в дозе по 100 мкг 2 раза в день. Лечение продолжалось 6 мес. с последующим наблюдением в течение 6 мес. Были сделаны выводы, что использование селена улучшило качество жизни больных, замедлило прогрессирование эндокринной офтальмопатии через 6 мес. лечения. Эффект сохранялся в течение 6 мес. наблюдения. Пентоксифиллин не доказал своей эффективности [36]. Хотя данных явно недостаточно, международная организация EUGOGO, опираясь на это исследование, включила селен в свои рекомендации по лечению легкой степени эндокринной офтальмопатии [37]. Это важно, т. к. для тяжелых форм разработана схема лечения с применением глюкокортикоидов, а для легких форм, которые иногда значительно ухудшают качество жизни больного, ранее не предлагалось какого-либо лечения, а только наблюдение.
В настоящее время продолжается исследование GRASS, планируемое к завершению в 2018 г., которое должно ответить на вопросы, позволит ли добавление селена к терапии болезни Грейвса ускорить достижение эутиреоза, снизить риск рецидива заболевания, улучшить качество жизни больных [38].
Вызывает интерес пилотное исследование по лечению больных с субклиническим тиреотоксикозом комбинацией селена и L-карнитина. Субклинический тиреотоксикоз распространен гораздо больше, чем манифестный, и, по разным данным, составляет от 0,6 до 16% в зависимости от критериев диагностики, возраста больных, обеспеченности региона йодом. Причины субклинического тиреотоксикоза могут быть разными: дебют болезни Грейвса, узловой или многоузловой токсический зоб, тиреотоксическая фаза тиреоидитов и др. Но независимо от причин стойкий субклинический тиреотоксикоз влияет на качество жизни больных, а у пожилых больных значительно увеличивает риск сердечно-сосудистых заболеваний – главным образом фибрилляции предсердий и тромбоэмболических осложнений. До настоящего времени не разработано эффективных и безопасных схем лечения этих больных. При уровне ТТГ 0,1–0,4 мЕд/л рекомендуется тактика наблюдения, тогда как при более низком уровне ТТГ применяется лечение небольшими дозами тиреостатиков и/или бета-блокаторов. Данное исследование было запланировано как пилотное, и количество больных было небольшим (n=18), что позволяет сделать только предварительные выводы. В результате применения 83 мкг селена и 500 мг L-карнитина в течение 1 мес. удалось значимо повысить уровень ТТГ почти до нормальных величин, снизить уровень антител к ТПО и ТГ, уменьшить клинические проявления тиреотоксикоза, такие как дрожь, сердцебиение, слабость. Лечение длилось в течение 1 мес., и через 1 мес. наблюдения после отмены терапии было зафиксировано возвращение гормональных показателей и клинических проявлений на исходный уровень, что продемонстрировало недостаточную продолжительность лечения. Побочных эффектов не было зафиксировано. Конечно, требуется более масштабное исследование, но данное пилотное исследование внушает надежду на разработку эффективной и безопасной схемы лечения больных с субклиническим тиреотоксикозом [39].
Селен, диффузный и узловой зоб и рак щитовидной железы
Некоторые исследователи изучали влияние селена на формирование зоба – как диффузного, так и узлового. В большинстве своем исследования малочисленные, но предполагается, что существует обратная связь между уровнем селена в крови и моче и объемом щитовидной железы и гипоэхогенностью. Так, L. Rasmussen et al. установили, что низкая концентрация селена в крови в сочетании с дефицитом йода ассоциирована с повышенным риском формирования как диффузного зоба, так и узлов в щитовидной железе [40].
Наиболее крупное исследование в этой области провели Q. Wu et al. В исследовании приняли участие более 6000 человек. Целью исследования было сравнение распространенности заболеваний щитовидной железы в регионах Китая с различной обеспеченностью селеном. Было обнаружено, что высокий уровень селена ассоциирован с более низкой частотой зоба (ОР 0,75, 95% ДИ 0,59–0,97) [21].
Таким образом, в настоящее время получены предварительные данные о большем распространении диффузного и узлового зоба в регионах с пониженным потреблением селена. Но требуются исследования, подтверждающие, что добавление селена способно предотвратить развитие АИТ и многоузлового зоба.
В нескольких исследованиях изучалась ассоциация рака и низкого уровня селена в крови и моче. Было выявлено, что частота рака при дефиците селена возрастает. Был проведен метаанализ 8 исследований с участием более чем 1200 пациентов, в которых изучалась связь уровня некоторых микроэлементов (селена, меди и магния) с раком щитовидной железы (РЩЖ). Было показано, что пациенты с РЩЖ имеют сниженный уровень селена и магния и повышенный уровень меди по сравнению со здоровыми людьми, составлявшими группу контроля [41]. J. Jonklaas в своем исследовании на 65 больных, подвергшихся тиреоидэктомии по поводу РЩЖ и узлового зоба, подтвердил, что недостаток селена ассоциируется с высокой степенью рака. Точные механизмы воздействия дефицита селена на развитие рака пока неизвестны, но предполагается, что недостаток селеноэнзимов приводит к увеличению свободных радикалов, способствующих канцерогенезу и прогрессированию заболевания [42].
Селен, общая заболеваемость и смертность
Некоторые исследования показали, что существует U-образная зависимость между концентрацией селена в крови и общей заболеваемостью, т. е. на заболеваемость влияет как недостаток, так и избыток селена [43]. Другими словами, дополнительное введение селена благоприятно при существующем его дефиците, но употребление дополнительно препаратов селена в отсутствие дефицита может приводить к различным побочным эффектам, например, гипергликемии и ускорению прогрессирования атеросклероза [44, 45].
Смертность от всех причин также возрастает при дефиците либо избытке селена. В исследовании с участием более 13 тыс. пациентов и длительностью 12 лет была показана слабая положительная ассоциация между уровнем селена, превышающим 150 нг/мл, и общей смертностью, а также смертностью от рака [46].
Применение селена на практике
Несмотря на то, что данные об эффективности селена довольно противоречивы, он уже применяется в реальной клинической практике. В Италии был проведен опрос эндокринологов об их опыте применения селена. В опросе приняло участие 778 врачей. 85,2% опрошенных указали, что они используют селен в лечении больных, причем около 30% назначают его часто, основной нозологией для назначения селена являлся АИТ. Две трети опрошенных назначали селен при субклиническом гипотиреозе у больных с АИТ. Одна пятая часть респондентов использовала этот микроэлемент в схеме лечения легкой эндокринной офтальмопатии. Большинство врачей использовали дозы от 100 до 200 мкг селена в сутки [47].
Примером селенсодержащего средства является биологически активная добавка Оксилик, содержащая 50 мкг селена. Также в состав Оксилика входят витамины С и Е, ликопин и β-каротин. Именно комбинация селена с другими витаминами с антиоксидантной активностью продемонстрировала свою эффективность при лечении аутоиммунных заболеваний щитовидной железы [32]. Это, вероятно, объясняется синергизмом их действия.
Оксилик обладает высокой синергидной комбинацией антиоксидантов в дозах, соответствующих физиологической потребности в них. Компоненты окружены комплексом фосфолипидов, что является высокотехнологичной фармацевтической методикой изготовления такого рода средств и значительно повышает всасываемость в желудочно-кишечном тракте.
Заключение
В настоящее время определены области эндокринологии, в которых применение селена может быть благоприятным. Это аутоиммунные заболевания щитовидной железы (аутоиммунный тиреоидит, болезнь Грейвса), узлы щитовидной железы и РЩЖ. Кроме того, показано неблагоприятное воздействие дефицита селена на общую смертность. Однако с учетом побочных эффектов селена при его передозировке необходима разработка эффективных и безопасных схем лечения, требующая дополнительных исследований в этой области.
Литература
1. Rayman M.P. The importance of selenium to human health // Lancet. 2000. Vol. 356. P. 233–241.
2. Rotruck J. T., Pope A.L., Ganther H. E. et al. Selenium: biochemical role as a component of glutathione peroxidase // Science. 1973. Vol. 179. P. 588–590.
3. Hartikainen H. Biogeochemistry of selenium and its impact on food chain quality and human health // J. Trace Elem. Med. Biol. 2005. Vol. 18. P. 309–318.
4. Sors T.G., Ellis D.R., Na G.N. et al. Analysis of sulfur and selenium assimilation in Astragalus plants with varying capacities to accumulate selenium // Plant J. 2005. Vol. 42. P. 785–797.
5. Rayman M.P. Selenium and human health // Lancet. 2012. Vol. 397(9822). P. 1256–1268.
6. Mehdi Y., Hornick J. L., Istasse L., Dufrasne I. Selenium in the environment, metabolism and involvement in body functions // Molecules. 2013. Vol. 18. P. 3292–3311.
7. Gupta M., Gupta S. An overview of selenium uptake, metabolism, and toxicity in plants // Frontiers in plants science. 2017. Vol. 7. P. 2074.
8. Waegeneers N., Thiry C., De Temmerman L., Ruttens A. Predicted dietary intake of selenium by the general adult population in Belgium. Food Additives and Contaminants. Part A // Chemistry, Analysis, Control, Exposure and Risk Assessment. 2013. Vol. 30(2). P. 278–285.
9. Duntas L.H., Benvenga S. Selenium: an element for life // Endocrine. 2015. Vol. 48(93). P. 756–775.
10. Prk K., Rimm E., Siscovick D. et al. Demographic and lifestyle factors and selenium levels in men and women in U.S // Nutrition research and practice. 2011. Vol. 5(4). P. 357–364.
11. WHO. Global Health Risks: Mortality and Burden of Disease Attributable to Selected Major Risks. Available online at: http://www.who.int/healthinfo/global_burden_disease/GlobalHealth. 2009:Risks_report_annex.pdf (Accessed March 5, 2014).
12. Winkel L.H., Johnson C.A., Lenz M. et al. Environmental selenium research: From microscopic processes to global understanding // Environ. Sci. Technol. 2012. Vol. 46. P. 571–579.
13. Agency for toxic substances and disease registry (ATSDR). Toxicologic profile for selenium. Atlanta, GA, USA: US department of health and human services // Public health service. 2003.
14. MacFarquhar J.K., Broussard D.L., Melstrom P. et al. Acute selenium toxicity associated with a dietary supplement // Arch Intern Med. 2010. Vol. 170(3). P. 256–261.
15. Ventura M., Melo M., Carrilho F. Selenium and thyroid disease: from pathophysiology to treatment // Intrnational J of Endocrinologl. 2017. Vol. 1297658. doi: 10.1155/2017/1297658.
16. Spallholz J.E., Boylan L.M., Larsen H.S. Advances in understanding selenium’s role in the immune system // Acad sci. 1990. Vol. 587. P. 123–139.
17. Schomburg L. Selenium, selenoproteins and thyroid gland: interactions in health and disease // Nature reviews endocrinology. 2012. Vol. 8(3). P. 160–171.
18. Saranac L., Zivanovic S., Bjelakovic B. et al. Why is the thyroid so prone to autoimmune disease? // Hormone research in pediatrics. 2011. Vol. 75(3). P. 157–165.
19. Schweizer U., Streckfuss F., Pelt P. et al. Hepatically derived selenoprotein P is key factor for kidney but not for brain selenium supply // Biochemical Journal. 2005. Vol. 386(2). P. 221–226.
20. Schomburg L., Riese C., Michaelis M., et al. Synthesis and metabolism of thyroid hormones is preferentially maintained mice // Endocrinology. 2006. Vol. 147(3). P. 1306–1313.
21. Wu Q., Rayman M.P., Lu H., Schomburg L. et al. Low population selenium status is associated with increased prevalence of thyroid disease // J Clin Endocrinol Metab. 2015. Vol. 100. P. 4037–4047.
22. Gatner R., Gasnier B.C., Dietrich J.W. et al. Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations // The Journal of clinical endocrinology and Metabolism. 2002. Vol. 87(4). P. 1687–1691.
23. Nacamulli D., Mian C., Petricca D. et al. Influence of physiological dietary selenium supplementation on the natural course of autoimmune thyroiditis // Clinical Endocrinology. 2010. Vol. 73(4). P. 535-539
24. Duntas L.H., Mantzou E., Koutras D.A. Effect of a six month treatment with selenomethionine in patients with autoimmune thyroiditis // European Journal of Endocrinology. 2003. Vol. 148(4). P. 389–393.
25. Preda С., Vasiliu I., Mihalache L. et al. Selenium- Essential Antioxidant Element .The example of autoimune thyroiditis // Rev.Chim. 2017. Vol. 68(7). P. 1617–1621.
26. Yu L., Zhou L., Xu E. et al. Levothyroxine monotherapy versus levothyroxine and selenium combination therapy in chronic lymphocytic thyroiditis // J Endocrinol Invest. 2017. doi: 10.1007/s40618-017-0693-z.
27. Turker O., Kumanliglu K., Karapolat I., Dogan I. Selenium treatment in autoimmune thyroiditis: 9-month follow-up with variable doses // The Journal of Endocrinology. 2006. Vol. 190(1). P. 151–156.
28. Esposito D., Rotondi M., Accardo G. et al. Influence of short-term selenium supplementation on the natural course of Hashimoto’s thyroiditis: clinical results of a blinded placebo-controlled randomized prospective trial // J Endocrinol Invest 2017. Vol. 40. P. 83–89.
29. Nordio M., Basciani S. Myo-inositol plus selenium supplementation restores euthyroid state in Hashimoto’s patients with subclinical hypothyroidism // European review for medical and pharmacological sciences. 2017. Vol. 21(2 suppl). P. 51–59.
30. Negro R., Graco G., Mangieri T. et al. The influence if selenium supplementation on postpartum thyroid status in pregnant women with thyroid peroxidase autoantibodies // The Journal of Clinical Endocrinology and Metabolism. 2007. Vol. 92(4). P. 1263–1268.
31. Winther K.H., Watt T., Bjorner J.B. et al. The cronic autoimmune thyroiditis quality of life selenium trial (CATALYST): study protocol for a randomized controlled trial // Trials. 2014. Vol. 15. P. 115.
32. Vrca V.B., Skreb F., Cepelak I. et al. Supplementation with antioxidants in the treatment of Graves’ disease; the effect on glutathione peroxidase activity and concebtration of selenium // Clinica Chimica Acta. 2004. Vol. 34191-20. P. 55–63.
33. Leo M., Bartalena L., Rotondo Dottore G. et al. Effects of selenium on short term control of hyperthyroidism due to Graves’ disease treated with methimazole: results of a randomized clinical trial // J Endocrinol Invest. 2017. Vol. 40(3). P. 281–287.
34. Calissendorff J., Mikulski E., Larsen E.H., Möller M. A prospective investigation of Graves’ disease and selenium: thyroid hormones, auto-antibodies and self-rated symptoms // Eur Thyroid J. 2015. Vol. 2. P. 93–98.
35. Wang L., Wang B., Chen S.R. et al. Effect of selenium supplementation on recurrent hyperthyroidism caused by Graves’ disease: a prospective pilot study // Hormone and Metabolic research. 2016. Vol. 48(9). P. 559–564.
36. Marcocci C., Kahaly G.J., Krassas G.E. et al. Selenium and the caurse of mild Graves’ orbitopathy // The New Englaand Journal of Medicine. 2011. Vol. 364(20). P. 1920–1931.
37. Bartalena L., Baldeschi L., Boboridis K. et al. The 2016 European Thyroid Association|European Group on Graves’ Orbitopathy Guidelines for the Management of Graves’ Orbitopathy // European Thyroid Journal. 2016. Vol. 5(1). P. 9–26.
38. Watt T., Cramon P., Bjorner J.B. et al. Selenium supplementation for patients with Graves’ hyperthyroidism (the GRASS trial): study protocol for a randomized controlled trial // Trials. 2013. Vol. 30(14). P. 119.
39. Nordio N. A novel treatment for subclinical hyperthyroidism: a pilot study on the beneficial effects of l-carnitine and selenium // European Review for Medical and Pharmacological Sciences. 2017. Vol. 21. P. 2268–2273.
40. Rasmussen L.B., Schomburg L., Kohrle J., et al. Selenium status, thyroid volume, and multiple nodule formation in area with iodine deficiency // European Journal of Endocrinology. 2011. Vol. 164(4). P. 585–590.
41. Shen F., Cai W.S., Li J.L. et al. The association between serum levels of selenium, copper, and magnesium with thyroid cancer: a meta-analysis // Biological trace element research. 2015. Vol. 167(2). P. 225–235.
42. Jonklaas J., Danielsen M., Wang H. A pilot study of serum selenium, vitamin D, and thyrotropin concentration in patient with thyroid cancer // Thyroid. 2013. Vol. 23(9). P. 1079–1086.
43. Rayman M.P., Stranges S. Epidemiology of selenium and type 2 diabetes: can we make sense of it? // Free radical BiologyandMedicine. 2013. Vol. 65. P. 1557–1564.
44. Stranges S., Navas-Acien A., Rayman M.P., Guallar E. Selenium status and cardometabolic health: state of the evidence // Nutrition, Metabolism, and Cardivascular diseases. 2010. Vol. 20(10). P. 754–760.
45. Rocourt C.R., Cheng W.H. Selenium supranutrition: are the potential benefits of chemoprevention outweighed by the promotion of diabetes and insulin resistance? // Nutrients. 2013. Vol. 5(4). P. 1349–1365.
46. Bleys J., Navas-Acien A., Guallar E. Serum selenium levels and all-cause, cancer, and cardiovascular mortality among US adult // Archives of Internal Medicine. 2008. Vol. 168(4). P. 404–410.
47. Negro R., Attanasio R., Grimaldi F. et al. A 2016 Italian Survey about the Clinical Use of Selenium in Thyroid Disease // Eur Thyroid J. 2016. Vol. 5. P. 164–170.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






